肝硬化合并门静脉血栓的危险因素及PLT、DD对其形成的预测价值
2022-09-03熊雪丽
熊雪丽
肝硬化是一类较常见的慢性肝病,主要病理特征为肝细胞弥漫性坏死、肝脏纤维组织增生,临床表现多为肝功能减退、门静脉高压等[1]。一般患者被确诊肝硬化,提示该患者肝病已属晚期。门静脉血栓(portal vein thrombosis,PVT)是肝硬化的一种并发症,主要指门静脉主干、分支发生血栓,伴或不伴肠系膜静脉和脾静脉血栓形成[2]。急性PVT 可导致肝腹水、肠坏死、消化道出血、休克甚至死亡,临床上检查PVT 主要靠多普勒超声、磁共振等影像学手段。PVT 起病隐匿,特异性不强,早期准确预测PVT 对于其防治意义重大[3⁃4]。近些年关于肝硬化合并PVT 的危险因素研究并不少见,其危险因素较多,主要因素尚不完全明晰[5⁃6]。D⁃二聚体(D⁃dimer,DD)是一种反映机体纤溶功能的分子标志物,有研究发现肝硬化PVT 患者DD 水平较高,可能是导致PVT 发生的危险因素[7]。血小板(platelets,PLT)减少被看作是慢性肝病的典型特征,肝硬化患者由于肝脏PLT 生成素分泌减少或脾功能亢进,导致PLT 生成明显下降[8]。本研究分析肝硬化合并PVT 的影响因素,以及DD 与PLT 对肝硬化PVT 的预测价值,以期为PVT 的预防诊治提供可靠的建议。
1 资料与方法
1.1 资料
选取2019年3月至2021年3月本院收治的87例肝硬化患者作为研究对象,根据是否合并PVT分为PVT 组(n=17)和非PVT 组(n=70)。纳入标准:①符合临床对肝硬化的最新诊断标准[9],经影像学确诊;②PVT 的诊断标准符合《肝硬化门脉高压食管静脉曲张出血防治共识》[10]。③患者对研究了解知情,签署知情同意书。排除标准:①合并心、肺、肾等脏器严重器质性病变;②既往有肝移植手术史;③恶性肿瘤;④抗凝治疗禁忌证;⑤肝癌;⑥患有精神类疾病;⑦临床病理资料不齐。本研究符合《赫尔辛基宣言》的原则。
1.2 方法
1.2.1 资料收集
利用医院信息系统查询患者年龄、性别以及肝硬化病程、发病原因、脾脏切除史、Child⁃Pauh 分级[11]等一般临床资料,记录患者白细胞(White blood cell,WBC)计数。
1.2.2 血液学指标
入组后第2 d 清晨采集全部患者的空腹静脉血4 mL,静置1 h,使用低速离心机(中科中佳,SC⁃3616,离心半径10 cm)于室温中1 500 r/min 离心20 min,分离血浆,采用全自动凝血仪(日本SYSMES 公司)检测患者血浆DD 水平、血浆凝血酶原时间(Prothrombin time,PT)和PLT 水平。
1.3 统计学方法
采用SPSS 20.0 统计学软件进行统计分析,采用Logistics分析肝硬化患者PVT 的影响因素,对正态分布的计量资料以()表示,组间比较采用独立样本t检验;计数资料用n(%)表示,组间比较用χ2检验;采用ROC 曲线分析DD、PLT、PT 对肝硬化合并PVT 的预测价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 影响肝硬化合并PVT 的单因素分析
结果显示,PVT 组的脾脏切除史占比和PLT、DD、PT 水平均高于非PVT 组,差异有统计学意义(P<0.05),PVT 组与非PVT 组的年龄、性别、Child⁃Pauh 分级、肝硬化病因、肝硬化病程以及WBC 水平比较,差异无统计学意义(P>0.05)。见表1。
表1 影响肝硬化合并PVT 的单因素分析[n(%),(±s)]Table 1 Single factor analysis of PVT influencing livercirrhosis[n(%),(±s)]
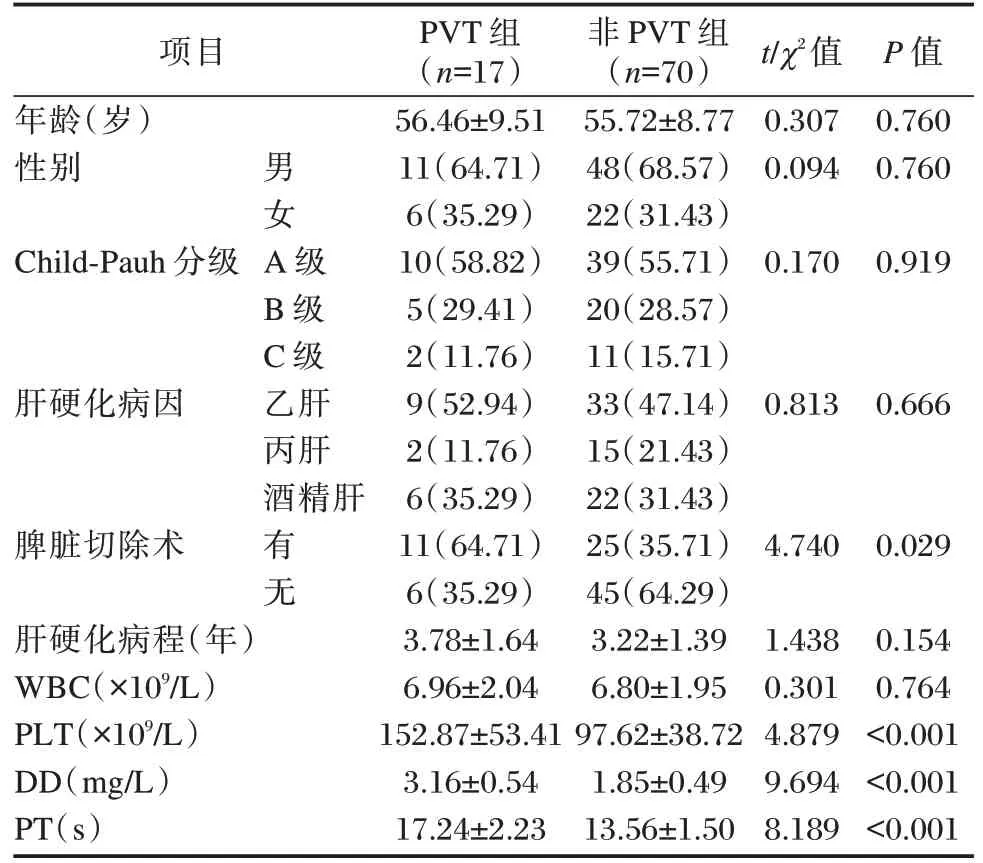
表1 影响肝硬化合并PVT 的单因素分析[n(%),(±s)]Table 1 Single factor analysis of PVT influencing livercirrhosis[n(%),(±s)]
?
2.2 影响肝硬化合并PVT 的多因素分析
结果显示,PLT、DD、脾脏切除术及PT 是影响肝硬化患者合并PVT 的危险因素(P<0.05)。见表2。

表2 影响肝硬化合并PVT 的多因素分析Table 2 Analysis of multiple factors affecting liver cirrhosis with PVT
2.3 PLT、DD 以及PT 对肝硬化患者合并PVT 的预测价值
结果显示,PLT、DD 和PT 预测肝硬化合并PVT 的AUC 分别为0.725(95%CI:0.619~0.816),0.810(95%CI:0.712~0.887)、0.743(95%CI:0.638~0.831),其中PT 的灵敏度最高(0.710),DD 的特异度最好(0.911)(Z=3.831、6.332、4.020,P<0.05)。见表3、图1。
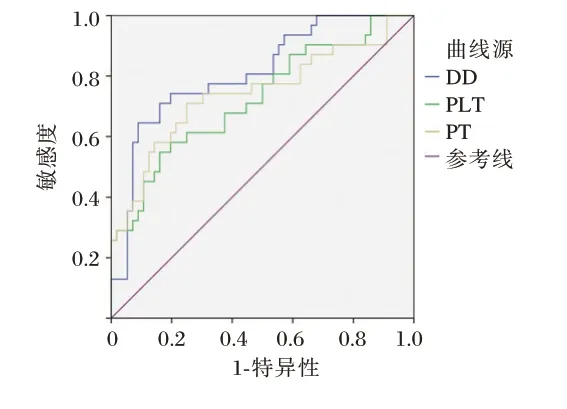
图1 PLT、DD 以及PT 预测肝硬化患者合并PVT 的ROC 曲线Figure 1 ROC curve of PLT,DD and PT predicting PVT in patients with liver cirrhosis
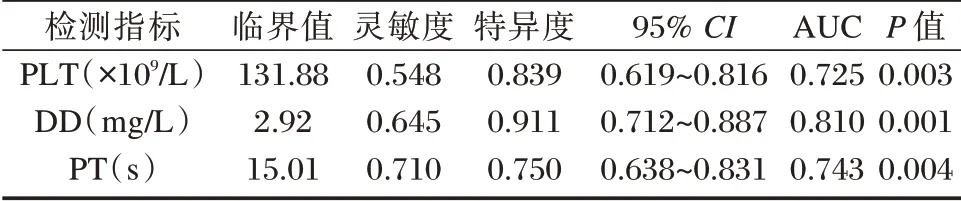
表3 PLT、DD 以及PT 对肝硬化患者合并PVT 的预测价值Table 3 The predictive value of PLT,DD and PT in patients with liver cirrhosis combined with PVT
3 讨论
PVT 是肝硬化终末期较常见的并发症,若未能及时得到有效治疗,极易引发肝腹水、消化道出血等并发症,危及患者生命安全。研究显示,肝硬化患者合并PVT 发生率可达11.2%[12]。而本次研究中,87例肝硬化患者,合并PVT 17 例,发生率为19.54%,与上述研究存在一定出入,这可能与本研究样本量偏少有关。然而由于肝硬化合并PVT 前期表现并不典型,现有影像学检测手段亦无法有效鉴别血栓新旧,因而比较难判断PVT 发生的时间,不利于防治工作的进行。早期精准预测PVT,对于肝硬化患者的病情进展观察以及预防工作的开展有重要的临床意义。
本次研究发现,PVT 组的PLT、DD、PT 等血液学指标水平显著高于非PVT 组患者,提示肝硬化合并PVT 患者血液处于高凝状态。国外研究显示,接受脾切除术的肝硬化患者,术后PVT 发生率可达37%,并且PLT 增加也是导致肝硬化患者发生PVT 的危险因素[13]。国内也有研究显示,门脉高压术后患者的DD 水平上升,DD 水平是肝硬化患者发生PVT 的危险因素[14],与本研究结论一致。进一步Logistics回归分析显示,PLT、DD、PT 及脾脏切除术是导致肝硬化患者发生PVT 的独立危险因素。分析原因,可能是切除脾脏后,脾静脉形成盲端,脾静脉血流速度减缓甚至停滞,导致门静脉系统处于低流高阻状态,极大增加了发生PVT 的风险;同时切除术过程产生的创伤、炎症反应等均可能导致血管内皮受损,促使PLT 凝集而形成PVT。另外,高水平DD 意味着肝硬化患者出现纤溶亢进,存在凝血紊乱现象,也使得PVT 发生的风险上升;PT 一般反映患者外源性凝血因子的变化,PT 值升高提示肝硬化患者外源性凝血途径受到影响,也可能导致PVT 风险增加。这一结果说明临床早期应注意监测肝硬化患者的PLT、DD、PT 水平,筛查脾脏切除史,预防PVT 的形成。
本研究发现,PLT、DD、PT 预测肝硬化患者合并PVT 的AUC 为0.725、0.810、0.743,同时DD 与PT 具有较高的灵敏度和特异度,提示PLT、DD、PT可有效预测肝硬化合并PVT。Yang 等学者[15]认为PLT 能通过一种胞内蛋白(雷帕霉素靶蛋白复合物)调节PVT 的形成过程,对PVT 具有一定的预测价值。国内相关研究显示PT 预测肝硬化PVT的灵敏度和特异度为77.5%和69.9%;该研究还发现,DD 预测PVT 的特异度为89.3%、灵敏度为86.6%[16]。国外研究显示,高水平DD 表示凝血纤溶功能异常,而门静脉主干内径变宽造成门静脉高压,使得患者凝血、抗凝平衡被打破,因此DD对肝硬化合并PVT 具有不错的灵敏度和特异度[17]。较早前国外报道显示DD 对PVT 的阴性预测率可达98%[18]。上述研究均说明了PLT、PT 和DD 对肝硬化PVT 有良好的预测价值,与本研究结论一致。
综上,临床应重视高PLT、DD 水平和脾脏切除史的肝硬化患者,监视PVT 的形成,同时联合PLT、DD、PT 预测,为预防PVT 提供参考依据。
