小鼠肝组织经胶原酶Ⅳ不同时长原位消化后Kupffer细胞的分选效果及其肿瘤细胞吞噬功能观察
2022-09-02李洁翟克超刘永达袁继行
李洁,翟克超,刘永达,袁继行
海军军医大学基础医学院医学遗传学教研室,上海 200433
正常的肝脏主要包括肝细胞、肝血窦内皮细胞、Kupffer 细胞以及肝星状细胞等[1]。Kupffer 细胞是肝脏特有的巨噬细胞,也是体内最大的常驻组织巨噬细胞群,其通过吞噬作用和抗原提呈作用在天然免疫应答中发挥重要功能[2-3]。在肝脏发生病变时,Kupffer 细胞的功能也相应发生改变,甚至发挥截然相反的作用。因此,进一步揭示Kupffer 细胞在肝脏稳态的维持以及疾病中的作用具有重要意义,而体外高效获取Kupffer 细胞有助于研究的开展。小鼠Kupffer 细胞分离纯化最常用的方式是胶原酶原位肝脏灌注消化肝组织,并利用Percoll 进行密度梯度分离获取肝脏非实质细胞(NPC),使用贴壁法或免疫细胞磁珠分选(MACS)或流式细胞分选(FACS)获取最终的Kupffer 细胞[4-6]。胶原酶Ⅳ对细胞损伤较小,适合进行肝脏细胞提取。但预实验中发现胶原酶Ⅳ消化过长时间会影响NPC 细胞总活率及Kupffer 细胞分选得率,而且影响了Kupffer 对肿瘤细胞的吞噬活性。Kupffer 细胞可以通过吞噬作用清除一部分随外周血转移到肝血窦内的肿瘤细胞,抑制肿瘤细胞向肝脏转移的过程。我们提取肝脏原代Kupffer 细胞也正是为体外吞噬肿瘤细胞的实验做准备,所以分离获取较好吞噬活性的Kupffer 细胞非常重要。故本研究用不同消化时间的0.04%胶原酶Ⅳ进行肝脏原位灌注及肝脏组织消化,并在体外共培养Kupffer 细胞与肿瘤细胞,观察胶原酶Ⅳ消化时间对Kupffer 细胞肝脏原位灌注结合MACS 提取效果及吞噬肿瘤细胞功能的影响。
1 材料与方法
1.1 实验动物及细胞系 实验动物:雄性C57BL/6小鼠,6~8周龄,体质量18~22 g,无特定病原体级,常规饲养,购买自上海斯莱克实验动物有限责任公司。实验用细胞系:小鼠黑色素瘤细胞系B16F10,购于中科院上海细胞库。
1.2 主要试剂及仪器 50 mL 离心管、15 mL 离心管、24 孔超低吸附平板购于美国Corning 公司;Hank"s 平衡盐溶液(HBSS,含钙镁和不含钙镁)、磷酸盐缓冲液(PBS)购自上海源培生物;98%三溴乙醇购于上海麦克林生化科技有限公司;台盼蓝购于上海生工;Percoll 购自美国GE Healthcare 公司;胶原酶Ⅳ购于美国Worthington 公司;小鼠抗-F4/80 超纯磁珠(Anti-F4/80 MicroBeads UltraPure,mouse)、磁珠分选柱(MS/LS Columns)购自德国Miltenyi Biotec 公司。细胞增殖示踪荧光探针CFSE(CFDA-SE)购自上海翊圣生物科技有限公司;胎牛血清(FBS)、青霉素—链霉素、0.25%Trypsin-EDTA、DMEM 培养基、IMDM 培养基购于美国Thermo Fisher Scientific公司。胰岛素注射器、留置针、100µm/70µm滤膜、APC 或者Alexa flour 647 标记的anti-F4/80 抗体、PE标记的anti-CD11b 抗体购买自美国BD Bioscience公司。
1.3 不同胶原酶Ⅳ消化时间下Kupffer 细胞肝脏原位灌注结合免疫磁珠分选提取效果观察
1.3.1 肝原位灌注法获取NPC 细胞及总活率计算 取1 只小鼠,腹腔注射三溴乙醇(1.2%,0.2 mL/10 g 体质量)麻醉,棉棒和碘伏擦拭小鼠腹部后,用灭菌的手术剪和镊子将小鼠腹部皮肤纵向剪开(注意禁止剪破腹膜),棉棒和碘伏擦拭腹部内皮表面,换新剪刀镊子将其腹部内皮剖开。用棉棒将小鼠其他内脏器官拨到右侧(防止剪破小肠和胃污染细胞),充分暴露门静脉和下腔静脉,用无菌镊子小心分离门静脉周围组织,保证门静脉完整不破裂,用镊子轻轻挑起支撑。留置针插入肝门静脉后,剪刀剪开下腔静脉。用37 ℃预热的不含钙镁的HBSS 冲洗肝脏10 min,流速20 r/min(蠕动泵),直至肝脏由暗红色变成土黄色且下腔静脉中无血液流出。用含钙镁的HBSS(含0.04%胶原酶Ⅳ)灌注10 min,流速15 r/min,期间间断性用镊子夹紧下腔静脉。将肝脏完全剥离,去除胆囊,用不含钙镁的HBSS 冲洗,置于6 cm 细胞培养皿中,加入2~3 mL 含钙镁的HBSS(含0.04%胶原酶Ⅳ),保证浸泡肝脏,将培养皿置于37 ℃培养箱中进行不同时间的消化(5、10、20 min),分别计为5 min 消化组、10 min 消化组、20 min 消化组,每组分别取6 只小鼠肝脏。用镊子轻轻抖动肝脏,1 mL 枪头轻轻吹散,用100 µm 滤膜过滤至50 mL 离心管中,所获得细胞即为肝脏细胞悬液。将肝脏细胞悬液用不含钙镁的HBSS补齐50 mL,4 ℃预冷离心机,40×g,3 min,收集上清。沉淀用50 mL 不含钙镁的HBSS 重悬,4 ℃,30×g,3 min,收集上清。将两次收集的上清离心,4 ℃,650×g,7 min 后收集沉淀,用4 mL 不含钙镁的HBSS 重悬细胞,70 µm 滤膜过滤,4 ℃暂放。先配 置100%Percoll(10% 10×PBS + 90% Percoll 原液),继 续 用1×PBS 分 别 稀 释 成50%Percoll 和25%Percoll。沿15 mL 离心管内壁缓慢依次加入5 mL 50%Percoll、5 mL 25%Percoll 和4 mL 细 胞 悬液,4 ℃,1 800×g,15 min 离心。离心结束后,取中间层细胞悬液(离心管刻度3~8 mL)至50 mL 离心管中,补加HBSS 至50 mL,4 ℃,650 g,7 min 离心后收集沉淀,即为肝脏NPC。用5 mL HBSS 重悬NPC,取10 µL NPC 细胞悬液与10 µL 台盼蓝充分混匀后,加入计数板,用Countstar 智能细胞分析仪进行活细胞计数及细胞活率计算。
1.3.2 MACS 分选获取Kupffer 细胞及Kupffer 细胞占NPC 比例计算 根据细胞计数结果,按照每107细胞用90 µL 磁珠分选缓冲液重悬,并加入10 µL anti-F4/80的磁珠,4 ℃避光孵育15 min。107总细胞中加入1~2 mL 的4 ℃磁珠分选缓冲液,轻轻吹匀,4 ℃,300×g 离心10 min,弃上清。用磁珠分选缓冲液重悬细胞,使其达到每500µL 含有108总细胞,准备过MS/LS 柱。严格按照产品说明书操作,将MS/LS 柱放于磁力架上,并用磁珠分选缓冲液润洗(防止气泡的产生),将已经孵育完抗体磁珠的细胞悬液加入MS/LS 柱中,待其全部流出后,用磁珠分选缓冲液洗涤MS/LS柱3遍。将MS/LS柱从磁力架上取下,加入磁珠分选缓冲液(MS 柱:1 mL,LS 柱:5 mL),用助推器快速推动液体流穿,并收集流穿液于15 mL 离心管中,即为Kupffer 细胞。取10 µL Kupffer 细胞悬液与10 µL 台盼蓝充分混匀后,加入计数板,用Countstar 智能细胞分析仪进行活细胞计数,将Kupffer 活细胞数除以NPC 活细胞总数,得到MACS分选后Kupffer细胞占比。
1.3.3 Kupffer 细胞形态学分析 将MACS 分选所得Kupffer 细胞用相同体积的培养基重悬,取相同体积的细胞悬液铺于培养皿中,待其贴壁1 h 后,观察在光学显微镜下观察Kupffer细胞形态和密度。
1.3.4 MACS 分选Kupffer 细胞得率分析 将肝脏NPC 细 胞 用PBS 清 洗1 次,取1×106细 胞 重 悬 于100 µL FACS 缓冲液(2%FBS 的PBS 溶液),按照1∶100 的稀释比例加入Fc-blocker,冰上30 min 封闭;按照1∶100 的稀释比例加入流式抗体(APC 标记的anti-F4/80 抗体、PE 标记的anti-CD11b 抗体),冰上避光20 min 染色;每管细胞用500 µL PBS 洗涤两遍,ThermoFisher Attune NxT 流式细胞仪检测。用MACS 获得的Kupffer 细胞占NPC 比例除以流式细胞术分析所得Kupffer 细胞占NPC 比例计算Kupffer细胞得率。
1.4 不同胶原酶Ⅳ消化时间下Kupffer 细胞吞噬肿瘤细胞功能作用观察 胶原酶Ⅳ消化时间对Kupffer 细胞吞噬肿瘤细胞的功能影响观察B16F10培养于DMEM 培养基(其中补充10%FBS和1%的青霉素—链霉素)中;Kupffer细胞培养于IMDM 培养基(其中补充10%FBS 和1%的青霉素—链霉素)中。所有细胞均培养在37 ℃、5%CO2的细胞培养箱中。用CFSE 标记B16F10 细胞,并充分清洗细胞,按照B16F10 细胞与MACS 分选得到的Kupffer 细胞4∶1的比例混合培养2 h。孵育结束后收集细胞,用Alexa Flour 647 标记的anti-F4/80 流式抗体染色,进行流式细胞术分析。通过计算CFSE 阳性(CFSE+)的Kupffer细胞占所有Kupffer细胞的比例,计算吞噬比例。
1.5 统计学方法 采用GraphPad Prism 5.0统计软件。符合正态分布的计量资料以±s表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组NPC 总活率比较 肝脏灌注消化后小鼠肝脏组织变得柔软,用镊子轻轻抖动肝脏即可看到组织块脱落并呈现云雾状,且消化时间越长,脱落组织块越细小,云雾状越明显(详图1)。5 min消化组、10 min 消 化 组、20 min 消 化 组NPC 活 率 分 别 为75.070%±1.886%、53.570%±2.257%、30.250%±3.466%,5 min 消化组分别与10 min 消化组、20 min消化组比较,P均<0.05。
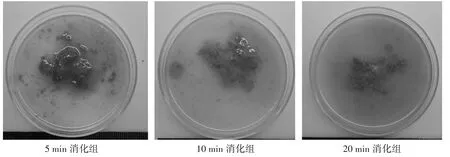
图1 胶原酶Ⅳ消化后各组肝脏组织脱落及分散情况
2.2 各组Kupffer 细胞、NPC 细胞总数及Kupffer 细胞占NPC 细胞比例 Kupffer 细胞、NPC 细胞总数及Kupffer细胞占NPC细胞比例见表1。
表1 各组Kupffer细胞、NPC细胞总数及Kupffer细胞占NPC细胞比例(±s)

表1 各组Kupffer细胞、NPC细胞总数及Kupffer细胞占NPC细胞比例(±s)
注:与其余两组比较,*P<0.05。
组别5 min消化组10 min消化组20 min消化组Kupffer细胞总数(105)6.92±1.40*2.85±0.37 0.82±0.07 NPC细胞总数(106)4.39±1.13 4.50±0.73 4.06±0.62 Kupffer细胞比例(%)15.94±0.93*6.36±0.25 2.05±0.34
2.3 各组Kupffer细胞形态学比较 Kupffer细胞完全贴壁后呈现扁平不规则外形,折光度较低;未完全贴壁的Kupffer细胞多呈现圆形或者棘状,折光度较高。相对于10 min消化组和20 min消化组,5 min消化组细胞密度最大,且完全贴壁细胞最多(详见图2)。

图2 不同消化时间MACS分选得Kupffer的形态(相差显微镜,×400)
2.4 各组MACS-Kupffer细胞比例、FACS-Kupffer细胞比例、Kupffer 细胞得率比较 MACS-Kupffer 细胞比例、FACS-Kupffer细胞比例、Kupffer细胞得率比较见表2。
表2 组MACS-Kupffer细胞比例、FACS-Kupffer细胞比例、Kupffer细胞得率比较(±s)

表2 组MACS-Kupffer细胞比例、FACS-Kupffer细胞比例、Kupffer细胞得率比较(±s)
注:与其余两组比较,*P<0.05。
组别5 min消化组10 min消化组20 min消化组MACS-Kupffer细胞比例(%)15.94±0.93 6.36±0.25 2.05±0.34 FACS-Kupffer细胞比例(%)18.37±0.67*11.47±1.06 4.55±0.48 Kupffer细胞得率(%)86.79±5.05*55.46±2.19 45.14±7.50
2.5 各组Kupffer 细胞吞噬比例比较 5 min 消化组、10 min消化组、20 min消化组Kupffer细胞吞噬比例 分 别 为27.970 0% ± 0.959 7%、21.830 0% ±0.589 7%、17.230 0% ± 0.693 6%,5 min 消化组分别与10 min消化组、20 min消化组比较,P均<0.05。
3 讨论
研究[3,7]显示,Kupffer 细胞在炎症反应、肿瘤免疫、肝脏稳态的维持等方面发挥重要功能。在药物引起的肝损伤及毒素诱导的纤维化过程中,Kupffer细胞具有保护性作用[8-9]。但是,Kupffer 细胞调控的炎性失调也会导致慢性炎症的产生[10]。此外,Kupffer 细胞在肿瘤转移过程中发挥复杂的甚至截然相反的功能,这取决于一些特定的因素,例如转移的阶段、肿瘤抗原载量、与其他免疫细胞的相互作用等[11]。所以,对于Kupffer 细胞功能及机制的研究非常重要,而Kupffer 细胞提取对于其作用机制的研究十分重要,如何在体外进行高效的Kupffer 细胞分离提取也就变得尤为重要。
获取Kupffer 细胞的第一步是对肝脏组织进行有效的消化,并获取高质量的肝脏NPC。目前,对肝组织进行消化较为有效的方法主要包括灌注胶原酶Ⅳ消化法(包括原位灌注和离体灌注)和利用德国美天旎的单细胞制备系统,后者需要专门的仪器设备,且试剂盒价格较高[6]。小鼠的Kupffer细胞表面有巨噬细胞通用的表面分子F4/80,目前利用MACS方法获取小鼠Kupffer细胞主要依赖于anti-F4/80的单克隆抗体。MACS 技术是1990 年报道的,起初它主要应用于研究血细胞的祖细胞,现在应用颇为广泛[12-13]。相对于FACS 来说,虽然在纯度和得率方面MACS 稍显逊色,但是它更加高效简捷,适合实验室大量快捷的获取Kupffer 细胞,尤其适合研究体外原代培养时Kupffer 细胞在相关疾病中的机制。所以,本研究通过摸索胶原酶Ⅳ原位灌注小鼠肝脏的最佳条件,解析胶原酶Ⅳ消化时间对通过MACS 获取Kupffer 细胞及其吞噬功能的影响。有文献报道,胶原酶的过度消化可以降低肝脏NPC 细胞活性,而胶原酶消化时间较低时影响NPC 细胞总量,从而影响大鼠的门静脉成纤维细胞的提取效果[13]。我们在小鼠Kupffer 细胞提取过程中发现,过度的胶原酶Ⅳ消化,显著降低了NPC 细胞活率和通过MACS 分选得到的Kupffer 细胞的总数及比例,但对于所获得的NPC 活细胞总数影响不大。由此可推测Kupffer 细胞对胶原酶Ⅳ更加敏感,对于Kupffer 细胞的提取需控制胶原酶Ⅳ消化时间。通过对比肝血窦内皮细胞与Kupffer 细胞对胶原酶Ⅳ的敏感程度,我们也发现,LSEC更能够耐受较高强度的胶原酶Ⅳ消化。一般情况下,MACS分选细胞得率在60%~90%。本文结果显示,MACS 分选的细胞得率与NPC 中Kupffer细胞占比有相关性,NPC 中Kupffer 细胞比例越高,则通过MACS 分选获得的Kupffer 细胞得率也就越高,这可能与Kupffer 细胞的抗原完整性和活性有关。
Kupffer 细胞具有吞噬活性及抗原提呈功能,此外也可以分泌一系列细胞因子参与炎症和肿瘤微环境的调节,例如IL-6、IL-1β、IFN-γ、IL-12、TNF-α、IL-10、TGF-β[14-18]。Kupffer 细胞的吞噬作用十分强大,他们可以吞噬病原体、免疫复合物、脂质体、脂质微球、肿瘤细胞、内毒素和其他颗粒等。体外进行巨噬细胞(例如Kupffer 细胞)与肿瘤细胞共培养研究巨噬细胞吞噬作用是研究人员常用的方法[19-21]。本研究通过体外共培养Kupffer 细胞和肿瘤细胞,评估胶原酶Ⅳ消化不同时间对Kupffer 细胞吞噬作用的影响,结果显示过度的胶原酶Ⅳ消化不仅影响Kupffer细胞得率也会影响Kupffer细胞的吞噬活性。这可能与胶原酶对Kupffer 细胞表面吞噬相关膜受体蛋白造成的损伤有关。文献[22]报道,一种Ⅳ型胶原酶可破坏肺泡基底膜。
总之,适当的胶原酶Ⅳ消化时间对Kupffer 细胞肝脏原位灌注结合MACS 提取是有利的,而且也更有助于Kupffer细胞对肿瘤细胞的吞噬作用。
