喜炎平注射液与不同输液器具的相容性研究
2022-09-02方礼刘地发刘芳芳刘尧奇刘明颖邓双炳
方礼,刘地发,2,刘芳芳,刘尧奇,刘明颖,邓双炳,3
1.创新天然药物与中药注射剂国家重点实验室,江西青峰药业有限公司,江西 赣州 341000;2.暨南大学,广东 广州 510632;3.南京中医药大学,江苏 南京 210023
注射剂药品使用注射器抽吸、溶解、调配后,通过输液器注入人体,因此输液器具与人们的用药安全息息相关。输液器材料选用不当会导致药物活性成分吸附,使药物失效,更有甚者,有的材料中的有害物质可能迁移至药液中输入人体,危害患者生命安全[1]。目前在我国市场上一次性注射器材质主要是采用高分子聚丙烯材料制成,分为三件式和两件式;输液器的材质主要有聚氯乙烯和烯烃热塑弹性体(TPE)[2-4]。
除了本身材料对注射剂使用可能有影响外,静脉输液联合用药亦存在一定影响,在多种药物连续输注过程中,为了避免两组药物在输液管内混合发生配伍反应,常采用冲管方法,以免与后组药液相混,发生不良反应。一般采用0.9%氯化钠注射液或5%葡萄糖注射液作为冲管液[5-6]。但长期以来,对于不同药物的冲管液量缺乏统一的参考标准,冲管所用的液体量具有随意性,缺乏科学依据[7]。
喜炎平注射液系穿心莲中提取的穿心莲内酯经磺化制成的中药注射液,临床主要用于呼吸道感染、肺炎、支气管炎、腹泻等。在儿科抗菌消炎应用广泛,该品种被纳入20 余种流行性疾病诊疗指南和临床专家共识或诊疗方案,并成为首批被列入《新型冠状病毒肺炎诊疗方案》的中药注射剂品种[8-16]。为提升喜炎平注射液用药的安全性,更好地指导临床规范用药,本研究对输液过程中使用到的注射器和输液器开展相容性试验,并考察不同体积冲管后对喜炎平注射液残留量的影响,以期为喜炎平注射液临床使用过程输液器具的选择及冲管体积提供依据。
1 仪器和材药
1.1 仪器
高效液相色谱仪Agilent 1260(美国安捷伦公司)、微粒分析仪GWF-5JA(天津天河医疗仪器有限公司),水平净化工作台SW-CJ-IG(苏州智净净化设备有限公司),pH 酸度计Five Easy 系列[梅特勒-托利多(上海)有限公司],电子分析天平XS105DU[梅特勒-托利多(上海)有限公司]。
1.2 材料
液相色谱柱Diamonsil C18(4.6 mm×250 mm,5 μm,迪马科技)。喜炎平注射液(江西青峰药业有限公司,批号:2017092303,规格:2 mL∶50 mg);5%葡萄糖注射液(批号:E2017070703,规格:250 mL∶12.5 g);0.9%氯化钠注射液(批号:E2017031801,规格:250 mL∶2.25 g),均来源于甘肃扶正药业科技股份有限公司。无菌注射器(圣光医用制品公司,批号:090213,三件式);无菌注射器(湖北仙明公司,批号:20181116,三件式);无菌注射器(江西三鑫公司,批号:151118,三件式);无菌注射器(江西益康公司,批号:190221,三件式);无菌注射器(上海康德莱公司,批号:20170904,二件式);无菌注射器(福州怡辰康公司,批号:170324,二件式);一次性使用输液器带针(江西益康公司,批号:190401);一次性输液器(江西三鑫公司,批号:190218,规格:BV1);一次性输液器(江西三鑫公司,批号:190615,规格:BV3);一次性输液器(圣光医用制品公司,批号:190321);一次性输液器(湖北仙明公司,批号:20190215)。17-氢-9-去氢穿心莲内酯-19-硫酸酯钠对照品(中国食品药品检定研究院,批号:111942-201402,含量:96.8%)。乙腈为色谱纯,磷酸二氢钾为优级纯,水为超纯水,其余试剂均为分析纯。
2 方法和结果
2.1 溶液的制备
2.1.1 注射器相容性试验在水平净化工作台(100级,分析实验室,室温,下同)内,采用三件式和二件式注射器,参照中华人民共和国国家标准GB15810-2019,一次性使用无菌注射器吸取喜炎平注射液至总刻度容量[17],回拉芯杆,使活塞稍离液面,分别左右振摇5 次,室温放置,分别在0、0.5、1 h 进行取样,作为供试品溶液A;并取未与一次性输液器接触的喜炎平注射液,作为对照组溶液。
2.1.2 输液器相容性试验在水平净化工作台内,采用模拟静脉滴注方式,考察不同输液器储存不同时间后,喜炎平注射液的变化。参照中华人民共和国医药行业标准YY/T1550.1-2017 一次性使用输液器具与药物相容性研究指南中供试液制备方法[18],取20 mL 喜炎平注射液,分别用5%葡萄糖注射液和0.9%氯化钠注射液作为输液载体,配制符合临床使用的药物输液液体2 份。其中1 份输液液体通过输液器具,按照药物使用说明书给出的输液方式、输液速度进行模拟输液,分别在100%、50%、25%剩余体积时收集流出液,作为供试品溶液B。另1 份配制好的药物输液液体摇匀后直接取样,作为对照组溶液。另取供试品溶液B 各溶液,精密吸取2 mL,置20 mL 量瓶中,加水稀释至刻度,摇匀,作为供试品溶液C。
2.1.3 冲管残留试验在水平净化工作台内,取喜炎平注射液20 mL,用250 mL 的5%葡萄糖注射液稀释,制备3 份,先后连接同一厂家一次性输液管和同一厂家输液针。使瓶内的液体注满输液管,关死调节滑轮,拔下输液管分别连接装有20 mL 5%葡萄糖注射液的滴定管。打开滴定管开关和输液器流量调节滚轮让瓶内液体通过输液器缓慢滴出,取临近滴完的最后5 mL 液体,作为供试品溶液D。同法分别连接装有20 mL、30 mL、40 mL、50 mL 的5%葡萄糖注射液的滴定管。0.9%氯化钠注射液冲管残留试验配制过程同上。
2.1.4 对照品溶液的制备取17-氢-9-去氢穿心莲内酯-19-硫酸酯钠对照品适量,精密称定,加50%乙腈制成每1 mL 含1.75 mg 的溶液;精密吸取1 mL,置20 mL 量瓶中,加水稀释至刻度,摇匀,即得对照品溶液。
2.2 分析方法
2.2.1 性状分别取供试品溶液A、B 的各溶液,观察是否澄清或浑浊。
2.2.2 pH 值分别取供试品溶液A、B 的各溶液,测定各溶液的pH 值,计算各时间点的RSD(相对标准偏差)进行统计学分析。
2.2.3 不溶性微粒分别取供试品溶液A、B 的各溶液,依照不溶性微粒检查第一法[2](《中华人民共和国药典》2020 年版四部通则0903)测定。
2.2.4 含量测定照高效液相色谱法(《中华人民共和国药典》2020 年版四部通则0512),参考国家食品药品监督管理局国家药品标准颁布件WS-10863(ZD-0863)-2002-2011Z 中含量测定项下17-氢-9-去氢穿心莲内酯-19-硫酸酯钠方法测定,计算各时间点含量的RSD。以Diamonsil C18色谱柱(4.6 mm×250 mm,5 μm)为色谱柱;以乙腈为流动相A,以磷酸二氢钾缓冲液(每1 000 mL水中加入磷酸二氢钾1.361 g 与1-庚烷磺酸钠1.0 g)为流动相B,按表1 进行梯度洗脱。柱温:25 ℃;流速:1.0 mL/min;检测波长:225 nm。分别精密吸取对照品溶液和各供试品溶液各10 µL,注入液相色谱仪,测定,记录色谱图。
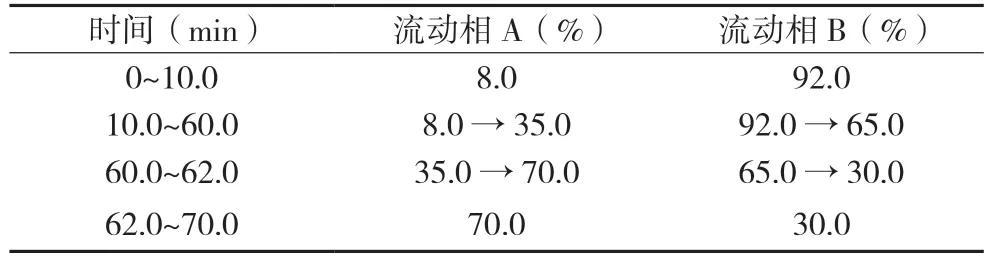
表1 梯度条件
2.3 实验结果
2.3.1 性状各溶液性状均无显著变化,无浑浊、结晶,供试品溶液A、B 分别为淡黄色澄明液体、无色澄明液体。
2.3.2 pH 值不同厂家、不同类型注射器内的喜炎平注射液pH 值在1 h 内均无显著性变化;两种不同输液载体,从配液至输液结束,不同厂家输液器内喜炎平注射液的pH 值无显著性变化;两试验pH 值RSD(n=3)均在0.3%以内。
2.3.3 不溶性微粒(1)注射器相容性试验:在1 h内,不同厂家、不同类型的注射器内喜炎平注射液不溶性微粒均符合药典规定。结果见表2。(2)输液器相容性试验:两种不同输液载体,从配液至输液结束,经过不同厂家输液器后的喜炎平注射液不溶性微粒结果的平均值(n=3)均符合药典规定,表明上述5 个厂家输液器对喜炎平注射液均无显著影响。结果见表3。
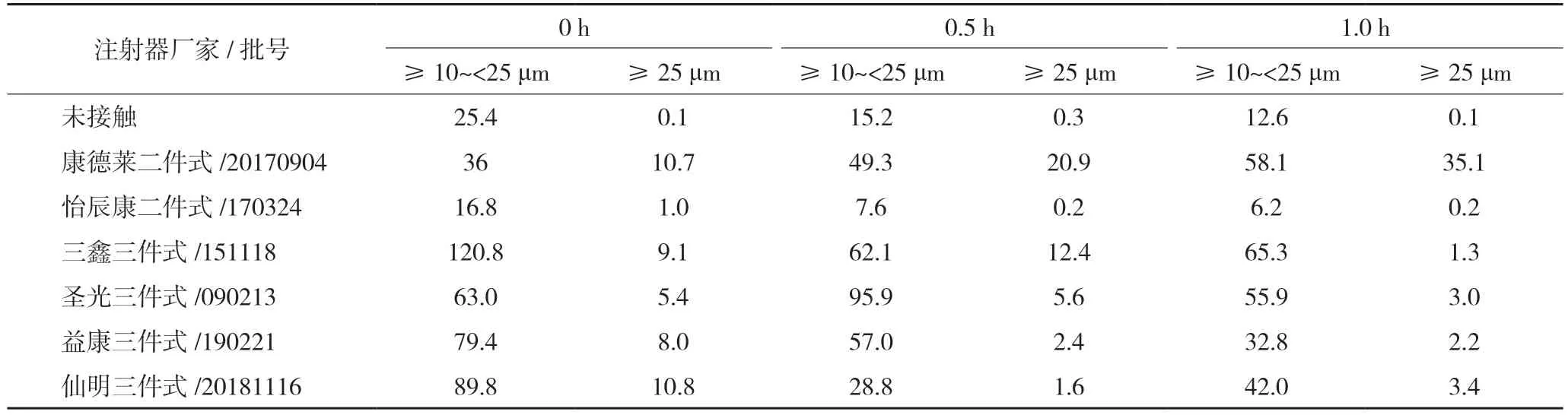
表2 一次性注射器试验不溶性微粒结果(粒)
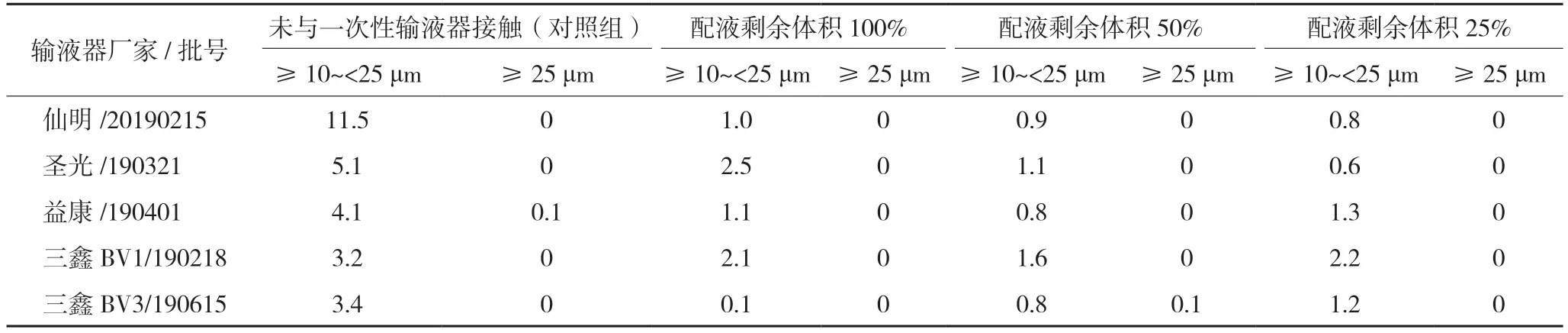
表3 一次性输液器试验不溶性微粒结果(粒)
2.3.4 含量测定(1)输液器相容性试验:两种不同输液载体,从配液至输液结束,5 种不同厂家输液器对喜炎平注射液主要化学成分无显著影响,含量与对照组含量相当,RSD(n=3)均小于2.0%。结果见表4。(2)注射器相容性试验:在1 h 内,6 种不同厂家或类型的无菌注射器对喜炎平注射液主要化学成分无显著影响,含量与对照组含量相当,RSD(n=3)均小于2.0%。结果见表5。(3)冲管残留试验:冲管液体积大于30 mL 时,测得最大成分的残留率平均值(n=3)均在0.05%以下。结果见表6。
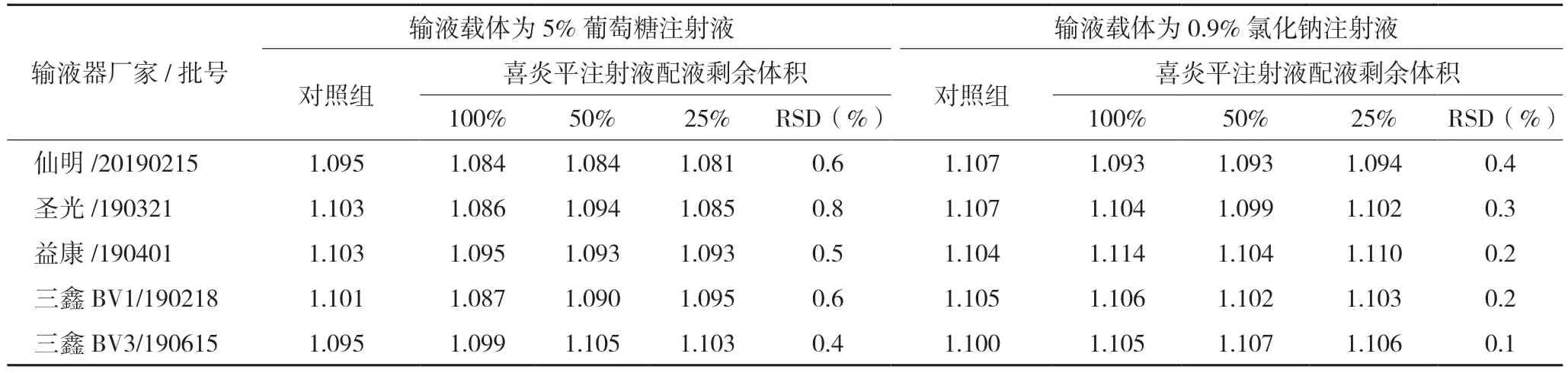
表4 一次性输液器试验含量结果(mg/mL)
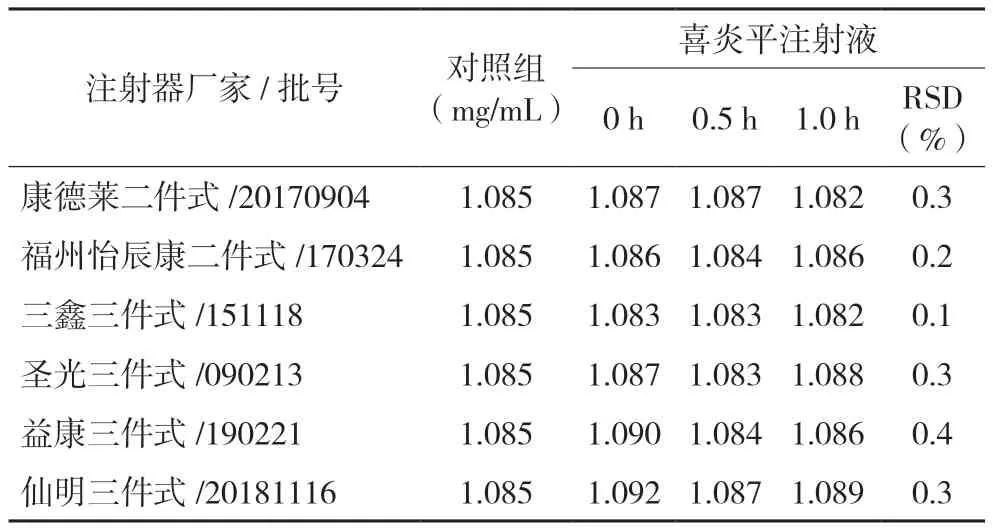
表5 一次性注射器试验含量结果(mg/mL)
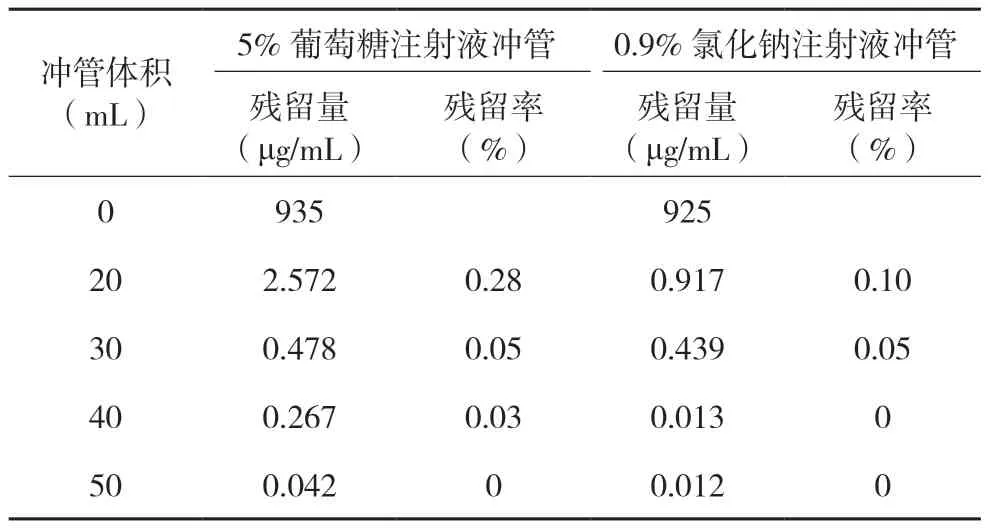
表6 喜炎平注射液冲管残留试验含量结果
3 讨论
本研究主要通过中药注射剂喜炎平注射设计了3 组试验,分别是与注射器、输液器接触过程中的相容性试验及确定冲管溶媒体积的冲管残留试验;实验从性状、pH 值、不溶性微粒和含量测定等指标多角度考察产品使用过程中的质量稳定性。最终实验结果表明喜炎平注射液使用不同厂家、不同类型的注射器和输液器,相容性均良好,但考虑到三件式注射器中橡胶带来的不溶性微粒增加的风险,建议推荐优先使用二件式注射器。喜炎平注射液如需与其他注射剂液连续使用时,为了避免混合造成配伍不稳定,更换成其他不同注射剂前应进行冲管,且冲管体积不应少于30 mL。
本次研究为中药注射剂输液器具的选择及冲洗体积的考察提供了一定的实验参考,但考虑到中药注射剂之间成分差异较大,不同品种应分别研究后方可确定。
