住院心力衰竭患者左心室血栓面积与临床变量的相关性
2022-09-01黄丽燕翟玫赵雪梅黄燕周琼梁琳田鹏超赵朗冯佳禹张宇辉张健
黄丽燕,翟玫,赵雪梅,黄燕,周琼,梁琳,田鹏超,赵朗,冯佳禹,张宇辉,张健
住院心力衰竭患者常合并血液淤滞、高凝状态、心内膜和血管内皮功能不全等,易发血栓[1-3]。心腔内血栓,尤其是左心室血栓(LVT)引起的猝死,心原性脑卒中,冠状动脉血栓栓塞,系统性栓塞和静脉血栓栓塞症等是导致心力衰竭患者不良预后的重要原因[4]。既往研究表明,血栓面积较大的患者发生系统性栓塞等不良事件的风险较高[5],强化抗凝引发的出血风险也较高[6]。识别影响LVT 面积的临床因素可能有助于早期干预危险因素,降低栓塞和出血风险。在本研究中,我们将探讨住院心力衰竭患者入院基线临床特征与LVT 面积之间的关系。
1 资料与方法
1.1 研究对象
连续入选2008 年10 月至2018 年5 月在中国医学科学院阜外医院心力衰竭中心重症监护病区住院,诊断为心力衰竭和LVT 的患者322 例。纳入标准:(1)符合中国心力衰竭诊断和治疗指南[7]诊断标准,诊断为心力衰竭的患者;(2)本次住院期间通过以下任一影像学诊断为LVT(包括心尖),包括超声心动图、心脏磁共振成像(CMR)、CT。排除标准:(1)患者年龄在14 岁以下;(2)NYHA 心功能分级Ⅰ级;(3)影像学报告中没有血栓面积的具体描述。
1.2 研究方法
回顾性收集所有患者的基线数据,包括人口学特征、主要合并症、相关实验室检查和影像学检查。具体影像学参数包括血栓长径、短径、左心室射血分数(LVEF)、左心室舒张末期内径(LVEDD)、左心室后壁厚度(LVPWT)和室间隔厚度(IVST)。
其中超声心动图中的LVT 是指左心室运动减低或运动障碍心肌节段附近的低回声团块。在整个心动周期中,LVT 至少在两个视图中可见。血栓大小由影像学检查中获得的血栓长径和短径相乘的血栓面积这一连续变量确定(单位:mm2)。
由于血栓面积数据呈右偏分布,我们将其进行平方根变换后用于后续分析。根据平方根变换后的血栓面积中位数将整体人群分为两组,分别为大面积组和小面积组,并比较两组间基线特征差异。
1.3 统计学方法
采用SPSS 25.0 统计软件与R 3.6.2 统计软件进行统计分析。正态分布的连续变量用均数±标准差表示,非正态分布连续变量用中位数(P25,P75)表示。分类变量以数字和百分比表示。采用Pearson或Spearman 相关性分析评估平方根变换后的血栓面积与基线连续变量间的相关性,平方根变换后的血栓面积的组间比较使用t检验分析。上述分析中P<0.10 的变量被纳入回归分析,以进一步确定住院心力衰竭患者LVT 面积的相关因素。缺失数据通过多重插补填补。采用逐步回归法消除解释变量多重共线性的影响。在逐步回归分析中,P<0.05 为差异有统计学意义。
2 结果
2.1 心力衰竭合并LVT 患者的基线特征(表1)
表1 心力衰竭合并LVT 患者基线特征()

表1 心力衰竭合并LVT 患者基线特征()
注:LVT:左心室血栓;BMI:体重指数;hs-CRP:高敏C 反应蛋白;LVEDD:左心室舒张末期内径;LVPWT:左心室后壁厚度;IVST:室间隔厚度;LVEF:左心室射血分数。扩张型心肌病:包括原发性扩张型心肌病、围产期心肌病、酒精性心肌病。1 mmHg=0.133 kPa。*:周围循环栓塞:除心脏、脑、肺和视网膜血管以外的栓塞[8]。△:用中位数(P25,P75)表示
研究共入选322 例患者,男性270 例(83.9%),平均年龄(50.75±15.31)岁,血栓面积为中位数348(220,595)mm2,LVEF 为(33.76±12.04)%,LVEDD 为(63.03±11.00)mm,NYHA 心功能分级Ⅱ级124 例(38.5%)、Ⅲ级103 例(32.0%)、Ⅳ级95 例(29.5%)。既往有心肌梗死病史180 例(55.9%),合并糖尿病78 例(24.2%)。
根据平方根变换后的血栓面积中位数18.64将整体人群分为大面积组(n=161)和小面积组(n=161)。大面积组的体重指数(BMI)、血浆大内皮素水平、LVEDD 均高于小面积组(P均<0.05)。
2.2 LVT 面积与临床变量的相关性分析及逐步回归分析(表2、3)
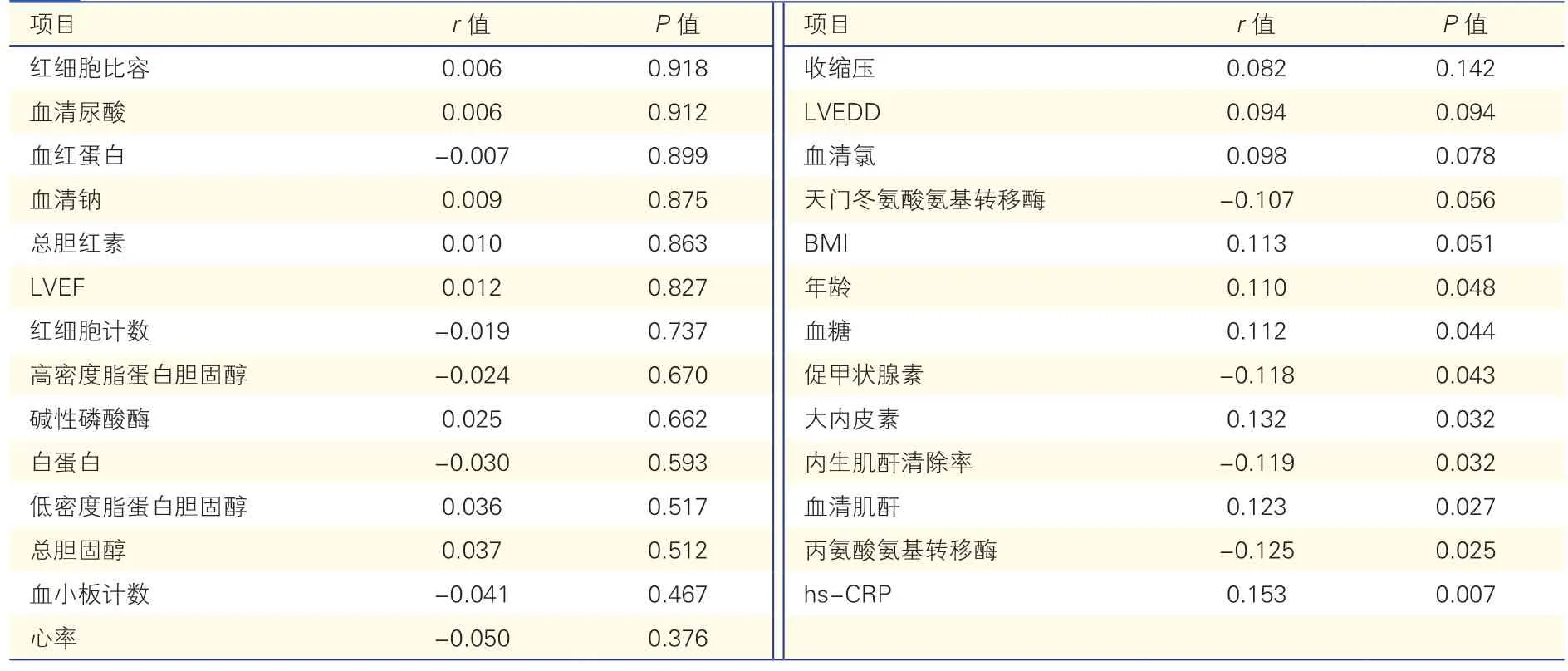
表2 基线连续变量与血栓面积的相关性分析(n=322)
Pearson 或Spearman 相关性分析结果显示,年龄(r=0.110,P=0.048)、BMI(r=0.113,P=0.051)、高敏C 反应蛋白(hs-CRP,r=0.153,P=0.007)、血清氯(r=0.098,P=0.078)、丙氨酸氨基转移酶(r=-0.125,P=0.025)、天门冬氨酸氨基转移酶(r=-0.107,P=0.056)、大内皮素(r=0.132,P=0.032)、血糖(r=0.112,P=0.044),血清肌酐(r=0.123,P=0.027)、内生肌酐清除率(r=-0.119,P=0.032)、促甲状腺素(r=-0.118,P=0.043)和LVEDD(r=0.094,P=0.094)与LVT 面积相关。
使用多重插补法填补缺失数据后,通过逐步回归分析LVT 面积的独立影响因素,年龄(β=0.067,P=0.020)、LVEDD(β=0.084,P=0.032)和hs-CRP(β=0.211,P=0.022)与LVT 面积独立相关。
2.3 各病史及合并症血栓面积比较(表4)
表4 各病史及合并症血栓面积比较()

表4 各病史及合并症血栓面积比较()
在显著性水平α=0.05 的前提下,没有证据显示糖尿病患者和非糖尿病患者的LVT 面积差异存在统计学意义(P=0.054)。

表3 逐步回归分析(n=322)
3 讨论
传统观点认为,LVT 常继发于心肌梗死。然而,随着经皮冠状动脉介入治疗等的发展,心肌梗死后LVT 的发生率逐渐降低[9],心力衰竭逐渐成为LVT最常见的诱因[4]。
心力衰竭患者LVT 形成和进展的机制尚不明确。已有研究指出,LVEDD 增加和低LVEF 与扩张型心肌病患者LVT 的形成密切相关[10],左心室壁局部或整体运动不协调和心肌收缩力下降引起的心腔内异常血流动力学可能导致血液涡流,激活凝血通路[11]。血液高凝状态也是心力衰竭患者血栓形成的危险因素。血小板因子4 和β-血栓球蛋白等评估血小板功能的指标、凝血酶-抗凝血酶Ⅲ复合物、纤维蛋白原、组织型纤溶酶原激活物和纤维蛋白肽A 等评估凝血酶活性的指标和D-二聚体等评估纤溶活性的指标在心力衰竭患者中显著升高[12-15]。心内膜和血管内皮损伤在心力衰竭患者心腔内原位血栓形成过程中也起到重要作用。除此之外,心力衰竭患者组织缺血及其继发的氧化应激反应可以激活血小板、内皮细胞和白细胞,激活炎性细胞因子[16],炎性细胞因子通过上调组织因子表达等途径促进血栓形成[17-18]。
LVT 患者发生猝死,心原性脑卒中,冠状动脉血栓栓塞,系统性栓塞和静脉血栓栓塞症的风险显著增加[6,19-22],对患者的生活质量和预后均产生不利影响。研究指出,心力衰竭合并LVT 患者的1 年内死亡率超过10%[4]。
LVT 患者发生心原性脑卒中,系统性栓塞等事件的风险与血栓的形态学特征有关。有研究指出血栓面积大、血栓突出和活动性血栓患者发生血栓栓塞事件的风险较高[5,23-24]。Lattuca 等[6]还发现,接受抗凝治疗的LVT 患者,其基线血栓面积与LVT完全消退率独立相关。大面积血栓更不易完全消退,更易进展为持续性LVT。与血栓完全消退的患者相比,持续性LVT 患者的死亡率更高。因此,识别与LVT 面积相关的临床指标有助于评估患者发生血栓栓塞和死亡等不良事件的风险。
抗凝是LVT 的主要治疗手段,然而,目前还没有关于心力衰竭合并LVT 抗凝治疗最佳持续时间的共识。对于VTE,已有诸多临床试验表明,延长抗凝时间可以在不增加出血风险的情况下预防VTE 复发[25-26]。然而,在心力衰竭合并LVT 患者中延长抗凝的风险与获益并存。长期抗凝可能导致心力衰竭患者出血、脑卒中、心肌梗死甚至死亡的风险增加[6,27]。在临床实践中,针对危险因素的早期干预可能有助于预防大面积LVT 的形成,从而避免高强度抗凝和长期抗凝带来的出血风险。
本研究发现LVT 面积与年龄和LVEDD 相关。衰老与凝血酶生成增加相关[28],高龄患者血栓并发症风险较高[29-30]。此外诸多研究已经证实扩大的心腔中异常的血流动力学可能导致LVT 的形成。本研究表明,LVEDD 与LVT 面积相关,提示在临床实践中,加强规范用药,逆转心室重构,早期恢复心室结构,对避免较大面积LVT 形成和改善患者预后具有潜在意义。
本研究还表明,hs-CRP 水平也与心力衰竭患者LVT 面积相关。已知临床和亚临床炎症与心力衰竭风险增加和心力衰竭患者不良预后相关。心力衰竭患者的炎症反应下游标志物如C 反应蛋白(CRP),白细胞介素(IL)等水平显著升高[31],常可以提示心力衰竭恶化[32],预测不良预后[33]。IL-1β 抑制剂卡那单抗可以剂量依赖性降低合并心肌梗死和hs-CRP 升高患者的心力衰竭住院和死亡复合终点风险[34]。研究还提示炎症因子在血栓形成中可能起重要作用。例如,一项关于心肌梗死后LVT 的研究发现,LVT 患者的CRP 浓度显著高于无LVT 患者(48 mg/L vs.8.4 mg/L),入院时CRP 水平是早期LVT 的独立相关因素[35]。Danenberg 等[36]发现,在动脉损伤后,CRP 转基因小鼠的血栓栓塞速度更快。CRP促进血栓形成的机制可能较为复杂,CRP 可作用于单核细胞和内皮细胞并产生促炎症作用;CRP 还可诱导内皮细胞细胞间粘附分子-1 和血管细胞间粘附分子-1 的表达,上调组织因子的表达和诱导其他细胞因子的表达,促进血栓微环境形成[37-38];此外,CRP 可通过诱导纤溶酶原激活物抑制剂-1 的表达而抑制纤溶[39]。综上,炎症,心力衰竭和血栓常常合并存在并相互促进,在临床实践中控制炎症,或采用他汀或地中海饮食调整控制亚临床炎症,不仅有助于改善心脏重构,降低心力衰竭相关不良事件风险,还能避免心力衰竭患者出现大面积LVT 及继发不良事件,改善患者预后。
综上所述,本研究发现,在NYHA 心功能分级Ⅱ~Ⅳ级住院心力衰竭患者中,年龄,LVEDD 和hs-CRP 显著独立影响LVT 面积,提示早期干预心力衰竭患者的左心室重构和控制炎症可能有助于减缓血栓进展,改善心力衰竭合并LVT 患者预后。
本研究的特点包括:(1)相对全面地收集临床和实验室资料;(2)仅纳入NYHA 心功能分级Ⅱ~Ⅳ级心力衰竭住院患者,以避免高估心力衰竭疾病负担。但是本研究的局限性也不容忽视。首先,本研究是一项回顾性研究,无法确定因果关系。其次,此研究为单中心研究,结果可能无法外推。此外,与2020 年中国心力衰竭医疗质量控制报告的住院心力衰竭人群特点相比,本研究患者年龄较小,男性比例较高,提示存在一定选择偏倚[40]。另外,血栓的二维平面测量结果不能完全代表其三维结构大小。最后,本研究的样本量有限,结论有待较大样本量的前瞻性研究证实。
利益冲突:所有作者均声明不存在利益冲突
