转录组分析探讨揭示羊肚菌多糖ME-X抗S180肿瘤的分子机制
2022-09-01叶姿妤周丽倩刘欣岚侯怡铃
鲁 艳,黄 瑶,叶姿妤,周丽倩,刘欣岚,丁 祥,侯怡铃*
(1.西华师范大学生命科学学院/西南野生动植物资源保护教育部重点实验室 四川 南充 637009;2.西华师范大学环境科学与工程学院 四川 南充 637009)
多糖是一种天然高分子聚合物,与蛋白质和多核苷酸类似,是生命活动中必不可少的大分子[1]。近年来,从天然资源如植物、动物、真菌和海藻中分离的多糖因其广泛的药理活性,如抗肿瘤、免疫调节、抗氧化和抗炎作用日益受到关注,特别是多糖的抗肿瘤作用吸引了越来越多科学家的注意[2]。肿瘤已经成为了危害人类最大的疾病之一,常规疗法会引起一系列的不良反应,而多糖的抗肿瘤作用相对安全。研究发现,地榆多糖对小鼠S180肿瘤的抑制率可达到56.5%[3],乳菇多糖(LEP)对小鼠S180实体瘤的抑瘤率能达到66.31%,并且这两种多糖对S180细胞均无毒性[4];海洋真菌多糖(YCP)对小鼠移植性瘤S180、Heps和Lewis的抑制率能达到43%左右且对小鼠无毒副作用[5]。羊肚菌Morchella esculenta具有非常高的药食两用价值,分子量为1 000 kDa的羊肚菌多糖(半乳甘露聚糖)能够增强巨噬细胞活化[6]。分子量为53.3 kDa的羊肚菌发酵杂多糖(MEP-II)能诱导人肝癌细胞系HepG2凋亡并能通过减少自由基的产生来帮助治疗肝癌[7]。分子量为81.8 kDa的羊肚菌多糖(MEP)能够抑制人结肠癌HT-29细胞的增殖和生长,且呈时间和剂量依赖性[8]。在我们的前期研究中,从羊肚菌中分离纯化得到一种平均分子量为16.3 kDa的羊肚菌多糖,命名为ME-X。ME-X由甘露糖、葡萄糖、半乳糖,比例为4∶4∶1;且具有(2,4→6)-α-D-吡喃甘露糖主链骨架,细胞活性试验证实ME-X能够促进Raw264.7、Jurkat和Raji细胞增殖[9-10],但ME-X能否抑制肿瘤,若能,其抑制肿瘤的分子机制还未解决。
本研究主要通过构建小鼠S180肉瘤模型结合转录组测序分析,探索研究羊肚菌多糖抑制小鼠S180肿瘤过程中可能涉及的关键基因和信号通路,拟为分子水平上揭示羊肚菌多糖的抗肿瘤机制提供一定的理论依据。
1 材料和方法
1.1 试验材料
羊肚菌多糖(ME-X)分离纯化自四川省阿坝藏族自治州小金县羊肚菌,S180小鼠肿瘤细胞购自四川大学生命科学学院。雌性昆明小鼠(KM)购自川北医学院。
1.2 体内抗小鼠S180肿瘤试验
雌性昆明小鼠在室温(23±2)℃、通风良好的环境下饲养。培养S180细胞至对数生长期,用新鲜培养基将细胞配制成密度为2×106个/mL的细胞悬液。随机取4只小鼠,腹腔注射S180细胞悬液,喂养7 d至腹部肿大,抽取腹水收集细胞,加入新鲜培养基重悬细胞使其密度为4×106个/mL,腋下皮下多点注射到15只正常雌性昆明小鼠身上,100 μL/只。24 h后,将小鼠随机平均分成3组,每组5只,分别为空白组(control组)、羊肚菌多糖组(ME-X组)、阳性对照组(甘露聚糖肽,Man组)。ME-X组每天按20 mg/kg的标准灌胃ME-X溶液100 μL,Man组每天灌胃20 mg/kg甘露聚糖肽100 μL,其余饲养条件均相同。连续给药8 d后,处死小鼠,测量每只小鼠的体重并编号记录,快速解剖小鼠取其免疫器官(包括肝、脾、胸腺)和肿瘤组织进行称重,并计算抑瘤率。计算方法如下:

式(1)中M1为ME-X组肿瘤重量的平均值或Man组肿瘤重量的平均值;M2为control组肿瘤重量的平均值。
1.3 总RNA提取、检测及测序
提取上述3组小鼠的S180肿瘤组织总RNA,提取按照Trizol试剂操作说明书进行。用琼脂糖凝胶电泳对RNA的降解程度和污染状况进行初步检测,使用Nonodrop对RNA的浓度和纯度进行精确检测,使用Agilent2100对RNA的完整度进行精确检测。将上述检测合格后的总RNA送至北京诺禾致源生物信息科技有限公司进行cDNA文库构建,库检合格后进行Illumina测序。
1.4 生物信息学分析
对测序后得到原始测序数据(raw reads)进行质控,得到分析数据clean reads。采用subread软件对基因表达水平进行定量分析;采用皮尔逊相关系数反应3组间基因表达水平的线性相关程度;采用clusterProfiler软件对差异表达基因(DEGs)进行GO富集分析、KEGG通路富集分析,阈值设置为Padj<0.05。
1.5 统计学处理
数据的统计分析采用SPSS中的单因素方差分析(one-way ANOVA),组间差异为P<0.05代表显著,以“*”表示;P<0.01代表极显著,以“**”表示。
2 结果与分析
2.1 体内抗小鼠S180肿瘤试验结果
体内抗小鼠S180肿瘤试验结果(见表1和图1)可知:在20 mg/kg的剂量下,小鼠的S180肿瘤组织的平均重量在ME-X组中为(0.48±0.12)g,在Man组中为(0.45±0.06)g,在 control组中为(0.96±0.20)g。统计学分析结果显示,ME-X能极显著地降低小鼠S180肿瘤的重量,并且ME-X和Man对小鼠S180移植性肿瘤的抑制率分别为53.81%和50.32%。显然,ME-X的抑瘤率略高于Man,且3组小鼠的体重、肝、脾及胸腺无显著变化。
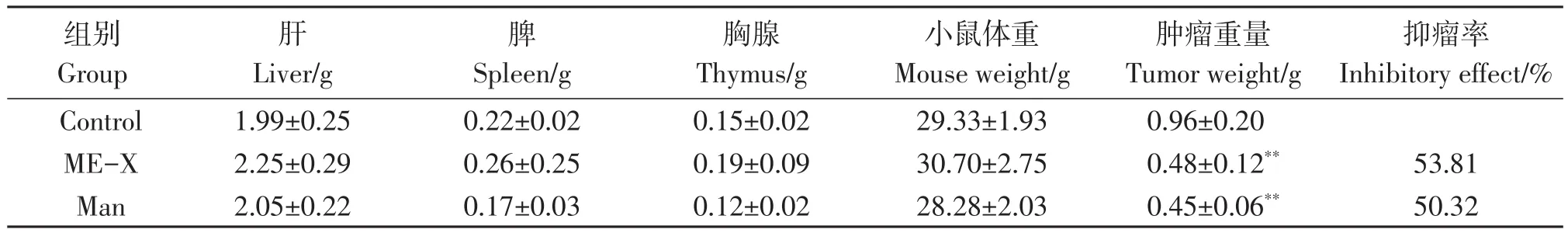
表1 ME-X体内对小鼠S180肿瘤的抑制效果Table 1 Inhibitory effect of ME-X on tumor of S180 mice in vivo
2.2 转录组数据质量分析
测序获得的原始数据(raw reads)去掉带接头和低质量的reads后,control组获得8.97G、Man组获得8.35G、ME-X组获得7.83G的clean reads。其中每个样品的Q30(%)均大于93.4%,GC含量均在50%左右,碱基错误率在0.03%,说明该测序结果高度可靠,可进行下一步分析研究(见表2)。
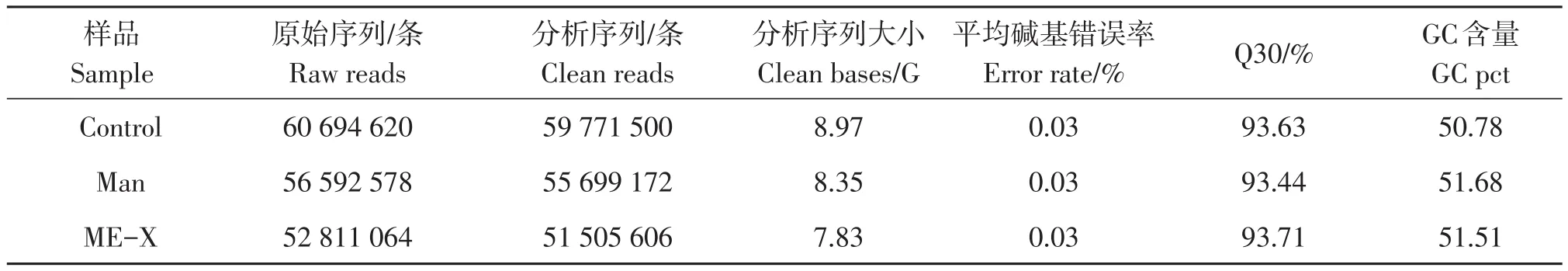
表2 样品组转录组测序数据质量统计结果Table 2 Quality assessment for sequencing data of transcriptome
2.3 基因表达水平分析
样本组间基因表达水平皮尔逊相关性分析结果(见图2A)表明ME-X组与Man组的基因表达水平相关性较高;而ME-X与control组之间的基因表达水平相关度较低,提示S180肿瘤细胞经ME-X处理后其基因表达水平存在一定的变化。
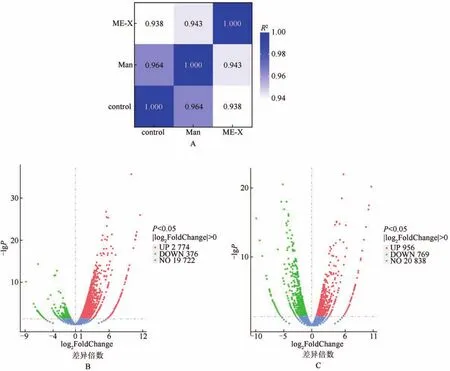
图2 皮尔逊相关性及差异表达分析Figure 2 Pearson correlation and differential expression analysis
通过RSEM软件对基因表达水平进行定量分析,当FPKM>1,FPKM˃60,FPKM<0.3分别被认为基因有表达,高表达,表达较低或不表达。分析结果显示control组中有12 203个基因表达(FPKM≥1),约占基因总数的23.18%,其中1 052个基因高表达(FPKM≥60),约占基因总数的2.00%。Man组中有12 240个基因表达(FPKM≥1),约占基因总数的23.25%,其中1 028个基因高表达(FPKM≥60),约占基因总数的1.95%。ME-X组中有13 006个基因表达(FPKM≥1),约占基因总数的24.70%,其中961个基因高表达(FPKM≥60),约占基因总数的1.83%。
进一步分析发现在control组中有9个基因极高表达(FPKM>2 200),包括:mt-Co1、Rplp1、Eef1a1、Rpl36、Rpl34-ps1、Lgals1、mt-Cytb、mt-Nd1、Rpl13;Man组中有9个基因为极高表达(FPKM>2 200),包括:mt-Co1、Rplp1、Eef1a1、Rpl36、Lgals1、mt-Nd1、mt-Cytb、Rpl13、Rps2-ps10;ME-X组中有6个基因为极高表达 (FPKM˃2 200),包括 :mt-Co1、Rplp1、Eef1a1、mt-Nd1、mt-Cytb、Lgals1;详见表3。

表3 3组中极高表达的基因(FPKM>2 200)Table 3 Quantification of gene expression in three groups(FPKM>2 200)
在以上筛选出的高表达基因中,mt-Co1、mt-Nd1、mt-Cytb在3组中同时高表达且均属于线粒体基因[11-13]:所编码的蛋白共同参与细胞氧化磷酸化过程[14-15]。其中值得关注的是mt-Co1,它的FPKM值在3组中均为最高:在ME-X组中为5 530.09、在Man组中高达6 760.32、在control组中为5 108.05。以上结果表明S180肿瘤细胞在ME-X的作用下,其氧化磷酸化释放能量的过程与control组无太大差异但与Man组存在一定的差异。
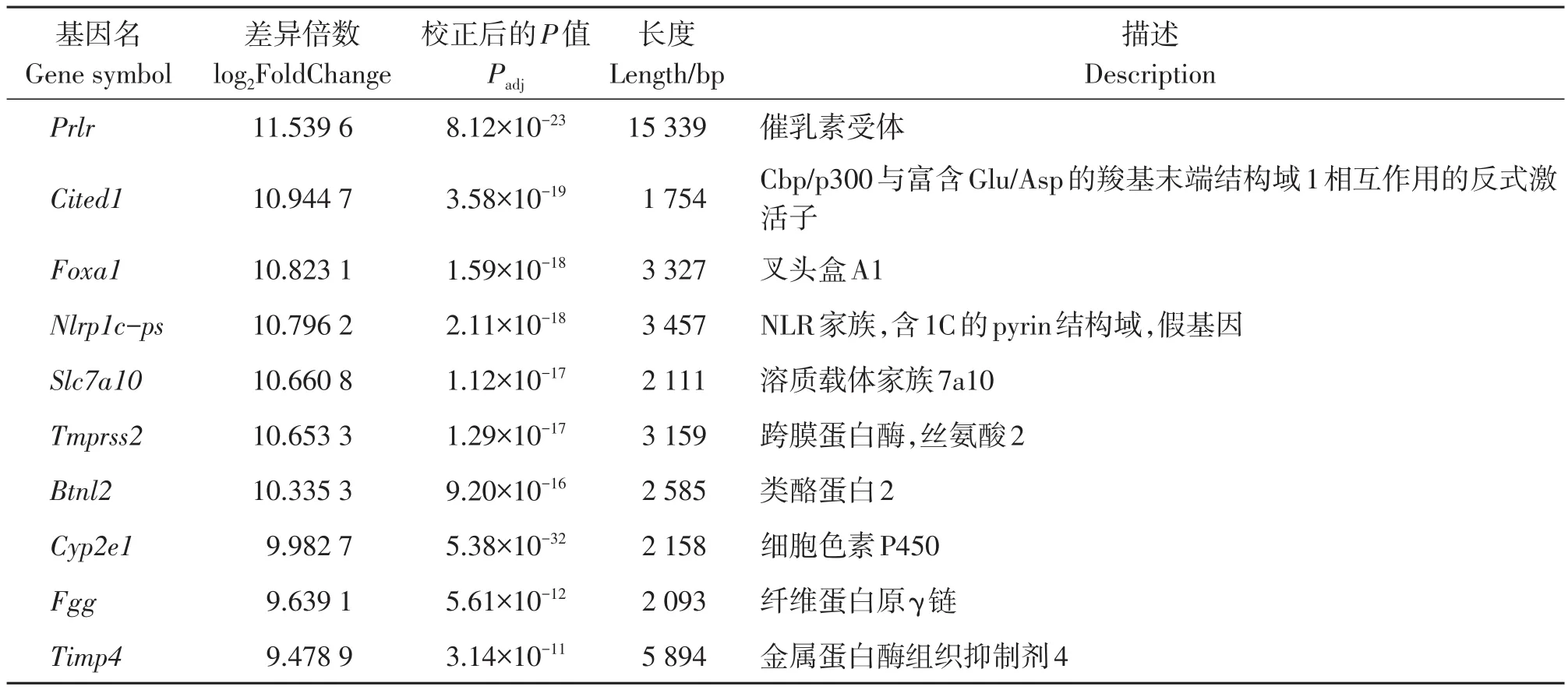
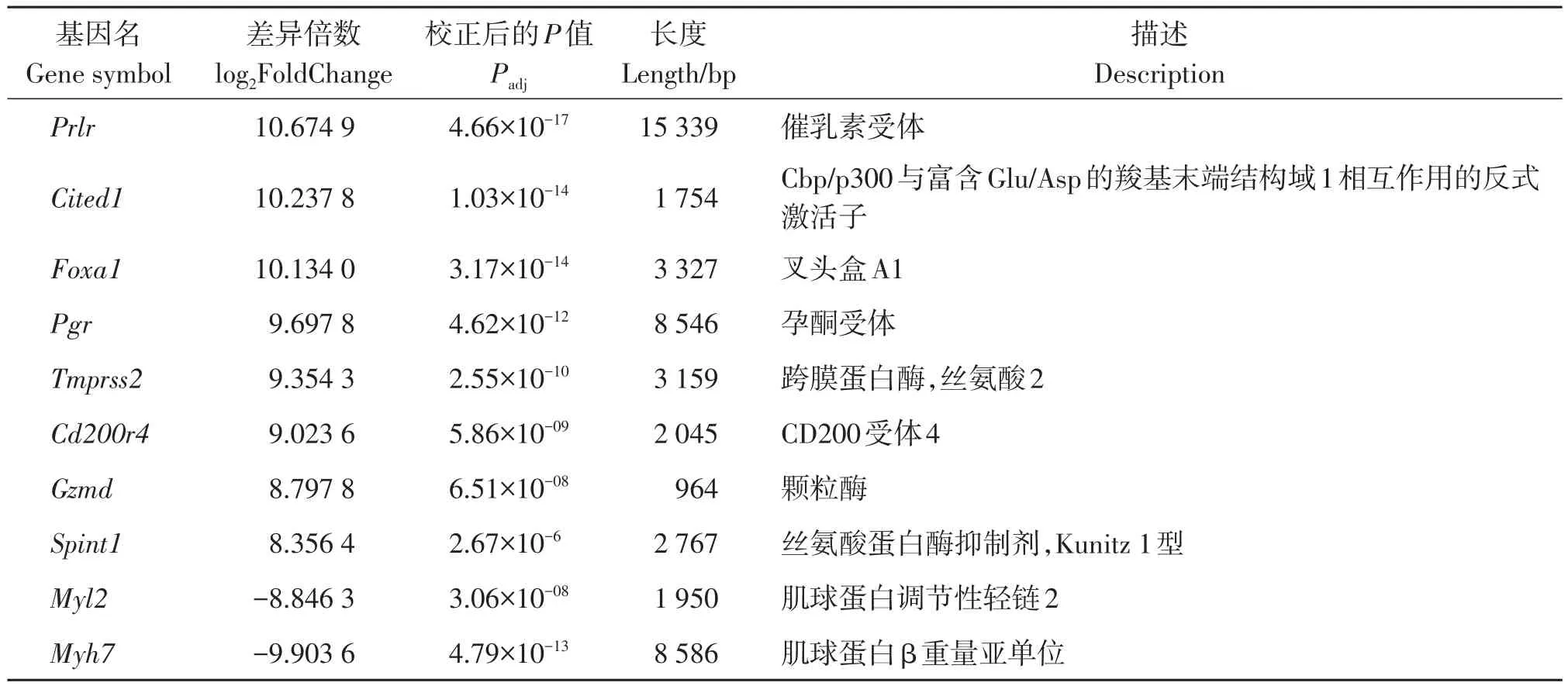
此外,Rplp1、Eef1a1均在蛋白质合成过程中发挥重要的作用[16-22];对应的FPKM值在ME-X组分别为3 058.59、2 731.75,在Man组分别为3 866.62、3 179.32,在control组分别为4 231.25、3 449.33——即FPKM值排序为ME-X组 不仅如此,我们还筛选到Lgals1:它编码半乳糖凝集素1[23-24]。该基因FPKM值在ME-X组中为2 214.15,低于Man组中的2 730.60和control组中的2 782.25,提示在ME-X的作用下,S180肿瘤细胞的增殖、分化和凋亡过程均有所改变,且不同于Man组。 差异基因GO功能富集分析结果显示:ME-X抑制S180肿瘤生长的关键基因功能分类显著富集在生物过程中的T细胞激活和获得性免疫反应过程,细胞组分中的质膜外侧和细胞外基质,分子功能中G蛋白偶联受体活性和细胞因子结合(见图3A)。而Man抑制S180肿瘤的基因功能主要富集在生物过程中的吞噬作用、识别和循环免疫球蛋白介导的体液免疫(见图3B)。这提示我们,与Man作用机制所涉及的关键基因门类不同,ME-X主要通过获得性免疫中的细胞免疫来达到抑制S180肿瘤的目的。 图3 差异表达基因GO和KEGG富集结果Figure 3 GO annotation and KEGG enrichment of DEGs ME-X组和Man组的转录组数据分别与control组通过edgeR进行差异表达基因(DEGs)分析,设定显著差异表达的阈值为Padj<0.05、∣log2FoldChange∣>0.80。结果显示,与control组相比:ME-X组中共存在3 150个差异基因,其中有2 774个基因上调,376个基因下调(见图2B),差异倍数较大的10个基因主要有Prlr、Cited1、Foxa1、Nlrp1c-ps、Slc7a10、Tmprss2、Btnl2、Cyp2e1、Fgg、Timp4(见表4);而 Man组中共存在1 725个差异基因,其中有956个基因上调,769个基因下调(见图2C),差异倍数较大的10个基因主要有Prlr、Cited1、Foxa1、Pgr、Tmprss2、Cd200r4、Gzmd、Spint1、Myl2、Myh7(见表5)。 表4 ME-X组相较于control组的差异表达基因(前10)Table 4 DEGs of ME-X group vs control group(Top 10) 表5 Man组相较于control组的差异表达基因(前10)Table 5 DEGs of Man group vs control group(Top 10) 进一步分析发现Prlr、Cited1、Foxa1、Tmprss2在ME-X组和Man组中均上调。其中Prlr和Cited1上调最显著:在ME-X组中两基因的log2FoldChange分别为11.539 6、10.944 7;Man组中log2FoldChange值分别为10.674 9、10.237 8。Prlr编码催乳素受体,Cited1则编码一种CREB结合蛋白[25-27]。这两个基因上调说明ME-X和Man能够改变S180肿瘤细胞的转录过程,并且具有一定的相似性。 此外,Foxa1编码DNA结合蛋白FOXA1,Timp4编码金属蛋白酶抑制剂TIMP4:两者均能诱导癌细胞凋亡,TIMP4还能特异性抑制多种肿瘤细胞增殖和迁移[28-31]。前者log2FoldChange在ME-X组为10.134 1、Man组为10.134 0;后者只在ME-X组上调,log2FoldChange为9.478 9。这说明ME-X不仅能以多种方式调节S180肿瘤细胞的凋亡,还能以不同的途径来改变其增殖和迁移能力。Btnl2编码主要组织相容性复合物[32-33],它只在ME-X组中显著性上调:log2FoldChange为10.335 3,提示ME-X能调节S180肿瘤小鼠T细胞的激活。 另外Cyp2e1编码蛋白质P450 2e1[34],该基因只在ME-X组上调:log2FoldChange为9.982 7,提示ME-X能以不同的途径催化S180小鼠体内多种与药物代谢和胆固醇、类固醇及其他脂质合成有关的反应来改变肿瘤细胞的代谢活动。 差异基因KEGG富集分析结果显示:ME-X组相较于control组的差异基因中有1 202个成功富集并注释在291条通路中;Man组相较于control组的差异基因中有545个成功注释在262条通路中。这些差异基因均显著富集在细胞黏附分子(CAMs)和细胞因子与其受体之间相互作用中(见图3C、3D),这表明ME-X抑制小鼠S180肿瘤的机制与Man具有相同之处。此外,ME-X组差异基因还显著富集在NK细胞介导的细胞毒性作用及PI3K-AKT信号转导等通路中(见表6),表明ME-X抑制小鼠S180肿瘤的机制与Man又存在较大差异。 表6 ME-X组中不同于Man组的KEGG富集结果Table 6 Different KEGG pathways enrichment of ME-X group vs Man group 对KEGG信号通路进一步分析发现,ME-X组富集在P13K-AKT信号通路中的差异基因最多,这说明P13K-AKT信号通路是ME-X抑制S180肿瘤最主要的信号转导通路。PI3K-AKT信号通路是癌症信号通路中非常重要的通路之一[35-36]。在ME-X作用下,该通路中表达显著上调的基因包括Prlr、Col4a6、Fgfr2、Pck1、Ghr、Ntrk2、Myb、Fgf10、Ccnd2、Il2rb。Prlr、Fgfr2、Ghr、Ntrk2及Il2rb均编码上游细胞膜受体蛋白:其中PRLR在该通路中主要负责识别催乳素;GHR主要与生长激素结合[37-38]。FGFR2主要识别成纤维细胞生长因子——如该通路中显著上调的Fgf10[39]。这提示ME-X能够通过上调表达膜受体蛋白来启动调节肿瘤细胞增殖和存活相关的信号。还有一些基因编码下游的蛋白,比如Pck1和Myb:Pck1在葡萄糖缺乏肝癌细胞中强制表达可增加肝癌细胞死亡[40]。而Myb过表达能增强CD8+T细胞的记忆形成、多功能性和回忆反应,促进过继转移后的治疗性抗肿瘤免疫[41-42]。综合以上结果表明P13K-AKT信号通路在ME-X抑制S180肿瘤细胞中承担着非常重要的作用。 羊肚菌多糖同其他真菌多糖一样被证实具有抗氧化作用,不仅可以保护斑马鱼胚胎免受AAPH诱导的氧化损伤[43],还可以通过PI3K/AKT途径减轻肺癌细胞A549氧化应激[44]。此外,羊肚菌多糖还有抗炎作用[45]。更重要的是羊肚菌多糖能抑制肿瘤细胞增殖[8,46-48],但其抗肿瘤机制还有待解决。 本次研究发现我们前期提纯的新的羊肚菌多糖ME-X能够抑制小鼠S180肿瘤生长,结合转录组分析ME-X能够显著下调S180肿瘤细胞中与蛋白质合成相关的基因Rplp1和Eef1a1,上调可诱导细胞凋亡的基因Foxa1、Timp4等,这与体内S180肿瘤抑制实验结果相符合。且ME-X组中差异表达基因功能主要富集在T细胞激活门类下,表明ME-X能够调节机体免疫力,这与我们前期研究相一致[9]。 然而不同于蔡伟等人研究发现南方红豆杉总多糖与紫杉醇联用是通过线粒体途径和Wnt信号通路来抑制S180肿瘤生长[49]:本研究发现ME-X对线粒体基因表达影响不明显,结合KEGG富集分析初步判断PI3K-AKT信号通路是ME-X抑制S180肿瘤细胞的生长中最重要的信号转导途径。 综上所述,羊肚菌多糖ME-X能够通过上调Prlr、Ghr和Fgf10/Fgfr2等信号(图4),来激活PI3K,在细胞膜附近招募并磷酸化二磷酸磷脂酰肌醇(PIP2)生成三磷酸磷脂酰肌醇(PIP3),PIP3作为第二信使,激活下游底物,最终导致Pck1和Myb等上调,来调控小鼠的免疫过程并影响S180肿瘤细胞的代谢、增殖及迁移,从而达到抑制S180肿瘤生长的目的。本研究为真菌多糖抗肿瘤机制探索提供了一定的理论依据。2.4 差异基因GO功能富集分析

2.5 转录组数据差异表达基因(DEGs)分析
2.6 差异基因KEGG信号通路富集分析

3 讨论
4 结论
