基于腺相关病毒血清型8 型介导的Gjb2 基因c.109G>A纯合突变耳聋小鼠的基因治疗
2022-08-30成桢哲金晨曦冯宝怡郑晓飞刘祎晴
成桢哲,金晨曦,冯宝怡,郑晓飞,刘祎晴,吴 皓#,陶 永#
1. 上海交通大学医学院附属第九人民医院耳鼻咽喉头颈外科,上海 200011;2. 上海市耳鼻疾病转化医学重点实验室,上海 200125;3.上海交通大学医学院耳科学研究所,上海 200125
遗传性耳聋是人类最常见的遗传性疾病之一,其发病率为2‰~3‰[1-2];而缝隙连接蛋白β2 (gap junction protein β 2,GJB2)基因突变是迟发性耳聋以及遗传性非综合征性耳聋最常见的病因[3-4]。GJB2基因主要在支持细胞、血管纹以及螺旋韧带中表达。它编码连接子蛋白(connexin 26,CX26),与CX30蛋白一起参与构成耳蜗基底膜非感觉上皮区域以及血管纹外侧壁区域的缝隙连接通道[5],涉及包括耳蜗发育、耳蜗内淋巴电位产生、耳蜗主动放大、第二信使转导以及钾循环在内的多项听觉生理过程[6-9]。腺相关病毒(adeno-associated virus,AAV)介导的基因治疗作为一种极具潜力的治疗手段,在遗传性耳聋模式动物的治疗中已有多篇成功报道[10-12]。迄今为止的Gjb2基因治疗主要集中于CX26条件性敲除小鼠模型,即在新生鼠时期实现CX26 蛋白的敲除,敲除小鼠成年后表现为螺旋神经节神经元以及内外毛细胞大量死亡,听力完全丧失。随后研究者通过AAV 介导外源正常CX26 蛋白表达,通过听性脑干反应(auditory brainstem response,ABR)实验仅在12 kHz和24 kHz 两个频率测得听力阈值的下调[13-14]。目前报道的Gjb2点突变的隐性纯合突变小鼠模型仅有1 种,即Gjb2基因c.109G>A 纯合突变小鼠(下文简称Gjb2纯合突变小鼠),表现为轻中度渐进性听力损失[15],并且在注射呋塞米后相较野生型小鼠,听力阈值会显著升高。本研究拟向新生Gjb2纯合突变小鼠注射带有绿色荧光蛋白(green fluorescent protein,GFP) 和野生型Gjb2基因的AAV8-GJB2-GFP,在成年后检测小鼠能否减轻呋塞米引起的阈值升高反应,从而评价GJB2用于遗传性耳聋基因治疗的可行性。
1 材料与方法
1.1 材料
1.1.1 实验病毒 病毒AAV8-GFP[5.80×1013GC/mL(GC:genomic copies)]及AAV8-GJB2-GFP(4.19×1013GC/mL) 均购自山东维真生物公司(ViGene Biosciences)。所有AAV都由CMV启动子控制。
1.1.2 实验小鼠 本研究使用的Gjb2纯合突变小鼠及其年龄和性别匹配的野生型对照小鼠均为129T2/SvEmsJ品系小鼠[15];通过对小鼠尾基因组DNA测序来确认基因型。野生型小鼠和Gjb2纯合突变小鼠均饲养于上海交通大学医学院附属第九人民医院实验动物中心,实验动物使用许可证号为SYXK(沪)2020-0025。
1.1.3 主要试剂及仪器 多聚甲醛(16005)、Triton(T8787)、动物组织RNA 稳定保存液RNAlater(R0901)、盐酸赛拉嗪(X1251)购自美国Sigma 公司,0.5 mol/L EDTA 溶液(E1170)购自北京索莱宝科技有限公司,驴血清(BMS0140) 购自美国Abbkine 公司,SYBR Green Premix Pre Taq HS qPCR Kit 购自湖南艾科瑞生物工程有限公司,蛋白酶抑制剂(04693116001)购自美国Roche 公司,RIPA 裂解液(P0013B)、BCA 蛋白浓度测定试剂盒(P0012)、5×loading buffer(P0015)购自碧云天生物公司,舒泰50 (WK001) 购自法国维克公司,呋塞米(C822848)购自上海麦克林生化科技有限公司,抗CX26 抗体(33-5800)、二抗及封片剂购自美国Invitrogen 公司,抗SOX2 抗体(AF2018)购自美国R&D 公司,抗肌球蛋白7a(myosin 7a,MYO7a)抗体(25-6790)购自美国Proteus BioSciences 公司,抗β-actin抗体(4967S)购自美国CST公司。
共聚焦显微镜(Leica TCS SP8)购自德国Leica公司,匀浆机(JXFSTPRP-48)购自上海净信公司,荧光定量PCR 仪(Roche LightCycler 480)购自美国Roche公司,化学发光仪(Amersham Imager 600)购自美国GE 公司,37 ℃直流电热垫(557020)购自美国Harvard 公司,TDT 听觉诱发电位工作站(TDT System3 RZ6 workstation) 购 自 美 国Tucker-Davis Tech公司。
1.2 方法
1.2.1 新生鼠注射 将出生2 d 内(P0~P2)的新生小鼠放在冰上低温麻醉。取耳前入路,暴露镫骨动脉后,用拉制的玻璃电极在显微镜直视下将AAV8-GFP或AAV-GJB2-GFP 病毒注射入新生鼠右侧内耳中阶。每只新生鼠注入0.3 μL 病毒。手术结束后置于37 ℃恒温加热垫上至完全复苏。
1.2.2 免疫荧光染色 小鼠处死后,快速取出耳蜗,进行4%多聚甲醛灌流固定。随后将组织放置在4%多聚甲醛中4 ℃固定过夜,随后换成0.5 mol/L EDTA室温脱钙6 h。脱钙结束后将耳蜗按顶圈、中圈、底圈解剖分离。用含有8%驴血清、0.3%Triton 的磷酸盐缓冲液(PBS)室温封闭组织1 h,加入抗SOX2抗体(1∶300 稀释)、抗myosin 7a 抗体(1∶300 稀释)4 ℃孵育过夜,PBS清洗3遍,每遍5 min。加入对应的二抗(1∶500 稀释)室温孵育1 h,PBS 清洗3 遍,每遍5 min。滴入含DAPI的抗淬灭剂后封片,进行共聚焦成像。使用Image J 分别对顶圈、中圈、底圈的GFP转染的内毛细胞及支持细胞进行计数。
1.2.3 实时荧光定量PCR 将快速获取的耳蜗组织放入RNAlater中防止RNA降解,去除前庭后放入匀浆机研磨匀浆(总运行时长37 s,运行7 s后中断3 s,频率为65 Hz)。随后按照TRIzol法提取组织RNA,反转录成cDNA 后,使用SYBR Green Premix Pre Taq HS qPCR Kit 在 荧 光 定 量PCR 仪 中 对Gjb2、Gjb6以 及Rpl19(ribosomal protein L19)进行PCR 扩增。扩增引物见表1。扩增程序为:95 ℃孵育5 min;随后95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,共45 个循环。目的基因的相对表达值用Rpl19进行标准化换算。

表1 实时荧光定量PCR引物序列Tab 1 Primer sequences for real-time qPCR
1.2.4 Western blotting实验 将去前庭的耳蜗组织放入含有蛋白酶抑制剂的RIPA 裂解液中,放入匀浆机研磨匀浆(总运行时长2 min,运行3 s 后中断8 s,频率为70 Hz)。随后4 ℃,17 000×g离心30 min。取上清液用BCA蛋白浓度检测试剂盒测得蛋白浓度,并将各样品稀释成相同的浓度。加入5×loading buffer放入95 ℃水浴5 min。每个样品上样量为20 μg总蛋白,进行SDS-PAGE 凝胶电泳,随后转膜至PVDF 膜上。5%脱脂奶粉封闭后,抗CX26 抗体(1∶1 000 稀释)以及抗β-actin 抗体(1∶1 000 稀释)4 ℃孵育过夜,对应二抗室温孵育1 h后,使用化学发光仪曝光显影。
1.2.5 ABR 实验 采用TDT 听觉诱发电位工作站(TDT System3 RZ6 workstation),按20 mg/kg 盐酸赛拉嗪和65 mg/kg舒泰50的剂量腹腔注射麻醉小鼠,待小鼠全麻后置于37 ℃直流电热垫上。将记录电极置于颅顶正中皮下,参考电极置于待测耳乳突下,接地电极置于另一侧大腿皮下。选择5.66 kHz、8.00 kHz、11.32 kHz、 16.00 kHz、 21.35 kHz、 32.00 kHz、45.00 kHz短音作为刺激声频,叠加次数为512次,强度从90 dB 声压级(sound pressure level,SPL)开始记录,每次递减5 dB SPL,以可以检测到的振幅的最低刺激强度定为该频率阈值。
1.2.6 呋塞米试验 将小鼠按“1.2.5”的方法腹腔注射麻醉后,快速腹腔注射呋塞米溶液200 mg/kg,等待30 min 后用ABR 检测稳定的听力阈移数值,并用同龄野生型小鼠作为对照组。
1.2.7 统计学方法 使用GraphPad Prism 8.0 对数据进行分析,定量资料用±s表示,组间比较采用方差分析(ANOVA)以及Bonferroni 校正。将P<0.05 定义为有统计学意义。
2 结果
2.1 AAV8-GFP在Gjb2纯合突变小鼠耳蜗的转染情况
于新生Gjb2纯合突变小鼠内耳中阶注射1.74×1010GC 的AAV8-GFP 病 毒,14 d 后 获 取 耳 蜗 组 织 进行免疫荧光染色,用SOX2 抗体标记基因治疗靶细胞即耳蜗支持细胞(图1A)。顶圈、中圈、底圈的支持细胞AAV8-GFP 病毒转染率分别为(11.60±1.28)%、(10.33±1.55)% 、(5.40±0.86)% (图1B)。 可 见AAV8-GFP病毒可用于后续Gjb2转染的载体。
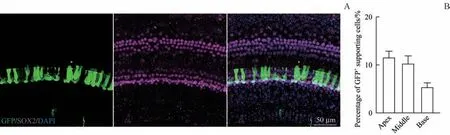
图1 Gjb2纯合突变小鼠耳蜗中阶注射AAV8-GFP 14 d后支持细胞转染情况Fig 1 Supporting cells transfection 14 d after AAV8-GFP injection in the scala media of the cochleae of Gjb2 homozygous mice
2.2 AAV8-GJB2-GFP 在Gjb2 纯合突变小鼠耳蜗的转染情况
新生Gjb2纯合突变小鼠中阶注射1.26×1010GC的AAV8-GJB2-GFP 病毒,4 周后取注射耳以及未注射耳的耳蜗组织进行实时荧光定量PCR,结果显示病毒注射后耳蜗Gjb2mRNA 表达量为未注射耳的1.26 倍(P=0.014),编码CX30 蛋白的Gjb6基因表达差异并无统计学意义(图2A)。Western blotting 结果显示CX26 的蛋白表达量为未注射耳的1.31 倍(图2B)。耳蜗免疫荧光染色结果提示外源性CX26(绿色荧光)成功在支持细胞区域表达(图2C),部分内毛细胞间可观察到CX26的异位表达(图2D)。

图2 Gjb2纯合突变小鼠耳蜗中阶注射AAV8-GJB2-GFP 4周后Gjb2及其蛋白CX26在耳蜗的表达和定位Fig 2 Expression and location of Gjb2 and it's expression protein CX26 in the cochleae of Gjb2 homozygous mice 4 weeks after AAV8-GJB2-GFP injection in the scala media
2.3 AAV8-GJB2-GFP对新生小鼠内耳的安全性
选择新生(P0~P2)Gjb2纯合突变小鼠,通过耳蜗中阶的注射方式给予1.26×1010GC 的AAV8-GJB2-GFP后,于小鼠4周龄时用ABR分别检测给药耳与对侧未给药耳的各频率听力阈值(n=10),两侧耳听力阈值一致(图3)。
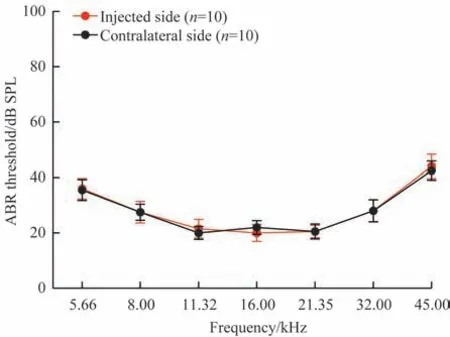
图3 Gjb2 纯合突变小鼠一侧耳蜗中阶注射AAV8-GJB2-GFP 4周后ABR阈值与未注射侧的比较Fig 3 Comparison of ABR thresholds between AAV8-GJB2-GFP injected side and contralateral side of cochleae after 4 weeks in Gjb2 homozygous mice
2.4 呋塞米试验在Gjb2纯合突变小鼠的反应
野生型小鼠及Gjb2纯合突变小鼠腹腔注射呋塞米前后的ABR阈值变化见图4。野生型4周龄小鼠基础听力与Gjb2纯合突变小鼠差异无统计学意义。在呋塞米注射后30 min,测量2组的ABR阈值,结果发现,野生型小鼠全频听力与注射前无明显变化,而Gjb2纯合突变小鼠全频听阈较注射前均显著升高(均P<0.01)。
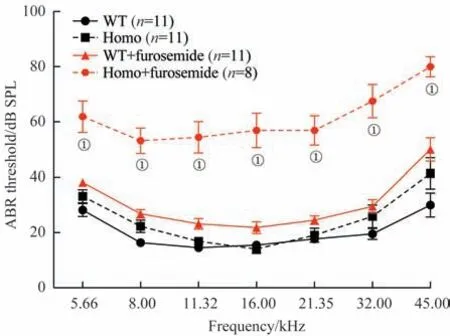
图4 4 周龄野生型小鼠及Gjb2 纯合突变小鼠注射呋塞米前后ABR阈值变化Fig 4 Changes of ABR thresholds before and after furosemide injection in 4-week-old wild type mice and Gjb2 homozygous mice
2.5 Gjb2 纯合突变小鼠注射AAV8-GJB2-GFP 后呋塞米试验的反应
新生Gjb2纯合突变小鼠中阶注射AAV8-GJB2-GFP 病毒4 周后进行呋塞米试验,发现治疗组较未治疗组整体听力阈值明显降低,在8.00、11.32 和16.00 kHz 测得的ABR 阈值,2 组之间差异具有统计学意义(均P<0.05)(图5)。

图5 Gjb2 纯合突变小鼠注射AAV8-GJB2-GFP 4 周后在呋塞米试验中的ABR阈值变化Fig 5 Changes of ABR thresholds in furosemide test in the Gjb2 homozygous mice 4 weeks after AAV8-GJB2-GFP injection
3 讨论
迄今为止,已经发现有超过300 种的GJB2基因突变位点与不同程度的耳聋相关(http://www.hgmd.cf.ac.uk/ac/),占我国遗传性非综合征性耳聋的18.31%,是遗传性非综合征性耳聋最常见的原因[16]。GJB2基因c.109G>A 突变是在东亚人群中携带率最高的突变类型,在中国汉族人口中携带率为6.2%[17]。为研究GJB2突变致聋的相关机制,本课题组前期构建该点突变敲入小鼠,并证实其可模拟人类轻中度、迟发性、渐进性耳聋听力表型[15],并且在应对环境(噪声刺激)、药物(呋塞米试验)压力下表现出与野生型小鼠不同的表型反应[18]。
关于GJB2的基因治疗,最早由林曦教授团队率先开展, 构建CX26 条件敲除小鼠(Foxg1-cCx26KO)。该小鼠表现为重度感音神经性聋,随后通过腺相关病毒1型介导Gjb2基因表达,成功转染部分支持细胞,并在体外细胞层面(钙黄绿素染色实验)发现功能有部分恢复,但在体研究(电生理实验) 未发现功能恢复[13]。IKEDA 团队对另一种CX26 条件敲除的耳聋小鼠模型进行AAV 介导的基因治疗,但仅有部分频率的听力阈值从100 dB SPL 恢复到70 dB SPL,而该听力阈值仍无法用于日常沟通交流[14]。也有研究通过病毒过表达脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的方法,试图减轻CX26 内耳条件敲除小鼠神经元的丢失,结果仅在耳蜗中圈、底圈观察到神经元数量的恢复,而听觉电生理实验无明显改善[19]。然而上述基因治疗均基于CX26 条件性敲除小鼠耳聋模型,其听力表型为重度听力下降,不符合大部分人群的GJB2突变表型。在听力下降的GJB2突变人群中,轻中度听力损失比例超60%[20],相较于CX26条件性敲除小鼠模型,本研究使用的Gjb2纯合突变小鼠表现为轻中度、迟发性耳聋,对其进行基因治疗更具有临床意义。
病毒注射治疗后免疫荧光染色结果表明,过表达GJB2部位包括内毛细胞和支持细胞,尽管存在内毛细胞区域有异位表达,但ABR 检测结果仍正常。这与RAPHAEL 团队结果一致[21],提示内毛细胞GJB2异位表达可能不会对毛细胞以及ABR 听力检测结果产生影响。
LUSTIG 团队将AAV1-VGLUT3 病毒导入Vglut3(vesicular glutamate transporter type 3)基因敲除小鼠模型中,使敲除小鼠听力恢复并维持到注射后3~6 个月,首次证实基因治疗可用于遗传性耳聋治疗[10]。随后很多团队证实AAV 介导的基因治疗可成功实现耳聋模式小鼠的听力恢复[10-12]。但发病率最高的GJB2基因治疗尚无突破。本课题组前期证实AAV8可安全高效转染内耳细胞[22-23]。通过AAV8-GJB2-GFP 中阶注射入新生小鼠内耳,可成功靶向支持细胞,介导外源GJB2 的表达。然而转染位置主要集中在顶中圈,支持细胞转染率也较低。后续可以AAV8病毒为模版,进行衣壳或者启动子改造[24],以期获得在支持细胞转染率高、在毛细胞转染率低的病毒工具。
呋塞米是一种袢利尿剂,不良反应之一是导致一过性听力下降,其机制可能是引起血管纹细胞水肿,导致内淋巴电位迅速降低,短暂性地引起小鼠听力阈值的升高[25]。团队前期测得Gjb2纯合突变小鼠基础的内淋巴电位仅为88 mV,而野生型小鼠可达100 mV。野生型小鼠以及Gjb2纯合突变小鼠腹腔注射200 mg/kg 呋塞米后,野生型小鼠测得的内淋巴电位下降为78 mV,仅有轻微的听力阈值上升;而Gjb2纯合突变小鼠内淋巴电位下降至42 mV,听力阈值上升也更明显[18]。以此作为实验基础,观察基因治疗能否保护呋塞米导致的Gjb2纯合突变小鼠听力下降。本实验结果表明基因治疗后,Gjb2纯合突变小鼠能缓解呋塞米引起的听力阈值升高。
本研究通过团队前期基础,利用耳聋家系发现的点突变Gjb2纯合突变小鼠进行病毒介导的过表达治疗研究。利用野生型小鼠和Gjb2纯合突变小鼠在呋塞米刺激下的阈值上升程度的不同进行实验,发现中阶注射AAV8-GJB2-GFP 病毒后Gjb2纯合突变小鼠ABR 阈值上升幅度明显小于未注射病毒的小鼠,AAV 介导的基因治疗使呋塞米对Gjb2纯合突变小鼠的听力损伤程度减小。这表明了Gjb2基因过表达策略可能可以治疗Gjb2点突变导致的听力改变。
Gjb2纯合突变小鼠为一种迟发性渐进性耳聋的模型,目前我们仅观察了AAV-GJB2-GFP 在4 周龄小鼠的表达效果。后期,我们将通过长期观察判断AAV 介导的基因治疗能否改善Gjb2纯合突变小鼠的渐进性听力下降。
本研究证实新生小鼠中阶注射AAV8-GJB2-GFP可以递送Gjb2靶向小鼠耳蜗支持细胞,并介导外源性Gjb2在支持细胞表达。AAV8-GJB2-GFP 内耳注射不损伤Gjb2纯合突变小鼠听力,Gjb2过表达可减轻呋塞米导致的Gjb2纯合突变小鼠听力下降。本研究为治疗GJB2相关遗传性耳聋的基因治疗提供了可行性证据。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有动物实验均已通过上海交通大学医学院附属第九人民医院伦理委员会的审核批准(批件号HKDL[2017163])。所有实验过程均遵照《实验动物饲养管理和使用指南》及《上海交通大学医学院附属第九人民医院动物中心管理手册》进行。
All experimental animal protocols in this study were reviewed and approved by Ethics Committee of Shanghai Ninth People's Hospital,Shanghai Jiao Tong University School of Medicine (Approval Letter HKDL [2017163]). And all experimental animal protocols were carried out by followingGuide for the Care and Use of Laboratory AnimalsandManual for Laboratory Animals Managementof Shanghai Ninth People's Hospital,Shanghai Jiao Tong University School of Medicine.
作者贡献/Authors'Contributions
成桢哲参与数据采集和分析、论文撰写;金晨曦、冯宝怡参与论文修改;郑晓飞参与实验设计;刘祎晴参与论文修改;吴皓参与实验指导;陶永参与实验设计、监督及论文修改。所有作者均阅读并同意了最终稿件的提交。
CHENG Zhenzhe acquired and analyzed the data, and drafted the manuscript. JIN Chenxi and FENG Baoyi revised the manuscript.ZHENG Xiaofei designed the study. LIU Yiqing revised the manuscript. WU Hao participated in the experimental study guidance.TAO Yong designed the study and participated in the manuscript correction. All the authors have read the last version of paper and consented for submission.
·Received:2022-02-18
·Accepted:2022-06-19
·Published online:2022-06-28
