天宫石斛快繁技术研究
2022-08-27王玥瑶杨柳青操赛雨何碧珠郭梨锦
刘 怡, 王玥瑶, 杨柳青, 操赛雨, 燕 鑫, 何碧珠,2, 郭梨锦
(1.福建农林大学园艺学院, 福州350000;2.兰科植物保护与利用国家林业与草原局重点实验室, 福建 福州 350000;3.资源与环境学院,国际镁营养研究所, 福建 福州 350000)
proliferation; rooting
天宫石斛(Dendrobiumaphyllum)为兰科(Orchidaceae)石斛属(Dendrobium)植物,石斛属植物为附生兰[1],是我国最早有文献记录的兰科植物之一,已知全属的种类远远多于7 000种,主要生长区域从亚洲的热带和亚热带地区至澳大利亚和新西兰,在我国主要分布于云南、广西、福建、广州、贵州和台湾等省区[2],目前已经发现的原种有80多个,其中2个变种。石斛兰多生长于海拔100~3 000 m丛林中的树木或岩石上[3],喜温暖、潮湿及冷凉的环境、较耐低温、不耐干旱和高温,忌积水和阳光曝晒,冬季最低温度低于-10 ℃时生理特征会受到影响。
石斛兰为世界应用最广的兰花之一,适应性强,花期长,花形小巧,种类繁多,石斛兰与卡特兰、蝴蝶兰、万带兰并列称为观赏价值最高的四大观赏兰类[4]。石斛兰在生活中应用范围极其广泛,不仅可盆栽,也可作为花篮、花束、新娘捧花等重要花材,是国际鲜切花市场上最重要的鲜切花之一[5]。部分石斛兰品种还具有珍贵的药用价值,铁皮石斛[6]、金钗石斛、马鞭石斛及其相近品种已经被《中国药典》收录。
天宫石斛别名垂枝石斛兰、瀑布兰、倒吊兰,为兰科石斛属落叶性多年生草本[7],原产地从我国云南东南部至西部(富宁、建水、金平、勐腊、勐海、泸水等地)。其花瓣粉红色,唇瓣奶白色并带有绒毛(如图1),唇瓣边缘有流苏状细齿,是石斛兰中极具观赏价值的品种[8]。目前天宫石斛在国内兰花市场鲜有问津,对其生理特性和快繁技术的研究鲜有报道。本研究以天宫石斛兰荚果为外植体,初步探究天宫石斛兰种胚快繁技术,为其应用提供参考。
1 材料与方法
1.1 试验材料
试验材料天宫石斛荚果(图2)采自云南省瑞丽市(97.31′~98.02′E,23.38′~24.14′N),气候为亚热带季风性湿润气候类型,年均气温21 ℃左右[10],年降水量1 394.8 mm。
1.2 试验方法
1.2.1消毒时间处理试验
取成熟度为80%的天宫石斛荚果为外植体,将荚果两端果柄切除,用牙刷蘸取洗衣粉清洗荚果表面杂质,用自来水流水冲洗10 min后,纯水荡洗3~4遍,置超净工作台内用75%乙醇消毒30 s,用2%次氯酸钠分别消毒2、4、6、8、10、12、14 min,无菌蒸馏水冲洗3~4次,用高温消毒过的滤纸吸干荚果表皮残留水分,再用手术刀纵切荚果后夹取荚果内种子,接种15 d后统计污染率,探究天宫石斛荚果适宜消毒时间。

图1 天宫石斛兰盛花期Fig.1 Flowering period of Dendrobium aphyllum

图2 天宫石斛兰荚果Fig.2 Pods of Dendrobium aphyllum
1.2.2荚果萌发与原球茎诱导
将处理过的种子分别接种于①MS+蛋白胨1 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L、②MS+蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L、③MS+蛋白胨1 g/L+香蕉30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L、④MS+蛋白胨1 g/L+地瓜30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L、⑤MS+蛋白胨1 g/L+椰乳30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L、⑥MS+蛋白胨1 g/L+胡萝卜30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L、⑦MS+蛋白胨1 g/L+青瓜30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L诱导培养基(pH值为7.6~7.8),每种培养基分别接种10瓶,共接种70瓶。接种后置于培养室中,将培养室温度控制在(23±2)℃,先暗培养15 d,待种子转绿后(图3),进行光培养(1 600~1 800 lx、每天光照10 h),观察各培养基生长状况,研究不同有机添加物对天宫石斛原球茎诱导的影响。

图3 15 d后天宫石斛兰种子转绿Fig.3 The seeds of Dendrobium aphyllum turn green after 15 days
1.2.3原球茎增殖
将MS+蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L诱导培养基中培养45 d后的原球茎分别转移至添加了6-BA(0.5、1.0、1.5、2.0 mg/L),NAA(0.1、0.3、0.5、1.0 mg/L),白糖(25.0 g/L),琼脂(5.8 g/L),蛋白胨(1.0 g/L),活性炭(1 g/L)的MS培养基中,然后置于温度为(23±2)℃、光照强度为1 600~1 800 lx的培养室中培养,每天光照10 h。每个处理接种3瓶,每瓶接种4~6个原球茎。培养30 d后查看原球茎生长状况,调查不同植物生长调节剂组合对天宫石斛兰原球茎增殖以及分化的影响。
1.2.4生根壮苗诱导
将在增殖分化阶段形成的无根苗转接至添加活性炭(0.3、0.6、0.9、1.2、1.5 g/L),6-BA(1.5 mg/L、NAA 1.0 mg/L),白糖(25.0 g/L),琼脂(5.8 g/L),蛋白胨(1.0 g/L),土豆(30.0 g/L)的MS培养基中,然后置于培养室进行光培养,培养条件与增殖分化培养阶段相同。每个处理接种6瓶,每瓶接种10~15株。分别在培养30 d、60 d时观察苗生长状况,记录不同活性炭用量对天宫石斛兰小苗生根壮苗的影响。
2 结果与分析
2.1 不同消毒处理时间对外植体污染率的影响
种子经消毒处理后,经过15 d暗培养,其中部分接种瓶出现污染,未污染接种瓶种胚转化为深绿色,相当一部分接种瓶出现半污染半转绿状态,由于接种瓶已经污染,后期会出现全部污染的现象,还有一部分接种瓶未出现污染,但种胚一直为黄色,没有转绿,这部分材料呈现出永久休眠状态。由表1可知,75%乙醇(浸泡30 s)+2%NaClO(浸泡10 min)的污染率最低,仅为30%,萌发率最高,达70%,明显优于其他参试组;75%乙醇(浸泡30 s)+2%NaClO(浸泡14 min)的污染率和萌发率都为0。因此,若荚果消毒不彻底易产生污染,荚果消毒处理时间过长[11],则可使天宫石斛兰荚果因受毒害而使种胚出现无法转绿或进入永久休眠状态。

表1 不同消毒时间对天宫石斛荚果消毒效果的影响Table 1 Comparison of disinfection effects of different disinfection times on pods of Dendrobium aphyllum
2.2 种子萌发与原球茎的诱导
天宫石斛兰种子在以MS+蛋白胨1 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L为基础培养基,添加各种有机添加物30 g/L的诱导培养基上先暗培养15 d、再转移至光照(10 h/d)条件下培养,30 d后观察发现所有培养基种子萌发基本完成[12]。研究发现,天宫石斛兰种胚在诱导过程中,各种培养基均不同程度地出现白化现象(图4),其中土豆30 g/L有机添加物的培养基诱导率最高,达95%,白化程度最低,为5%;椰乳30 g/L的有机添加物培养基诱导率最低,仅为10%,白化程度最高,达90%;由表2可知,ck组处理培养基诱导率明显低于添加土豆、香蕉、青瓜有机物的培养基,高于添加地瓜、椰乳、胡萝卜有机物的培养基;由表2可知,各种培养基均出现不同程度白化现象。试验结果表明,土豆、香蕉、青瓜有机物对天宫石斛兰种胚诱导起促进作用,地瓜、椰乳、胡萝卜有机物对天宫石斛兰种胚诱导起抑制作用,其中添加土豆的培养基促进效果最佳,添加椰乳的培养基抑制作用最强;各种培养基中均出现不同程度白化现象,说明培养基中氮含量过高,不适合天宫石斛种胚生长。

图4 部分原球茎出现白化现象Fig.4 Albinism of some protocorms
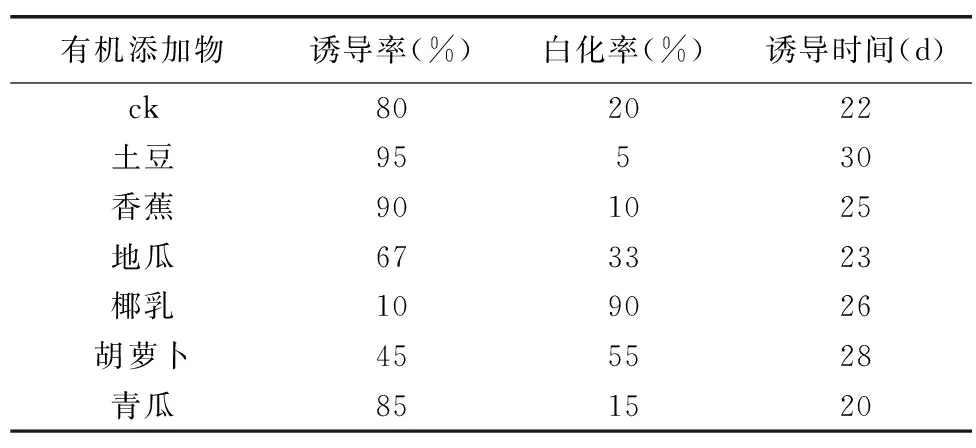
表2 不同有机添加物对天宫石斛原球茎诱导的影响Table 2 Effects of different organic additives on protocorminduction of Dendrobium aphyllum
2.3 6-BA与NAA浓度对天宫石斛原球茎增殖的影响
以MS+蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L为基本培养基,以6-BA和NAA为因素变量,以6-BA和NAA不同浓度为水平变量,设置16个处理(附上不同浓度6-BA和NAA组合,详见表3),每个处理接3次重复。试验结果见表4。
由表4可知,16个组合处理中,处理C 4平均增殖系数最高,达9.4,而平均增殖系数最低的为处理A 2,仅为1.6。研究表明,不同浓度6-BA和NAA组合对天宫石斛原球茎增殖促进作用不同,添加6-BA 1.5 mg/L+NAA 1.0 mg/L的MS+蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L培养基促进效果最明显,而添加6-BA 1.5 mg/L+NAA 1.0 mg/L的MS+蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L培养基促进效果最差。因此,在天宫石斛原球茎增殖阶段,添加6-BA 1.5 mg/L+NAA 1.0 mg/L可以增强天宫石斛原球茎增殖能力[13]。将每一个处理组合增殖原球茎分别接种在相同活性炭浓度培养基中,待生根壮苗后发现,C 4组合处理原球茎在生根壮苗时,叶片繁多、叶色翠绿,根系浓密且粗壮,茎秆直径偏大,颜色呈现浓绿色[13];A 2组合处理原球茎在生根壮苗时,生长植株出现枯死现象并且植株生长状态呈现出叶片稀疏、叶色微微发黄,根系零散且细长,茎秆直径细小颜色淡绿色[14](如图5所示)。结果表明,C 4组合处理原球茎在生根壮苗时要明显优于A 2组合处理。
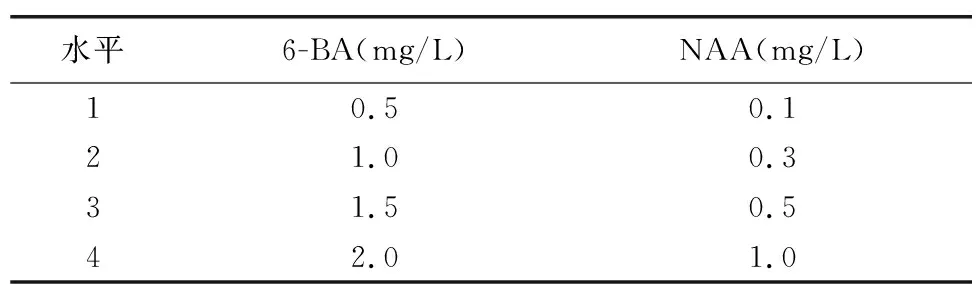
表3 不同激素组合对天宫石斛原球茎增殖影响试验方案Table 3 Effect of different hormone combinations on the increment of protocorm of Dendrobium aphyllum

表4 6-BA与NAA不同浓度对天宫石斛原球茎增殖影响的试验结果Table 4 Effects of different concentrations of 6-BA and NAA concentrations on protocorm proliferation of Dendrobium aphyllum
2.4 生根壮苗培养
选择生长健壮,长势大致相同的天宫石斛丛生芽(如图6)接种到含有不同浓度活性炭(0.3、0.6、0.9、1.2、1.5 g/L)+MS+蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L+6-BA 1.5 mg/L+NAA 1.0 mg/L培养基中,然后置于培养室中,进行连续光照培养,60 d后统计各培养基中生根以及植株生长状况。研究表明,随着活性炭浓度升高,培养基中的平均根数和单株重量都有所增加,其中活性炭浓度为1.2 g/L时,根数多、植株根系生长粗壮且平均根数与单株鲜重均达到最大值;活性炭浓度为0.3 g/L时,根数少、根系生长细长、植株矮小且平均根数与单株鲜重均为最小值。因此,在天宫石斛生根壮苗阶段,添加不同浓度的活性炭对促进生根效果不同,植株生长状况也有所不同[15]。

图5 天宫石斛增殖培养Fig.5 Proliferation culture of Dendrobium aphyllum

图6 天宫石斛丛生芽Fig.6 Clustered buds of Dendrobium aphyllum
3 小结与讨论
3.1 消毒条件的优化选择
本试验在对外植体消毒处理时发现,天宫石斛荚果用2% NaClO消毒,接种后暗培养15 d进行观察统计,发现随着对天宫石斛荚果消毒时间延长,接种瓶污染率降低,当消毒时间为10 min时污染率最低,成活率最高,消毒效果最佳;当消毒时间超过10 min后污染率提高;当消毒14 min时种子出现毒害或永久休眠状态。因此,使用2% NaClO消毒天宫石斛种子处理时,消毒时间控制在10 min消毒效果最佳,污染率仅为30%,这与李艳冬等[16]采用2% NaClO消毒10 min研究结果大致相同。

图7 生根壮苗培养Fig.7 Rrooting and strong seedling culture
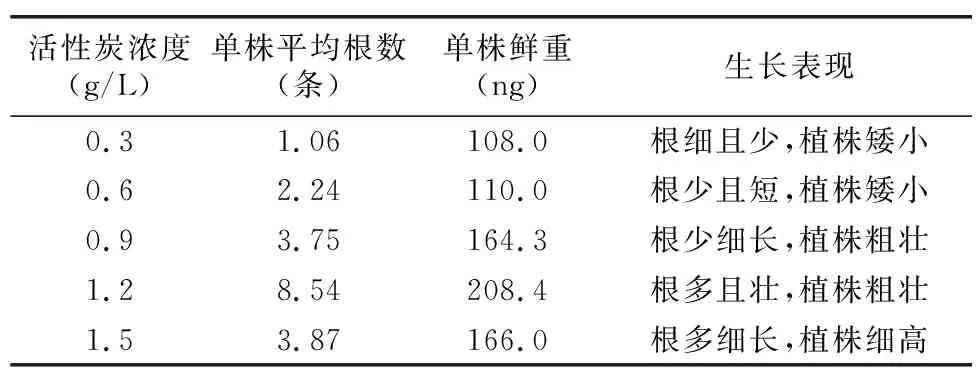
表5 活性炭浓度对天宫石斛生根壮苗的影响Table 5 Effect of activated carbon concentration on Rooting and strong seedlings of Dendrobium aphyllum

图8 天宫石斛移栽苗Fig.8 Transplanted seedlings of Dendrobium aphyllum
3.2 不同培养基对天宫石斛原球茎的影响
探究诱导原球茎过程中发现,以蛋白胨1 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L为基本培养基,分别在培养基中添加土豆、香蕉、地瓜、椰乳、胡萝卜、青瓜有机物。在15 d暗培养后,转入光照培养(每天光照10 h)条件下45 d后观察培养基发现,添加土豆、香蕉、青瓜的培养基中诱导率均高于对照组,其中添加土豆诱导率最高(达95%)。王云惠等[17]诱导原球茎培养基成分构成中未添加任何有机物,诱导时间为60 d,表明添加有机物的培养基可以有效缩短诱导时间。因此,在天宫石斛原球茎诱导阶段,添加土豆有利于天宫石斛原球茎的诱导。

图9 天宫石斛作观赏植物Fig.9 Dendrobium aphyllum as an ornamental plant
植物组织培养过程中,要求无菌生长环境并且需要满足植物生长的必需物质,同时植物生长调节剂是培养过程中不可或缺的因子,不同植物生长调节剂配比对培养物质的生长有重要作用[18]。本试验在天宫石斛原球茎增殖阶段以蛋白胨1 g/L+土豆30 g/L+白糖25 g/L+琼脂5.8 g/L+活性炭1 g/L为基本培养基,添加不同浓度的6-BA与NAA组合,以期获得天宫石斛原球茎增殖阶段6-BA与NAA最佳组合。试验结果表明,6-BA与NAA的16种组合中,均可促进天宫石斛兰原球茎增殖,6-BA 1.5 mg/L+NAA 1.0 mg/L组合增殖天宫石斛原球茎效果最佳,增殖效果高于龚建英等[19]的研究结果。
3.3 活性炭对组培苗的影响
活性炭能够在植物生长过程中吸收毒害物质,而且添加适量活性炭之后,有利于在组培苗的底部形成一个较暗局部环境,有助于组培苗根系生长发育。本研究发现,天宫石斛生根壮苗阶段,活性炭最佳浓度为1.2 g/L,平均根数为8.54,略高于刘扬等[20]的研究结果(7.49),当活性炭浓度≥1.2 g/L时,产生抑制作用,因为活性炭在培养基中吸附有毒害代谢物质的同时,也会吸收培养基中包含的矿物质营养成分,植物生长调节剂以及其他必需维生素[21]。因此,一定要选择最佳活性炭浓度,否则会影响组培苗的生长。
本研究培养过程中出现不同程度白化现象,可能是培养基中氮含量超标[22],其原因有待进一步研究。
