蒜芥茄染色体5 SrDNA、18 SrDNA和端粒序列位点检测及其核型分析
2022-08-27龚亚菊杜光辉蔚亚楠黎志彬吴丽艳
程 捷, 龚亚菊, 杜光辉, 蔚亚楠, 黎志彬, 鲍 锐, 桂 敏, 吴丽艳
(1.云南省农业科学院园艺作物研究所, 昆明 650205; 2.云南大学资源植物研究院, 昆明 650500)
sequence; 5 SrDNA; 18 SrDNA
蒜芥茄(SolanumsisymbriifoliumLam.)为茄科、茄属植物,一年生草本,属于野生茄的一种,主要分布于我国广西和云南,目前在云南省已沦为野生[1]。研究表明,蒜芥茄对青枯病[2]、黄萎病[3]和根结线虫[4]等病虫害具有较强的抗性,与栽培茄存在一定的远缘杂交不亲和,在生产中可作为嫁接砧木。然而,目前就蒜芥茄染色体核型相关的研究较少,其染色体倍性及其在茄科中的分类地位尚不清楚。因此,对蒜芥茄的染色体进行核型分析,明确其在茄科作物中的近缘物种及关系,将对蒜芥茄价值和功能的阐明有一定作用。
染色体核型分析是细胞遗传学研究的基本方法,是研究物种演化、分类以及染色体结构、形态与功能之间关系所不可缺少的重要手段。荧光原位杂交技术FISH(Fluorescence in situ hybridization)是利用荧光标记的特异寡聚核苷酸片段作为探针,与DNA进行杂交,检测已知基因或序列在染色体上定位的方法。相比于传统的核型分析,FISH可以通过荧光标记识别信号位点,更快速准确地检测出染色体的特征;在染色体数目较多、形态较为相似的物种中应用优势较大,操作简便,探针标记稳定,可同时检测几种不同探针。FISH技术已在小麦[5]、玉米[6]、烟草[7]等多个作物上得到了成功应用。
rDNA即核糖体DNA,分为5 SrRNA、5.8 SrRNA、18 SrRNA、28 SrRNA四种类型,其中,5 SrRNA和18 SrRNA常作为探针。5 SrDNA具有串联组织且高拷贝的特性,适合作为标记来确定染色体核型[8]。18 SrDNA序列是生物中较为保守的序列,常用于生物分类分析。端粒是位于染色体末端的双链DNA重复序列,能够维护染色体的稳定,避免染色体之间的末端融合及DNA酶的降解[9]。几乎所有高等植物的端粒都是由端粒重复序列(TTTAGGG)n组成[10]。
目前,关于茄子核型分析的研究较少,只有部分茄子品种的核型被报道[11-12]。基于此,本研究以蒜芥茄为试验材料,应用端粒保守重复序列(TTTAGGG)6、5 SrDNA和18 SrDNA作为探针,对蒜芥茄根尖细胞有丝分裂中期的染色体进行荧光原位杂交检测和分析,明确蒜芥茄染色体核型,以期为蒜芥茄的系统研究和杂交育种奠定理论基础,并为茄子及其近缘野生种的分类学和细胞学研究提供数据参考。
1 材料与方法
1.1 材 料
供试材料蒜芥茄由云南省农业科学院园艺作物研究所收集保存。
1.2 方 法
1.2.1材料准备
蒜芥茄种子在55 ℃温水中浸泡15 min,无菌水冲洗后,在500 mg/L的赤霉素(GA3)中浸泡4 h,无菌水冲洗2~3次后,将种子放于铺有双层滤纸的培养皿(直径为9 cm)中,置于28 ℃光照培养箱中恒温培养至生根。切取生根的蒜芥茄萌发幼苗,将其根尖放入0.5 mL顶端扎孔的离心管中,并放入4 ℃冰箱保存备用。
1.2.2染色体制片
蒜芥茄根尖染色体制片采用武江等[13]的方法并加以改进,具体操作过程如下:
1) 将装有根尖的离心管置于充气罐内,充入0.9~1.0 MPa的笑气(N2O),静置处理2 h。
2) 笑气处理后立即在冰浴条件下将预冷的90%冰乙酸加入离心管内,静置处理10 min。固定后,将冰乙酸吸出,并用ddH2O清洗2次。
(3)由于研究设备缺乏,现阶段研究成果还未得到验证。由于现实情况的限制,诸多研究结果无法直接作用于实际工程建设。
3) 用刀片将根尖白色部分切下,放入装有25 μL酶液(纤维素酶与果胶酶3∶1混合)的0.5 mL离心管中,37 ℃水浴条件下酶解1~2 h。
4) 酶解结束后,用70%的酒精将根尖清洗3次,再用解剖针将根尖在剩余酒精中充分破碎,震荡,4 000 r/min离心后,晾干剩余酒精。
5) 根据根尖数量,在离心管内加入25~45 μL的冰乙酸,瞬时离心后,充分震荡混匀。将洁净的载玻片放置在湿润的盒子中,吸取8 μL混匀的细胞悬浮液,在载玻片正上方滴下后立即将盒子盖上,直到细胞散开,再将载玻片晾干后取出。
6) 将制成的染色体标本在普通光学显微镜下镜检,找到目标分裂相保存备用。
1.2.3荧光原位杂交
选择端粒保守重复序列、5 SrDNA和18 SrDNA作为探针,与蒜芥茄染色体标本进行荧光原位杂交,采用缺口平移法标记探针,端粒保守重复序列为合成的(TTTAGGG)6序列,5 SrDNA探针为质粒pTa 794[14],18 SrDNA探针为质粒pBR 322[15]。
1) 探针标记。用端粒保守重复序列(橙色),5′FAM(绿色,羧基荧光素),TAMRA(红色,四甲基罗丹明)标记的dUTP进行标记。探针标记各成分为:labeled dUTP 4 μL、DNA 1 μg、ddH2O 16 μL,总体系为20 μL。探针标记过程避光,将各成分离心混匀,放入16 ℃水浴锅过夜。
2) 原位杂交。将50~100 mL的70%甲酰胺溶液滴在染色体制片上,盖上盖玻片,放入80 ℃杂交箱处理2 min。迅速甩掉盖玻片,依次放入-20 ℃预冷的70%、95%、100%的酒精中各处理5 min。取出后,自然风干。将配好的杂交液[由7.5 μL去离子甲酰胺,1.5 μL 20×SSC,1.5 μL ssDNA(鲑鱼精DNA),1.5 μL B-DNA(封阻DNA),3 μL 50%DS(葡聚糖)和1 μL Probe(探针)组成]瞬时离心,放入80 ℃杂交箱变性8~10 min,迅速取出离心管,放入冰水混合物中处理5 min以上。将杂交液滴在载玻片上,轻轻盖上盖玻片,避免产生气泡,用指甲油封住盖玻片四周。将载玻片放入湿润盒内,在37 ℃杂交箱中杂交过夜。
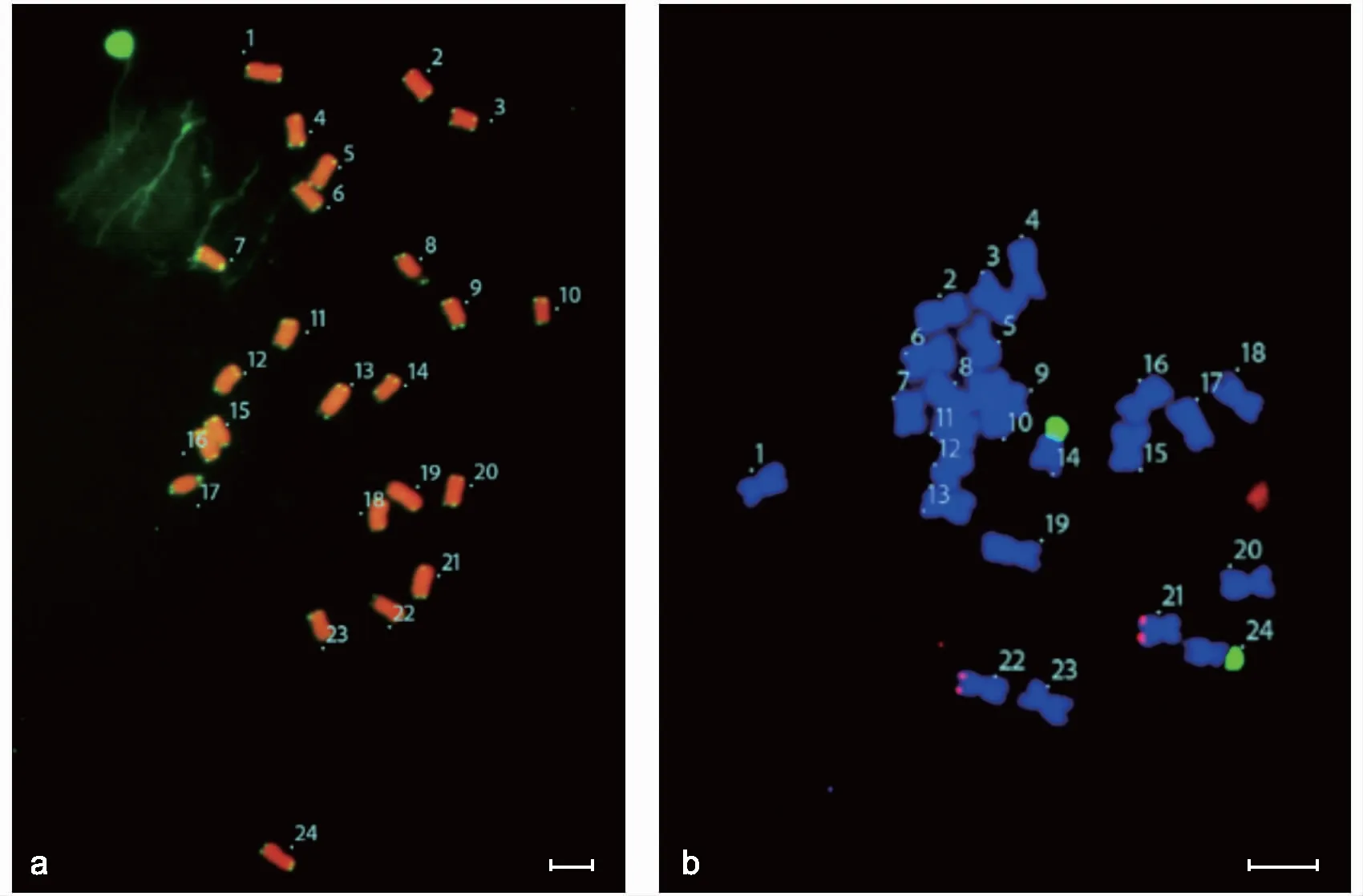
注:a为端粒的DAPI染色;b为5 SrDNA和18 SrDNA荧光杂交;图中标尺5 μm。图1 蒜芥茄端粒保守重复序列、5 SrDNA位点(红色信号)和18 SrDNA位点(绿色信号)及其染色体分布Fig.1 Conserved telomere repeat sequence,5 SrDNA sites (red signal),18 SrDNA sites (green signal) and chromosome distribution of S. sisymbriifolium Lam
4) 镜检。将制片在Olympus BX 70荧光显微镜的DP 70 CCD下镜检拍照。
1.2.4染色体核型数据的处理和分析
选取30个染色体分散较好的细胞,统计各细胞染色体数目。选取5个清晰的细胞的染色体中期图片,利用Photoshop软件对每一组染色体的全长、长臂和短臂进行测量,取其平均值,计算染色体长度、臂比等。核型分析参照李懋学和陈瑞阳[16]、李懋学和张赞平[17]的方法,核型模式图的绘制按照乔永刚和宋芸[18]的方法。
2 结果与分析
2.1 蒜芥茄染色体荧光原位杂交结果
端粒保守重复序列的DAPI染色结果(图1 a)表明,细胞染色体数目为24,端粒序列(绿色荧光)位于染色体两端,未发现染色体异常的细胞。蒜芥茄染色体的5 SrDNA和18 SrDNA定位结果(图1 b)表明,蒜芥茄染色体上具有1对5 SrDNA杂交位点(红色信号)和1对18 SrDNA杂交位点(绿色信号)。
2.2 蒜芥茄核型分析
通过对蒜芥茄染色体长度、长臂和短臂等数据进行测量、统计和分析可知(见表1),蒜芥茄染色体相对长度变幅为6.95%~9.88%,着丝粒指数在40.28%~48.67%之间;染色体臂比值在1.05~1.48之间,为中部着丝粒染色体(m);最长染色体与最短染色体之比为1.42,核型不对称系数为54.73%,核型不对称性属1 A型;核型公式为:2 n=2 x=24=24 m(2 SAT)。
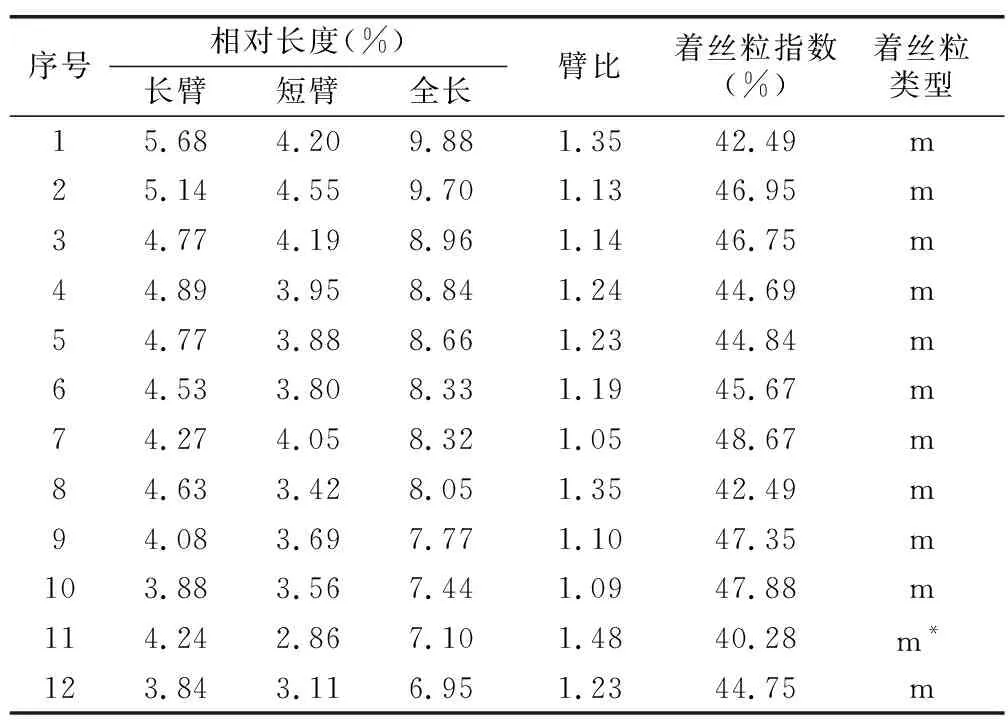
表1 蒜芥茄染色体的核型参数Table 1 Karyotype parameters of the chromosome in S. sisymbriifolium Lam
按总长度由长至短,对染色体进行排列与编号,绘制核型模式图(见图2)。结合2.1中荧光原位杂交结果可知,蒜芥茄染色体上的5 SrDNA杂交位点,位于第10组染色体短臂的近端部上;随体和18 SrDNA杂交位点,均位于第11组染色体上。

图2 蒜芥茄染色体核型模式Fig.2 Chromosome karyotype pattern of S. sisymbriifolium Lam
3 讨 论
染色体核型分析可确定染色体的整体特征,有助于物种间亲缘关系的分析,揭示其遗传进化的过程和机制,也是分析生物染色体数目和结构变异的基本手段之一。茄科植物虽然在起源分类、遗传育种及栽培生理等方面研究深入,但有关染色体核型分析也仅限于个别种,种间的比较分析更少。本研究首次进行蒜芥茄染色体的核型分析,可为其遗传进化提供细胞学上的理论依据,还可为其远缘杂交奠定理论基础。
端粒是位于染色体末端能够保护染色体维持其稳定性的特殊DNA-蛋白复合物,与细胞分裂、衰老及寿命都有着紧密的联系。由于端粒相关序列在同一生物的不同染色体之间的相似性较低,因此,端粒相关序列可作为基因组作图的染色体连锁群端点标记,用以研究染色体端部结构特性和染色体类型[19]。根据不同染色体的端粒信号特点,可从分子层面辅助染色体的配对,相较传统方法更方便准确。本研究对蒜芥茄进行端粒重复序列的荧光原位杂交,明确其染色体的数目为24条,端粒序列(TTTAGGG)6位于每条染色体两端。He等[20]对茄子、马铃薯、番茄等9种茄科植物进行端粒重复序列的荧光原位杂交,发现每条染色体端部都有荧光信号,在一些染色体上还有间质信号。本研究并未发现间质信号,但有端部信号,表明茄科植物染色体两端的端粒重复序列有一定的保守性。有研究表明,端粒长度在茄科番茄和烟草的发育过程中没有明显变化[19],但端粒结构可能会发生变化,如重复序列的改变或重排等,尤其是在衰老组织中。因此,确定蒜芥茄中端粒重复序列(TTTAGGG)6的位点,并进一步研究其序列的排列状况,有助于研究端粒调控衰老的机制。除此之外,端粒序列的荧光杂交在研究染色体缺失、重复等变异中也有一定作用。王海波等[21]利用端粒重复序列鉴定马铃薯和茄子体细胞杂种染色体的变异情况,发现部分重排染色体着丝粒区域有端粒重复序列,推测部分染色体是由末端相连的方式重排。端粒DNA序列还可以作为细胞和分子遗传图谱的末端标记,整合分子遗传图谱与经典遗传图谱。因此,在本研究基础上进一步分析蒜芥茄及栽培茄的端粒杂交信号,有助于明确蒜芥茄在茄科中的遗传关系和分类地位。
5 SrDNA是绝大多数生物核糖体大亚基的一个组成部分,其功能在真核生物中还不太清楚。5 SrDNA基因家族通常以高拷贝串联重复形式存在于基因组中,有2 000~5 000个拷贝,且常不与其他重复序列(如26 S-5.8 S-18 S)串联在一起,其基因序列较保守[22]。18 SrDNA属于45 SrDNA的一部分,45 SrDNA主要位于细胞核核仁区,参与核仁形成,一般在染色体的次缢痕部位与随体相连,因此45 SrDNA的杂交位点数目一般为随体染色体的数目[23]。从本研究结果可以看出,蒜芥茄染色体上有1对5 SrDNA位点在第10组染色体上,1对18 SrDNA杂交位点在第11组随体染色体上。王海波等[21]对栽培茄进行荧光原位杂交,发现其5 S rDNA定位在1号染色体上,而本研究中的5 SrDNA位点却在10号染色体上,表明栽培茄与野生蒜芥茄在细胞学上有一定的分化。王金英等[7]对野生烟草染色体进行FISH定位分析,发现了2个5 SrDNA位点和2个18 SrDNA位点,实现了5 SrDNA和18 SrDNA在烟草中期染色体上的同时定位,而以上结果和本研究发现的位点个数是一致的。同时,Chiarini[24]对银叶茄(S.elaeagnifolium)进行荧光原位杂交,发现二倍体表现出1对18 S信号和1对5 S信号,而四倍体和六倍体的FISH标记信号与染色体倍性水平成正比。Chiarini等[25]还通过荧光原位杂交技术研究了茄属9种植物的染色体特征,发现所有物种均有1对5 SrDNA和18 SrDNA位点,很少的物种有2对5 SrDNA,据此推测茄科植物5 S和18 S位点在进化中较稳定,适合作为荧光标记来辅助核型分析。
本研究对蒜芥茄进行核型分析,得出其染色体数目为24条,核型为较原始的1 A型,该核型与祝海燕等[12]对野生茄托鲁巴姆的核型分析结果一致,而詹园凤等[26]对两种栽培茄核型分析的结果为2 A型,表明蒜芥茄的染色体变异较小、进化程度较低,与栽培茄亲缘关系较远。此外,祝海燕等[12]通过对栽培茄快青和野生茄托鲁巴姆、红刺茄等进行染色体核型分析发现,3个材料的染色体数目均为2 n=2 x=24,且都只有1对带随体的染色体(SAT-染色体),此结论与本研究结果一致。但是,本研究蒜芥茄的随体位于11号染色体,而托鲁巴姆、红刺茄的随体分别位于5号、4号染色体[12]。据此推测,蒜芥茄与这两种野生茄在进化上有一定的分化。Rego等[27]研究了茄属16种植物的核型特点,发现所有物种染色体均为2 n=24,表明茄科植物的核型在染色体数目和形状上较保守,对称性变化不大。吴世斌和李正理[28]研究了西双版纳几种野生茄的染色体数目和形态,发现不同类型的野生茄染色体核型差异较大。因此,野生茄之间的核型差异很可能是导致其形态特征差异的因素。但有关茄属植物的种间核型差异与外部形态差异的关系还有待进一步深入研究。
4 结 论
通过细胞遗传学手段鉴定了蒜芥茄的染色体倍数为2倍体,核型公式为2 n=2 x=24=24 m(2 SAT),属于较对称的1 A型原始核型。借助于荧光原位杂交技术,确定了端粒序列(TTTAGGG)6位于蒜芥茄染色体的两端,识别了1对5 SrDNA和1对18 SrDNA信号位点分别位于10号和11号染色体上。
