Omi/HtrA2 抑制剂对蛛网膜下腔出血大鼠早期脑损伤的影响
2022-08-26程振宇申屠华松陈亦华何忠平俞北伟王瑞权傅斌
程振宇,申屠华松,陈亦华,何忠平,俞北伟,王瑞权,傅斌
自发性蛛网膜下腔出血(SAH)可直接破坏脑组织,诱发剧烈的炎症反应;同时破坏血脑屏障通透性,加重脑水肿。各种因素聚集造成神经细胞凋亡,诱发SAH 后的早期脑损伤[1-2]。Omi/HtrA2 是一种参与细胞凋亡的线粒体丝氨酸蛋白酶,而UCF-101 是Omi/HtrA2 特异性抑制剂[3]。动物实验显示,UCF-101 可显著抑制脑缺血神经细胞凋亡[4],改善外伤性脊髓损伤[5],也可明显降低脓毒症性脑病脑炎症反应和神经细胞凋亡及改善血脑屏障通透性[6-8]。本研究观察UCF-101 腹腔注射对SAH 大鼠脑组织炎症反应、脑水肿、血脑屏障通透性、神经细胞凋亡及相关蛋白表达的影响,旨在揭示Omi/HtrA2抑制剂对大鼠SAH后早期脑损伤的保护作用并探讨其作用机制,现报道如下。
1 资料与方法
1.1 材料 健康Wistar 大鼠(上海斯莱克实验动物有限责任公司),雄性,清洁级,体质量250~300 g;UCF-101(规格:5 mg/支,德国Calbiochem公司);ApoAlert细胞凋亡检测试剂盒(规格:100T/盒,美国Biosciences Clontech 公司);白介素-1(IL-1)、IL-6 和 肿瘤坏死因子-(TNF-)酶联免疫分析试剂盒(规格:96孔/kit,武汉艾美捷科技有限公司);酶免疫分析仪(型号:iMark,美国Biorad 公司);脱色摇床(型号:TY-80B,常州澳华仪器有限公司);转印槽(型号:Trans-Blot,美国Biorad 公司);电泳仪(型号:DYCP-31C,北京六一生物科技有限公司);小型垂直电泳槽(型号:164-8001,美国Biorad 公司);生物倒置显微镜(型号:IX-71,中国奥林巴斯有限公司)。
1.2 动物模型制备 本研究经医院伦理委员会审核,按照随机数字表法将120只大鼠分成 Sham 组、SAH 组和UCF-101 组,每组40 只。根据指标测定的需要每组大鼠又被分成4 个亚组,各10 只大鼠,分别用于蛋白表达、细胞凋亡、脑水肿和血脑屏障通透性测定。采用Roux 等建立的枕大池二次注血法制作SAH 大鼠模型,Sham 组大鼠注入等量0.9%氯化钠注射液。在手术操作前0.5 h,UCF-101 组大鼠腹腔注射UCF-101(剂量:3.0mol/kg),其余两组大鼠腹腔注射0.9%氯化钠注射液(剂量:10 ml/kg)。在24 h 后,处死大鼠进行指标测定。
1.3 Western-blotting 检测 大鼠脑组织经细胞裂解、离心及蛋白浓度测定后,经凝胶电泳、电转移和室温封闭,加入兔抗大鼠 AQP-9、MMP-9、Occludin、Claudin-5、ZO-1、TIMP-1 和GAPDH 单克隆抗体孵育过夜,洗膜,加入辣根过氧化物酶标记的羊抗兔IgG二抗室温摇床孵育,洗膜,化学发光试剂作用,X 光胶片曝光、冲洗并扫描。采用quality one软件分析杂交条带灰度值,以GAPDH水平为内对照,比较相对灰度值。
1.4 细胞凋亡检测 将大鼠脑组织进行4%多聚甲醛固定24 h后,脱水、透明、浸蜡进行包埋。4 m 厚度切片,60 ℃烤片3 h,切片脱蜡。根据ApoAlert TUNEL细胞凋亡检测试剂盒说明书进行操作,最后用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像,计算凋亡神经细胞比例。
1.5 酶联免疫吸附法测定 取脑组织标本研磨后置于离心管中,用高速匀浆器在沐浴中进行匀浆,以20 000 r/min 离心10 min,提取上清液按照试剂盒说明书操作,采用酶联免疫吸附试验检测IL-1、IL-6 和TNF-浓度。
1.6 脑组织含水量测定 在10%水合氯醛麻醉下,大鼠断颈处死,迅速取脑称重,在80℃条件下的恒温箱中烘烤48h后再次称重两次,两次测定值之差<0.2mg,采用公式计算脑水肿指数:脑水肿指数=(湿重-干重)/湿重×100%。
1.7 血脑屏障渗透性测定 采用测定脑组织中伊文氏蓝含量来确定大鼠血脑屏障的渗透性。首先建立伊文氏蓝标准回归曲线,然后经股静脉注射伊文氏蓝,处死大鼠,根据标准向左心室灌注0.9%氯化钠注射液,切取颞底组织并称重。脑组织与50%三氯乙酸溶液混匀后离心,取上清液,应用紫外分光光度仪进行比色,根据标准曲线计算出伊文氏蓝含量,结果以g/g 脑组织表示。
1.8 统计方法 采用SPSS 19.0 统计软件,数据以均数±标准差表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脑组织炎症因子表达SAH 组、UCF-101 组大鼠脑组织IL-1、IL-6 和TNF-表达水平高于Sham组(均P <0.05),且SAH 组各指标均高于UCF-101 组(均P <0.05)。见表1。
表1 各组大鼠脑组织IL-1、IL-6 和TNF-表达水平 pg/mg
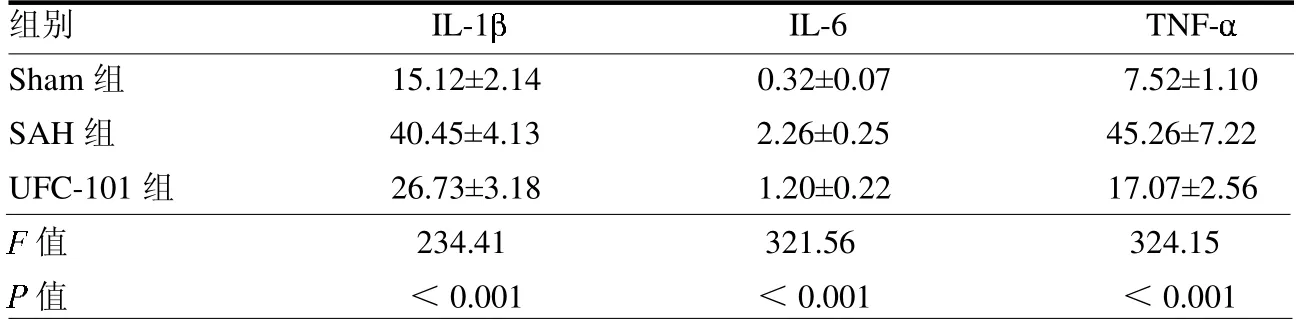
表1 各组大鼠脑组织IL-1、IL-6 和TNF-表达水平 pg/mg
2.2 各组大鼠血脑屏障通透性和内皮细胞紧密连接蛋白表达 SAH 组、UCF-101 组大鼠脑组织 occludin、claudin-5 和ZO-1 蛋白表达均低于Sham组(均P <0.05),且SAH组上述指标均低于UCF-101 组(均P <0.05);SAH组、UCF-101 组血脑屏障通透性均高于Sham 组(均P <0.05),且SAH 组高于UCF-101 组(P <0.05)。见表2。

表2 各组大鼠血脑屏障通透性和内皮细胞紧密连接蛋白表达
2.3 各组大鼠脑水肿指数和基质蛋白表达 SAH 组、UCF-101 组大鼠脑组织TIMP-1 蛋白表达均低于Sham 组(均P<0.05),SAH 组低于UCF-101 组(P <0.05)。SAH 组、UCF-101 组大鼠脑水肿指数、脑组织MMP-9 和AQP-9 蛋白表达均高于Sham组(均P<0.05),且SAH组上述各指标均高于UCF-101 组(均P<0.05)。见表3。

表3 各组脑水肿指数和基质蛋白表达
2.4 各组大鼠脑组织神经细胞凋亡情况 Sham 组、SAH 组和UCF-101 组大鼠脑组织凋亡神经细胞比例依次是(5.92±1.00)%、(26.68±4.92)% 和(15.85±2.24)%(F=219.45,P <0.001)。SAH组、UCF-101 组大鼠脑组织凋亡神经细胞比例高于Sham组(均P<0.05),且SAH 组高于UCF-101 组(均P <0.05)。见封三彩图2。

图2 各组大鼠脑组织神经细胞凋亡情况
3 讨论
SAH 后早期脑损伤的病理生理机制相当复杂,涉及炎症反应、细胞凋亡、血脑屏障的破坏及脑水肿的形成等。这一系列过程由诸多蛋白参与和调节,从而维持一个相对平稳的状态[9-11]。在急性脑损伤后,脑组织中的炎症因子、内皮细胞紧密连接蛋白、水通道蛋白和基质蛋白(如IL-1、IL-6、TNF-、AQP-9、MMP-9、Occludin、Claudin-5、ZO-1 和TIMP-1 等)的表达水平均会发生不同水平的改变,IL-1、IL-6、TNF-、AQP-9和MMP-9 蛋白表达水平上调,Occludin、Claudin-5、ZO-1 和TIMP-1 蛋白表达水平下降。这些蛋白表达水平的改变,造成脑组织稳态的破坏,出现了神经细胞凋亡和脑炎症反应的加剧,以及血脑屏障的破坏及脑水肿的形成[1-2]。本研究显示,SAH大鼠神经细胞凋亡、脑水肿和血脑屏障通透性加重的同时,也伴有上述蛋白表达水平的改变。因此,通过检测上述蛋白在脑组织中的表达水平也一定程度上反映了SAH 大鼠脑损伤的程度。
Omi/HtrA2 是一种线粒体丝氨酸蛋白酶,可以增强含半胱氨酸的天冬氨酸蛋白水解酶活性,从而参与细胞凋亡[3]。UCF-101 是Omi/HtrA2 特异性抑制剂,可以抑制急性肺炎大鼠肺炎症反应和细胞凋亡[12],也可以抑制帕金森氏病大鼠的内质网氧化应激反应[13],同时对脑缺血大鼠的神经细胞凋亡的抑制作用表现明显[4],且可降低脓毒症脑部大鼠炎症反应、神经细胞凋亡和血脑屏障通透性[6-8]。因此,Omi/HtrA2 抑制剂对SAH 大鼠脑损伤可能具有保护作用。研究提示,采用Omi/HtrA2 抑制剂UCF-101 腹腔注射治疗实验性缺血性脑损伤、外伤性脊髓损伤和脓毒症性脑病具有一定效果[4-8]。关于UCF-101 腹腔注射的剂量没有统一的标准,用于脑缺血和脓毒血症脑病大鼠腹腔注射的UCF-101剂量分别是1.5mol/kg[4]和10mol/kg[6]。本研究采用的UCF-101腹腔注射的剂量是3mol/kg,结果显示,使用UCF-101 腹腔注射对SAH大鼠进行治疗可以显著逆转SAH 造成的大鼠脑组织 IL-1、IL-6、TNF-、AQP-9、MMP-9、Occludin、Claudin-5、ZO-1 和TIMP-1 蛋白表达水平的变化,降低神经细胞凋亡,改善血脑屏障通透性和减轻脑水肿。因此,UCF-101 对SAH 大鼠脑损伤可能具有显著保护作用,其机制可能与其修复血脑屏障、减轻脑水肿、抑制促炎因子释放和降低神经细胞凋亡有关。
综上所述,本研究初步揭示了Omi/HtrA2 抑制剂UCF-101 对SAH 脑损伤的保护作用及机制,为下一步继续研究UCF-101 做为SAH 脑损伤治疗新药提供一定的理论依据。
