多囊卵巢综合征患者腰臀比与糖脂代谢、胰岛素样生长因子-1及胰岛素抵抗的相关性
2022-08-25王雁周扣兰李熠钱丹娟李肖肖
王雁,周扣兰,李熠,钱丹娟,李肖肖
(南京医科大学附属江苏盛泽医院妇产科,江苏 苏州 215200)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是由遗传和环境因素共同参与的内分泌紊乱性疾病,在育龄女性中的发病率为6%~21%,患者主要表现为月经紊乱、痤疮、卵巢多囊性改变等症状,致女性远期心血管疾病和代谢综合征等发生风险增加[1]。PCOS发生机制复杂,其中肥胖女性的PCOS发病率明显增高[2]。目前一般采用体质量指数(body mass index,BMI)作为整体肥胖的衡量指标,但是BMI正常或偏低者PCOS的发病率仍然较高[3]。腹型肥胖患者脂肪组织位于腹部皮下、腹腔脏器等处,为PCOS患者肥胖的主要类型。研究发现,与周围型肥胖相比,腹型肥胖患者内脏脂肪占比高致患者炎症因子分泌增多,并进一步增加远期心血管疾病发生风险[4]。腰臀比可反映机体腹部脂肪积聚情况,为常用的腹型肥胖指标,与BMI相比,腰臀比在反映PCOS患者机体代谢紊乱中的应用效果更佳[5]。
胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)属于单链碱性蛋白,其结构与胰岛素相似,与PCOS患者胰岛素抵抗(insulin resistance,IR)的发生明显相关,但是其与腰臀比的关系尚未明确[6]。IR可使机体对葡萄糖的利用能力下降,致使胰岛素分泌增加,促使高胰岛素血症等的发生,为PCOS发生的重要病理基础[7]。既往针对PCOS患者腰臀比的研究多集中于与BMI的对比,关于腰臀比与IGF-1的相关性,以及在预测PCOS患者糖脂代谢异常、IR中是否具有一定的应用价值尚不清楚[8]。因此,本研究拟通过比较不同腰臀比 PCOS患者的糖脂代谢指标、IGF-1及IR水平,分析PCOS患者腰臀比与糖脂代谢、IGF-1、IR的相关性,以及对糖脂代谢异常、IR的预测价值。
1 对象与方法
1.1 研究对象
选择2018年1月至2021年9月南京医科大学附属江苏盛泽医院收治的PCOS患者110例作为PCOS组,年龄19~40岁,平均(29.49±6.02)岁,BMI为20~32 kg/m2,平均(25.63±3.82)kg/m2;另选择同期入院的健康体检者60例作为对照组,年龄18~39岁,平均(29.64±5.96)岁,BMI为19~31 kg/m2,平均(25.79±4.10)kg/m2。两组BMI、年龄等基线资料比较差异无统计学意义(P均>0.05),具有可比性。受试者均知情同意,本研究经江苏盛泽医院伦理委员会审核后进行。
PCOS诊断标准[9]:未见或稀发排卵;超声下可见至少单侧卵巢卵泡数超过12个(直径为2~9 mm),或体积超过10 mL;伴有多毛、痤疮等高雄激素体征,或者经实验室等相关检查,确诊为高雄激素血症;符合上述3条中任意2条,且无库欣综合征等其他可导致高雄激素血症的疾病。
纳入标准:PCOS组符合上述关于PCOS的诊断标准;对照组身体健康,无PCOS;年龄18~40岁;资料完整;认知功能正常。排除标准:感染性疾病;甲状腺功能障碍;酗酒;子宫内膜异位症等其他生殖系统疾病;近3个月激素使用史;肝肾等功能异常;心血管疾病;近3个月影响糖脂代谢药物使用史。
1.2 研究方法
1.2.1 临床资料收集 收集受试者BMI、年龄等基线资料。
1.2.2 腰臀比测定 受试者采取站立位,分别用皮尺测定腰围和臀围,计算腰臀比。腰臀比=腰围(cm)/臀围(cm),其中女性腰臀比≥0.80为腹型肥胖[10]。将PCOS组中腰臀比≥0.80的患者纳入腹型肥胖组,<0.80的患者纳入非腹型肥胖组。
1.2.3 血样采集及处理 采集受试者空腹肘部静脉血5 mL置于抗凝管中,3 500 r/min离心15 min后取血清,置于-80 ℃下保存待检。
1.2.4 血脂代谢指标测定 由检验科专业技术人员采用酶偶联比色法测定总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、三酰甘油(triglyceride,TG),采用德国罗氏P800全自动生化分析仪及配套试剂进行。血脂代谢异常标准:TG≥1.70 mmol/L,TC≥5.18 mmol/L,LDL-C≥3.37 mmol/L或HDL-C≤1.04 mmol/L。
1.2.5 血糖代谢指标测定 由检验科专业技术人员采用酶偶联比色法测定空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 h postprandial blood glucose,2 h PBG),用德国罗氏P800全自动生化分析仪及配套试剂进行;采用电化学发光法测定空腹胰岛素(fasting insulin,FINS)水平,采用德国西门子ADVIA CentaurCP全自动化学发光免疫分析仪及配套试剂。同时计算稳态模式IR指数(homeostasis model assessment for insulin resistance,HOMA-IR),HOMA-IR=FPG×FINS/22.5。血糖代谢异常:FPG≥6.10 mmol/L,或2 h PGB≥7.80 mmol/L;IR:HOMA-IR≥2.69。
1.2.6 ELISA法测定IGF-1水平 严格按照说明书进行,加样后,于37 ℃下温育120 min;加入酶标工作液、底物工作液后,加入终止液,采用美国伯乐imark酶标仪于450 nm下测定光密度值,计算IGF-1水平。试剂盒由武汉伊莱瑞特生物科技股份有限公司提供。
1.3 统计学分析

2 结果
2.1 PCOS组和对照组糖脂代谢指标以及其他指标比较
与对照组相比,PCOS组腰臀比、2 h PBG、LDL-C、TG、FINS、IGF-1、HOMA-IR水平均明显增高,HDL-C水平明显降低(P均<0.05)。PCOS组和对照组FPG、TC水平比较,差异无统计学意义(P均>0.05)。见表1。
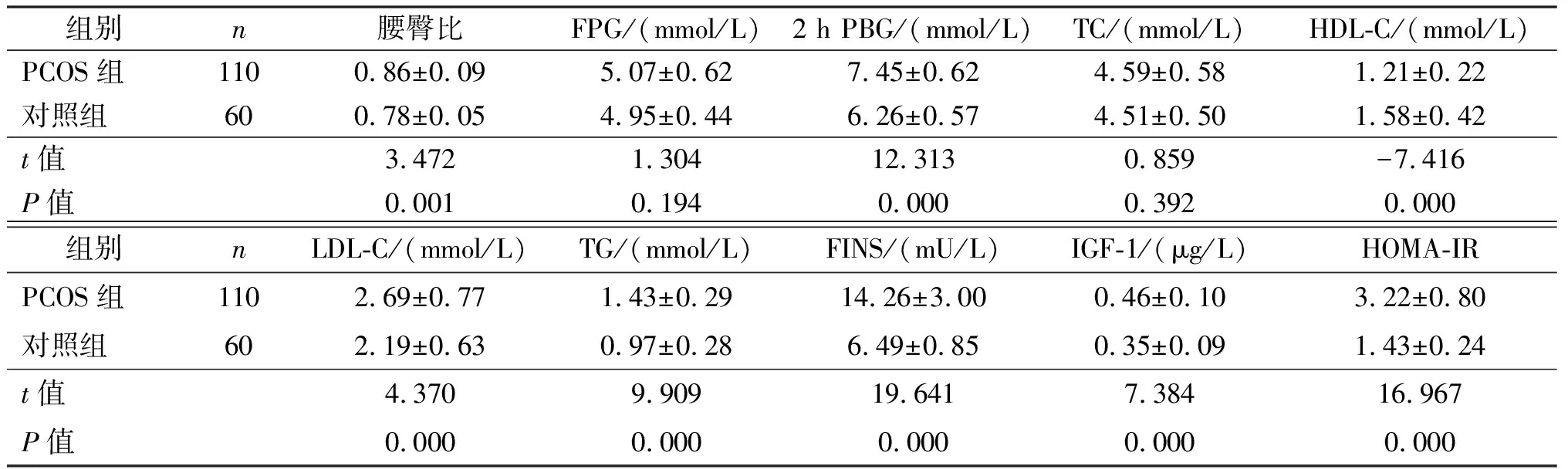
表1 两组糖脂代谢指标、IGF-1以及HOMA-IR比较
2.2 腹型肥胖组和非腹型肥胖组糖脂代谢指标以及其他指标比较
与非腹型肥胖组相比,腹型肥胖组2 h PBG、LDL-C、TG、FINS、IGF-1、HOMA-IR水平明显增高,HDL-C水平明显降低(P均<0.05)。腹型肥胖组和非腹型肥胖组FPG、TC水平比较,差异无统计学意义(P均>0.05)。见表2。
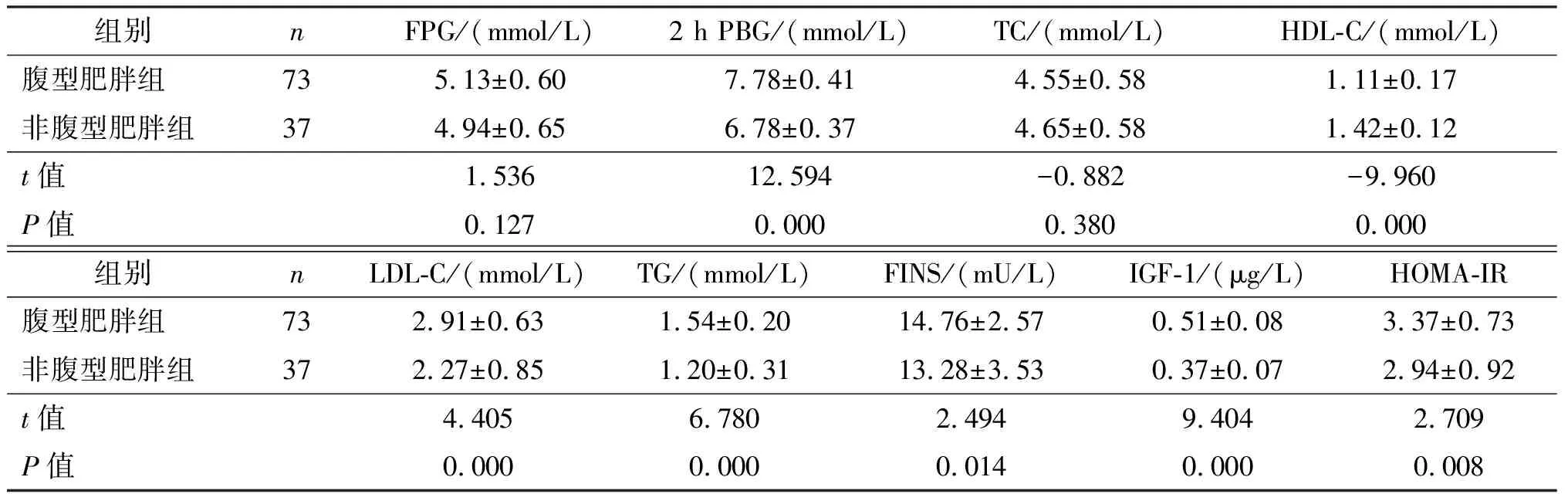
表2 腹型肥胖组和非腹型肥胖组PCOS患者糖脂代谢指标、IGF-1以及HOMA-IR比较
2.3 PCOS患者腰臀比与糖脂代谢指标及其他指标相关性分析
PCOS患者腰臀比与2 h PBG、TG、IGF-1、HOMA-IR呈明显正相关(r分别为0.771、0.546、0.671、0.552,P均<0.05),与HDL-C呈明显负相关(r=-0.692,P<0.05),与LDL-C、FINS呈弱相关(r=0.390、0.233,P均<0.05),与FPG、TC无明显相关性(P均>0.05)。
2.4 腰臀比对PCOS患者糖脂代谢异常及IR的预测价值
曲线下面积(area under the curve,AUC)>0.7提示预测价值较好。结果显示,腰臀比对PCOS患者血糖、血脂代谢异常及IR预测的AUC均>0.7,提示腰臀比对三者的预测价值均较好。见表3,图1。

表3 腰臀比对PCOS患者糖脂代谢异常及IR的预测价值
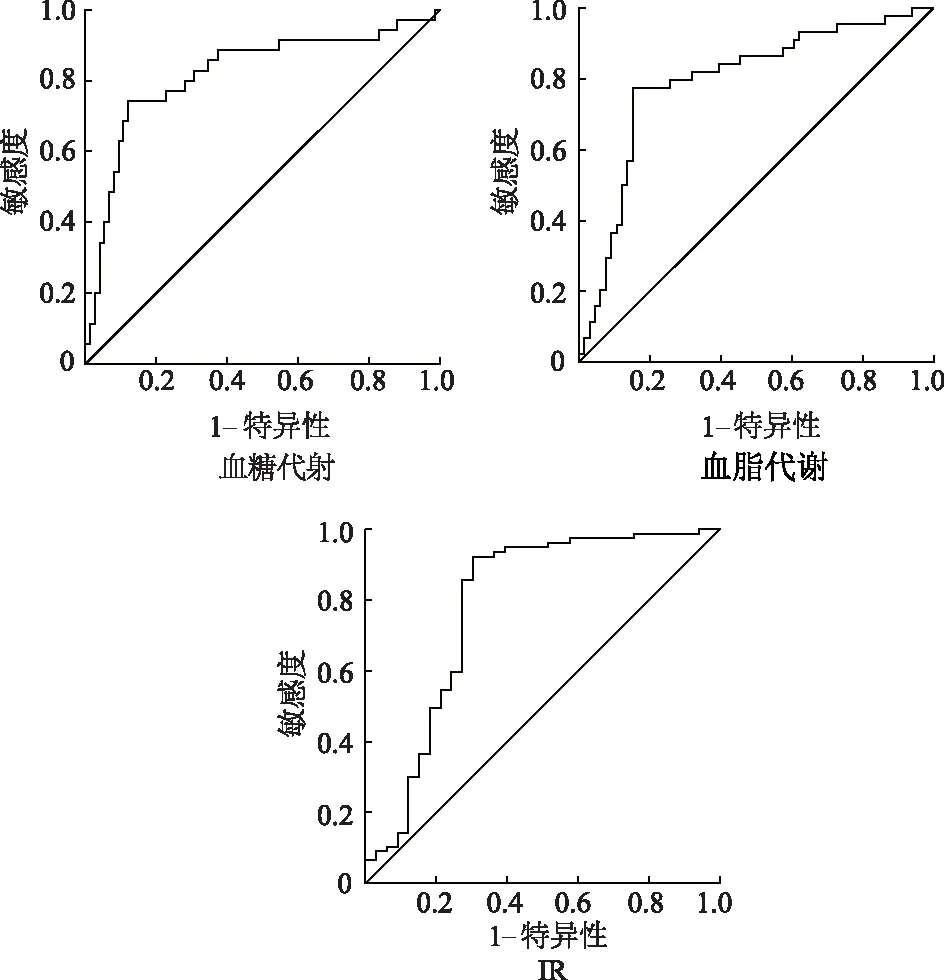
图1 ROC曲线分析腰臀比对PCOS患者血糖、血脂代谢异常及IR的预测价值
3 讨论
Hudecova等[11]研究发现,与健康女性相比,PCOS患者糖耐量受损发生率明显增高,且胰岛素敏感性下降,但是β功能未受明显影响。Ng等[12]对199例PCOS患者进行长期随访,结果发现,正常体重和超重PCOS患者糖尿病发生风险明显提高,且腰臀比与PCOS患者进展为T2DM明显相关。Perona等[13]研究则认为腰臀比与女性血糖水平并无明显相关性。本研究中,PCOS组和对照组FPG水平比较,差异无统计学意义,但是PCOS患者2 h PBG水平明显高于对照组,提示PCOS患者可能存在一定的胰岛素分泌障碍,致2 h PBG升高;与非腹型肥胖PCOS患者相比,腹型肥胖患者2 h PBG水平明显增高,提示腹型肥胖可使患者糖代谢紊乱进一步加重。目前研究认为这可能与IR相关[7],但是具体机制仍需深入分析。
研究发现,中心肥胖可致PCOS患者的血脂代谢紊乱[14],但是关于具体血脂代谢指标与腰臀比、PCOS的相关性仍具有一定争议。Vrbíková等[15]发现,与健康青少年相比,PCOS青少年患者具有明显的血脂紊乱和IR,主要表现为血清LDL-C水平升高,HDL-C水平降低,但是腰臀比、TC、TG水平比较,差异并无统计学意义。Mu等[16]研究发现,对于体重正常但是表现为中心肥胖的PCOS患者,在调整年龄差别后,其发生IR、TG升高、HDL-C降低的风险更高。Franik等[17]研究发现,与腰臀比<0.80女性相比,腰臀比≥0.80的PCOS女性FPG、2 h PBG、HOMA-IR、TG、TC、LDL-C水平均明显升高,HDL-C水平明显下降,进一步提示腹部肥胖可加重PCOS患者的糖脂代谢紊乱。本研究中,PCOS患者脂代谢异常主要表现为TG、LDL-C水平升高以及HDL-C水平下降,腹型肥胖组患者血脂紊乱更严重,且腰臀比与TG、HDL-C均具有明显的相关性。这可能是由于腹型肥胖患者脂肪堆积促使脂联素、IL-6等炎性因子的分泌增加,使机体处于慢性炎症状态,影响下丘脑-垂体-卵巢轴功能,促使雄激素、皮质醇等分泌异常,使机体血脂代谢紊乱加重[18]。此外,腹型肥胖患者腹腔脂肪组织中脂肪分解率提高,可使游离脂肪酸水平提高,游离脂肪酸可直接通过门脉循环到达肝脏,促使TG合成;还可使脂肪酶活性增强,TG、HDL-C、LDL-C等水平发生明显改变[19]。但是本研究中PCOS组与对照组TC水平比较,差异无统计学意义,这可能是由于TC主要来自肝脏或食物,其与肝脏功能具有一定的关系,与患者肥胖情况的相关性较低等因素相关。
研究发现,随着内脏脂肪含量的增加,机体对胰岛素的敏感性呈明显下降趋势[20]。FINS水平的提高能够增加卵巢细胞分泌雄激素,并可减少性激素结合球蛋白的分泌,致血清中雄激素水平进一步升高,促使PCOS的发展[21]。本研究发现,PCOS患者HOMA-IR和FINS水平明显高于对照组,腹型肥胖组HOMA-IR和FINS水平明显高于非腹型肥胖组,且PCOS患者腰臀比与HOMA-IR明显相关。IR是PCOS发展过程中的关键环节,腹型肥胖患者内脏脂肪细胞体积增加,氧供、血供不足,交感神经活性下降,使脂肪组织慢性缺氧,促使炎症、脂肪等相关活性因子的释放,IR进一步加重[22]。此外,腹型肥胖患者中脂肪酸水平升高致胰岛素降解受阻,机体对胰岛素的敏感性下降,促使IR发生。由此提示,临床中可通过使用胰岛素增敏剂,以减轻机体IR,改善排卵障碍,抑制雄激素分泌等,达到治疗PCOS的目的。此外,本研究发现,PCOS患者腰臀比与LDL-C、FINS的相关性较弱(r=0.390、0.233),这可能是受样本选择差异的影响,有待选择多中心样本进一步研究。
目前关于IGF-1与PCOS、腰臀比的相关性具有较大争议。Lazurova等[23]发现肥胖PCOS女性的血清IGF-1水平与非肥胖PCOS女性没有差异,但是与代谢参数呈负相关。Schmitz等[24]研究认为,腰臀比与IGF-1的相关性随着美国人群身体活动量的改变而变化,其中对于身体活动量较低的人群,腰臀比与IGF-1呈正相关,而对于身体活动量较高的人群,IGF-1与腰臀比则无明显相关性。本研究发现,PCOS患者IGF-1水平高于对照组,腰臀比水平的提高可进一步促使PCOS患者IGF-1水平增加,且腰臀比与IGF-1具有明显的相关性。PCOS腹型肥胖患者胰岛素水平的升高,促使肝脏表达IGF-1,增强芳香化酶、黄体生成素等的活性,使卵泡膜孕激素、雄激素等水平升高,进而促使多囊卵巢的形成,参与PCOS的发生发展[25]。此外,雄激素水平的升高可促使脂肪在腹部累积,IGF-1水平升高可通过细胞色素P450等作用提高P450c17α活性,使卵巢组织分泌雄激素的功能进一步提高,进而促使腹型肥胖的发生[26]。
本研究发现,PCOS患者腰臀比对糖脂代谢异常、IR具有较好的预测价值,提示对于PCOS患者,通过运动、饮食调节等减轻腹型肥胖,在改善患者糖脂代谢、IR中可能具有较为积极的意义。但是本研究属于单中心研究,且在研究中未调整饮食、地区等混杂因素,有待后续进一步探讨药物或运动干预对不同腰臀比 PCOS患者糖脂代谢等的影响,以明确腰臀比在临床中的应用价值。
综上所述,PCOS患者尤其是腰臀比较高的患者,表现为明显的糖脂代谢紊乱、IGF-1异常增高以及IR,且腰臀比对PCOS患者糖脂代谢异常、IR均具有较好的预测价值。
