鸡沙门氏菌临床分离株的鉴定与耐药性分析
2022-08-25罗小芬郭小江张峻杰冯孝傲成虹松程振涛
罗小芬, 郭小江, 赵 超, 张峻杰, 冯孝傲, 成虹松, 程振涛,2*
(1. 贵州大学动物科学学院,贵州 贵阳 550025; 2. 贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025;3. 贵州省草地技术试验推广站,贵州 贵阳 550025)
沙门氏菌(Salmonella)属于肠杆菌科,沙门氏菌属的成员,是人和动物的常见病原菌,广泛存在于大自然中,呈全球性分布[1~4]。其致病性因血清型而异,临床症状也各异,被世界卫生组织(WHO)列为严重的食源性疾病病原[5~9]。沙门氏菌是家禽的重要病原菌,感染发病可造成重大经济损失[10]。2021年9月,六盘水市某养鸡场发生沙门氏菌感染疑似病例,本研究对该场送检病死鸡进行细菌分离鉴定及耐药性分析,为鸡沙门氏菌病的有效防控提供参考。
1 材料与方法
1.1 检测病料无菌采集该场3只(1月龄)病死鸡的肝脏、脾脏作为检测病料。
1.2 主要试剂麦康凯琼脂培养基、普通营养琼脂培养基、营养肉汤培养基、14种肠杆菌科微量生化鉴定管(均购自杭州微生物试剂有限公司)、革兰氏染色试剂盒(购自北京索莱宝科技有限公司)、2×TaqPCR Master Mix Ⅱ、DNA提取试剂盒(均购自天根生物公司)、 DL 2 000 DNA Marker(购自大连宝生物工程有限公司)、胶回收试剂盒(购自Omega公司)、10种药敏纸片(购自西京诺唯微生物科技有限公司)。
1.3 主要仪器超净工作台(购自苏州净化设备公司)、多功能梯度PCR仪(型号:VeritiTM96-Well T hermai Cycler,美国ABI公司生产)、台式高速冷冻离心机(型号:ScanSpeed 1730R,丹麦LABOGENE公司生产)、全温培养摇床(型号:QYC-2012C,购自上海新苗医疗器械制造有限公司)。
1.4 细菌分离培养取病死鸡的肝脏、脾脏病料,在超净工作台内分别接种于麦康凯琼脂培养基、普通营养琼脂培养基,37 ℃恒温箱中培养18 h。挑取生长的单个菌落接种于营养肉汤培养基中,置于摇床(170 r/min)37 ℃ 恒温箱中培养18 h,获得分离菌纯培养物。
1.5 革兰氏染色镜检挑取分离菌纯培养物于载玻片上涂抹均匀,酒精灯火焰固定,草酸铵结晶紫染色1 min,蒸馏水冲洗,加碘液覆盖涂面复染 1 min,水洗,用吸水纸吸干水分,加95%酒精数滴脱色20 s,水洗后沙黄复染,光学显微镜(油镜100×10)下观察菌体特征。
1.6 生化试验将分离菌分别接种于14种肠杆菌科生化鉴定管(硫化氢、苯丙氨酸、葡萄糖酸盐、靛基质、甲基红、枸橼酸盐、尿素、葡萄糖、赖氨酸、鸟氨酸、棉子糖、山梨醇、侧金花醇、木胶糖),37 ℃恒温箱中培养24~48 h,观察结果。根据《肠杆菌科细菌生化鉴定编码册》(第二代15e系统)对结果进行判定。
1.7 分子生物学鉴定参考GenBank数据库中沙门氏菌16S rDNA序列(登录号:EF489442),利用引物设计软件Primer 5.0设计1对特异引物(Tm值:57 ℃,预扩增片段1 550 bp)。上游引物:5’-AAAATGAGAGTTTGATCCTGGCTCA-3’;下游引物:5’-CCTTGTTACGACTTCACCCCAATC-3’。按DNA提取试剂盒说明书方法提取分离菌总DNA,构建PCR反应体系(25 μL):2×TaqPCR Master MixⅡ 12.5 μL,上、下游引物(10 pmol/μL)各1 μL,模板2 μL,ddH2O 8.5 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火1 min,72 ℃延伸90 s,共35个循环;72 ℃终延伸8 min。取PCR扩增产物10 μL电泳并胶回收目的条带测序,利用DNA Star 7.0软件对测序结果进行序列分析。
1.8 药物敏感性试验采用药敏纸片法对分离菌进行10种抗菌药物(链霉素、庆大霉素、卡那霉素、阿莫西林、强力霉素、恩诺沙星、复方新诺明、红霉素、青霉素、羧苄西林)的敏感性测定。方法:取已分离鉴定菌株接种于营养肉汤5 mL中,37 ℃培养过夜,用移液器吸取菌液滴于普通琼脂培养基中央,用灭菌L型玻璃棒涂抹均匀,室温下(25 ℃)放置3~5 min,用无菌镊子将各抗菌药物试纸片分别贴于培养基表面,各试纸片距离相等,37 ℃培养过夜。测量抑菌圈大小(重复3次,取平均值)。根据抑菌圈大小判断分离菌对各种药物的敏感程度。判定标准:抑菌圈≥20 mm为高度敏感,10~20 mm 为中度敏感,<10 mm为耐药。
2 结果
2.1 培养菌落及菌体特征从肝脏病料中共分离培养出3株菌落,在普通营养琼脂培养基上呈圆形、白色半透明、湿润光滑、边缘整齐(见图1);在麦康凯琼脂培养基上呈圆形、隆起、无色透明(见图2)。革兰氏染色镜检可见红色(革兰氏阴性)、大小均匀、两端钝圆、无荚膜、无芽孢的短杆菌(见图3)。

1号菌落 2号菌落 3号菌落图1 普通营养琼脂培养基生长菌落

1号菌落 2号菌落 3号菌落图2 麦康凯琼脂培养基生长菌落

1号菌 2号菌 3号菌图3 分离菌革兰氏染色镜检(100×10)
2.2 生化特性3株分离菌的硫化氢、甲基红、枸橼酸盐、葡萄糖、赖氨酸、鸟氨酸、山梨醇、木胶糖试验结果均为阳性,苯丙氨酸、葡萄糖酸盐、靛基质、尿素、棉子糖、侧金花醇试验均为阴性,与沙门氏菌的生化特性相符。
2.3 分子生物学鉴定结果由图4可见:3株分离菌均扩增出1 550 bp目的条带。将3株细菌的16S rDNA序列与GenBank中的沙门氏菌[FORC88(CP029029.1)、PNCS014875(CP039610.1)、大肠杆菌[4116S(MK621250.1)、7616S(MK621269.1)、2516S(MK621240.1)、3216S(MK621245.1)]、葡萄球菌[MPU99(AB353073.1)、O82(CPO38819.1)、WCUH29(CPO39156.1)、aureus 16S(KX863493.1)]、巴氏杆菌[RCAD0259(CP014157.1)、FCf15(CP038871.1)、FCf76(CP038874.1)]的16S rDNA基因进行系统进化树分析,结果3株分离菌与沙门氏菌的亲缘关系最近,与巴氏杆菌的亲缘关系最远(见图5)。最终鉴定3株分离菌均为沙门氏菌。
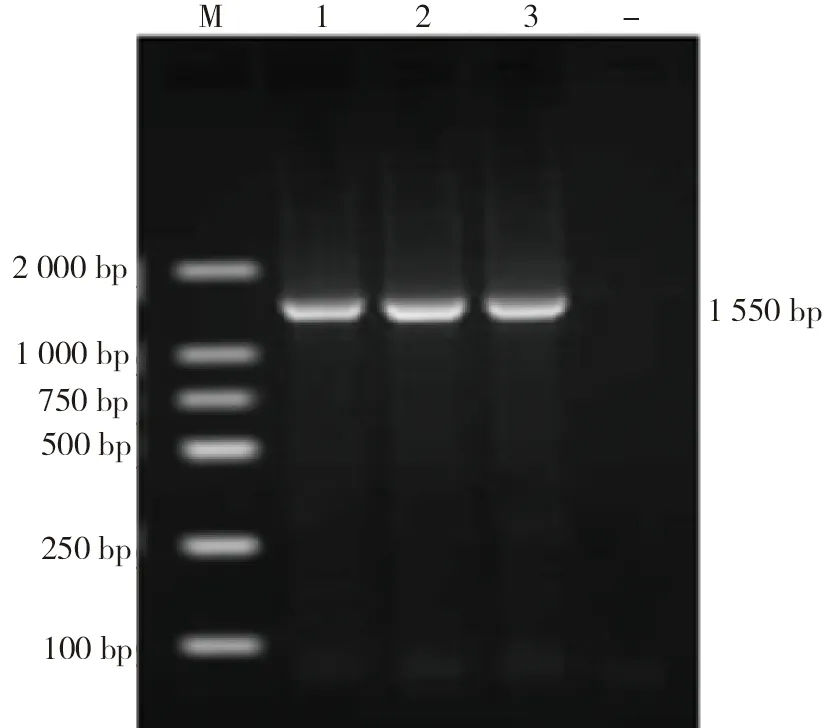
M:DL 2 000 DNA Marker; 1~3:分离菌株; -:阴性对照图4 分离菌16S rDNA PCR产物扩增结果
2.4 药敏试验结果由表1可见:3株分离菌均对阿莫西林、红霉素、青霉素耐药;对链霉素、庆大霉素、卡那霉素、强力霉素中度敏感;对恩诺沙星、复方新诺明、羧苄西林高度敏感。

●为3株分离菌图5 分离菌株系统进化树分析
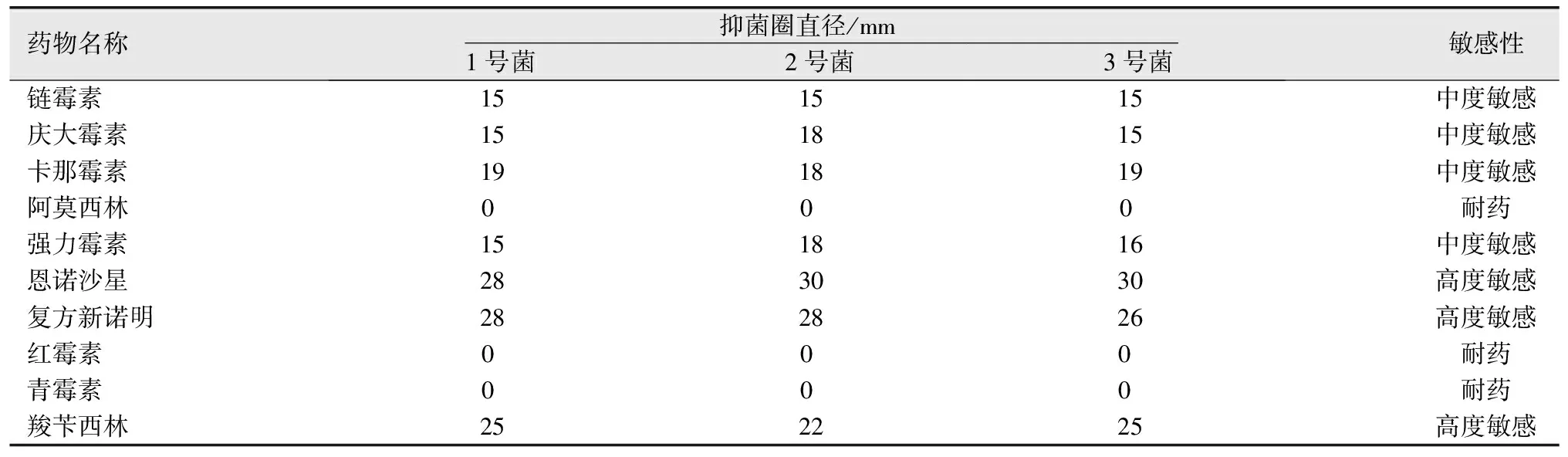
表1 3株分离菌药敏试验结果
3 结论
本试验临床分离的3株细菌经鉴定为沙门氏菌,表明鸡场存在沙门氏菌感染,可选取高度敏感药物恩诺沙星、复方新诺明、羧苄西林进行治疗。
4 讨论
4.1沙门氏菌的检测方法有细菌分离培养、分子生物学和免疫学检测等[11,12],其中《食品微生物学检验 沙门氏菌检验》(GB 4789.4—2010)是我国目前规定的标准检测方法。根据沙门氏菌的培养及生化特性,该方法包含前增菌、增菌、分离、生化试验和血清学鉴定等5个步骤[13,14]。如:宋欣媛等在昆明地区运用传统的检测方法从发病鸡的肝脏和脾脏中分离出沙门氏菌[15]。史瑞雅[16]等运用普通PCR方法从病禽的肝脏和肾脏中检测出沙门氏菌。考虑到敏感药物的筛选工作,本试验采用经典方法与分子生物学方法鉴定发病鸡场病例的沙门氏菌感染株,鉴定更为准确,并为后续防治工作奠定了基础。
4.2本试验对3株沙门氏菌的药敏试验结果与黄凯等[17]、王晓艺等[18]的研究结果相符,但与张步娴等[19]分离的鸡源沙门氏菌耐药性不尽相同,表明沙门氏菌的耐药性存在地域差异。根据此次药敏试验结果,可优先使用恩诺沙星等高度敏感药物防治该养鸡场的沙门氏菌病。
