不同提取方法对黄芪提取液活性成分及抗氧化性的影响
2022-08-24姜莉王成邢颖徐怀德
姜莉,王成,邢颖,徐怀德
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
黄芪为豆科植物蒙古黄芪或夹膜黄芪的干燥根,为我国著名的常用滋补中药材,2018年国家卫生健康委员会将黄芪纳入药食同源物质目录进行全国推广。黄芪富含多糖、三萜皂苷、黄酮等多种活性成分,具有降血糖、保护肝脏、调节免疫等多种生理活性[1-2]。研究表明,黄芪可用于改善人体免疫系统,对于心血管疾病和肾脏等疾病的治疗也有一定作用[3-5]。
目前,有关黄芪的研究主要集中在活性成分的提取及活性分析方面。天然产物提取常用的方法有超声辅助提取法、酶解提取法、亚临界水提取法等,不同提取方法原理不同,目标产物得率、结构、活性等方面也存在较大差异。为了弥补各提取技术的不足,提高提取效率,各方法联合协调使用可发挥技术优势,如亚临界水法与超声辅助提取法或酶解提取法联用、加速溶剂萃取法与超声辅助提取法联用等。胡双飞等[6]采用超声耦合亚临界水法提取螺旋藻活性多肽中发现,联合提取得到的目标产物提取得率更高,活性更好。而有关不同提取方法对黄芪中活性成分影响的研究较少,因此本文以黄芪总皂苷、总黄酮、多糖、体外抗氧化能力、美拉德反应程度及提取残渣微观结构为考察指标,对比了不同提取方法对黄芪活性成分和抗氧化性的影响。
1 材料与方法
1.1 材料与试剂
黄芪(陕西省榆林市子洲县、三年生栽培黄芪):市售。干燥的黄芪根经粉碎机粉碎,过40目筛,筛下物用自封袋包装后保存于干燥器中,备用。黄芪根切成2 mm厚的薄片用于水磨法提取。
黄芪甲苷、黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、毛蕊异黄酮、毛蕊异黄酮苷、芒柄花黄素对照品:上海源叶生物科技有限公司;纤维素酶(4 000 U/g)、甲醇、正丁醇、氨水、苯酚、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、2,4,6-三吡啶基均三嗪、维生素 C(vitamin C,VC)、福林酚试剂、九水合硝酸铝:西陇科学股份有限公司。以上试剂均为分析纯。
1.2 仪器与设备
FCFSK-0.5L高温高压反应釜:郑州予华仪器制造有限公司;SB-500DTY超声波多频清洗机:宁波新芝生物科技股份有限公司;HH-2A电热恒温水浴锅:北京科伟永兴仪器有限公司;DM-ZF-105分离式磨浆机:沧州利达民用机械厂;UV-1700紫外可见分光光度计、QP2010 Ultra气相色谱-质谱联用仪:日本岛津公司;S-4800N扫描电子显微镜:日本日立公司;LC-2010AHT高效液相色谱仪:美国Waters公司。
1.3 试验方法
1.3.1 提取方法
亚临界提取组(S):称取黄芪粉8.00 g,置于高温高压反应釜中,加入376 mL蒸馏水,密封反应釜,通入氮气,排气5 min后,于180℃条件下提取23 min,提取液过滤后,滤渣重复提取,合并两次滤液,待用。
超声辅助提取组(U):参照于海瑶等[7]的方法,略作改动。称取黄芪粉末3.00 g,加60 mL蒸馏水超声提取80 min,提取液过滤后,滤渣重复提取1次,合并两次滤液,待用。
酶解提取组(E):参照吕凤娇等[8]的方法,略作改动。称取黄芪粉末5.00 g,加入30 mL pH值为4.5的磷酸缓冲液,后加入纤维素酶0.05 g,充分振荡后,于55℃水浴2.5 h,过滤,滤渣重复提取。
水磨提取组(G):取黄芪切片10.0 g,加入60 mL蒸馏水,于40℃浸泡6h,磨浆机研磨,过滤,滤渣重复提取。
超声辅助-亚临界提取组(U-S):先利用超声提取条件进行提取,再利用亚临界提取条件下进行提取。
酶解辅助-亚临界水法提取组(E-S):先利用酶解提取条件进行提取,再利用亚临界提取条件进行提取。
水磨-亚临界提取组(G-S):先利用水磨提取条件进行提取,再利用亚临界提取条件进行提取。
1.3.2 黄芪总皂苷测定
样品溶液的制备:等量正丁醇对提取液萃取3次,合并正丁醇液,饱和氨溶液洗涤2次,再用正丁醇饱和的水溶液洗涤2次,采用旋转蒸发仪移除正丁醇,残渣用适量甲醇溶解,定容,即得黄芪总皂苷样品。
黄芪总皂苷提取得率测定:参考张劲松等[9]的测定方法,采用香草醛-高氯酸比色法测定黄芪总皂苷得率,按式(1)计算。

黄芪单体皂苷测定:黄芪总皂苷提取液经真空冷冻干燥后得到冻干粉,冻干粉用甲醇溶解后得到待测样品溶液。采用高相液相色谱法,同时参考王伟等[10]的方法,并稍作修改。色谱柱:Phenomenex C18(250 mm×4.6 mm,5 μm),流动相为乙腈-水(40∶60,体积比)。 流速为1.0 mL/min,漂移管温度95℃,进样体积10 μL。以峰面积的常用对数为纵坐标,浓度为横坐标建立标准曲线,采用外标两点法对数方程计算含量,计算方法如式(2)。

式中:C为由标准曲线对数方程得出的样品溶液中黄芪甲苷的浓度,μg/mL;V为样品的体积,mL;R为对照品的纯度,% ;W为样品的称样量,g。
1.3.3 黄芪总黄酮测定
样品溶液的制备:取提取液20 mL转移至100 mL分液漏斗,加入20 mL水饱和的正丁醇充分振摇萃取,重复3次,合并正丁醇液后,通过旋转蒸发仪蒸干溶剂,残渣用适量甲醇溶解,定容。
黄芪总黄酮测定:参考张劲松等[9]的测定方法,采用氯化铝-亚硝酸钠比色法测定黄芪总黄酮提取得率,按式(3)计算。

黄芪单体黄酮测定:黄芪黄酮提取液经真空冷冻干燥后得到冻干粉,冻干粉用甲醇溶解后得到待测样品溶液。采用高效液相色谱法参考王波等[11]的方法进行测定。 色谱柱:Agilent C-C18(250 mm×4.6 mm,5 μm),流动相为乙腈(A)、0.1% 磷酸水溶液(B),梯度洗脱,洗脱条件为:0~50 min,35% A;50 min~51 min 15% A;51 min~60 min 15% A。流速为1.0 mL/min,柱温30℃,紫外检测波长254 nm,进样体积为10 μL。采用面积外标法分别计算样品中毛蕊异黄酮、毛蕊异黄酮苷和芒柄花素的含量,按式(4)计算。
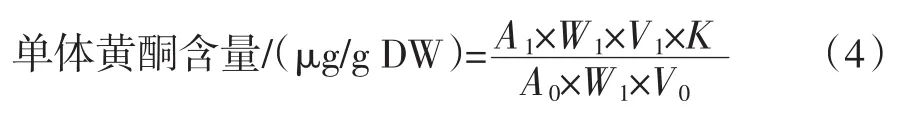
式中:A1为样品溶液中单体黄酮峰面积;A0为对照品峰面积;W1为样品称样量,g;W0为对照品称样量,μg;V1为样品的体积,mL;V0为对照品的体积,mL;K为对照品的纯度,% 。
1.3.4 黄芪多糖含量测定
样品溶液的制备:取提取液5 mL于10 mL离心管中,加无水乙醇2.7 mL,充分振荡,于4℃冷藏放置12 h后,离心,取沉淀用5 mL无水乙醇洗涤,继续离心,沉淀加蒸馏水溶解,置于25 mL容量瓶中,定容,即得待测样品。
黄芪多糖测定:参考叶迎[12]的测定方法,采用苯酚-硫酸比色法测定黄芪多糖得率,按式(5)计算。

1.3.5 黄芪提取液体外抗氧化能力测定
DPPH自由基清除力测定:参考Chang等[13]的方法,并略作改动,结果以每克干物质中VC的含量表示。
ABTS+自由基清除力测定:参考Kim等[14]的方法,并略作改动,结果以每克干物质中VC的含量表示。
铁离子还原能力测定:参考Jeong等[15]的方法,并略作改动。结果以每克干物质中VC的含量表示。
1.3.6 美拉德反应水平
参考胡云峰等[16]的方法,并略作改动。取不同提取方法得到的提取液适量,置于10 mL离心管中,向各离心管中分别加入一定量蒸馏水,使提取液黄芪原料浓度一致,在波长420 nm处测定吸光度,吸光度即为美拉德反应水平。
1.3.7 提取残渣微观结构
将提取后的黄芪残渣置于60℃烘箱中烘干,取少量干燥残渣均匀地铺于导电胶上,压平,并用离子溅射仪在样品表面蒸镀一层铂金膜。测定时将样品置于扫描电子显微镜的样品室中,设定电压5 kV,放大倍数500~5 000,观察黄芪精粉颗粒微观结构。
1.4 数据分析
数据采用SPSS 18.0进行数据处理和分析,采用Origin进行作图,每组含量以平均值±标准差形式表示。
2 结果与分析
2.1 不同提取方法对黄芪皂苷得率的影响
不同提取方法对黄芪总皂苷得率的影响如图1所示。

图1 不同提取方法对黄芪总皂苷得率的影响Fig.1 Effects of different extraction methods on the yield of total saponins of Astragalus radix
由图1可知,单一提取法中,亚临界和超声辅助提取黄芪总皂苷提取得率较高,分别为1.91% 和1.70% ,水磨提取次之,提取得率为1.36% ,酶解提取得率最低,为0.96% 。黄芪皂苷稳定性较好,亚临界提取温度可达180℃,高温高压使水分子极性变小、热运动加剧,从而提高总皂苷得率;超声辅助提取的超声波空化效应和热效应也会对黄芪细胞壁结构产生强烈破坏,促进皂苷类化合物的溶出。联合提取法中超声辅助-亚临界提取的总皂苷提取得率最高,为3.71% ,酶解辅助-亚临界和水磨-亚临界提取中得率为2.92% ,这可能与超声波的空化效应和纤维素酶对黄芪细胞壁的降解共同作用有关[17],在这些双重作用下,黄芪细胞结构被破坏地更加彻底,从而加速了黄芪皂苷类物质的溶出,提高了黄芪总皂苷的得率。
黄芪甲苷、黄芪皂苷Ⅰ和黄芪皂苷Ⅱ是黄芪中最重要的3种单体皂苷,其中黄芪甲苷作为黄芪特征性成分之一,也是黄芪质量控制的标记化合物。不同提取方法对3种黄芪单体皂苷含量的影响如表1所示。
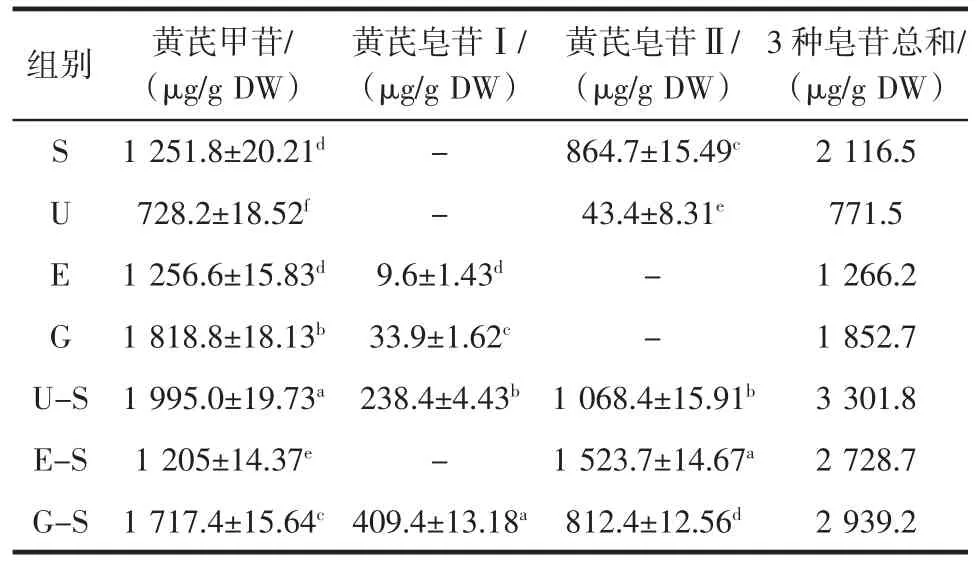
表1 不同提取方法对黄芪单体皂苷的影响Table 1 Effect of different extraction methods on monomer saponins of Astragalus radix
表1结果表明,超声辅助-亚临界提取、水磨和水磨-亚临界提取中黄芪甲苷的含量较高,水磨-亚临界提取中黄芪皂苷Ⅰ含量最高,亚临界提取、超声辅助和酶解辅助-亚临界提取中未检测出黄芪皂苷Ⅰ。酶解辅助-亚临界提取中黄芪皂苷Ⅱ含量最高,酶解辅助和水磨提取中未检测出黄芪皂苷Ⅱ。从黄芪甲苷、黄芪皂苷Ⅰ和黄芪皂苷Ⅱ3种单体皂苷的含量总和发现,联合提取法明显优于单一提取法,其中超声辅助-亚临界提取效果最好,其单体皂苷含量总和达到了3 301.8 μg/g。
有研究表明,高温、高湿以及酸碱条件均会引起中草药中单体物质的转化,这种转化会造成单体物质含量和结构的变化,黄芪中皂苷类物质在不同条件下也会由乙酰基或糖苷键的异构化而发生转化[18]。当溶液为中性时,乙酰黄芪皂苷Ⅰ会转化为黄芪皂苷Ⅰ;当溶液为碱性时,黄芪皂苷Ⅰ、黄芪皂苷Ⅱ及异黄芪皂苷Ⅰ和Ⅱ等均会转化为骨架物质-黄芪甲苷[19]。孙欢欢等[20]的研究也证明在碱性环境中,黄芪皂苷Ⅰ和Ⅱ以及部分未知化合物会向黄芪甲苷发生明显转化。本研究中黄芪皂苷从提取到测定经历了酸性、碱性和高温环境,这也导致黄芪皂苷Ⅰ和黄芪皂苷Ⅱ的转化较复杂,但各提取方法得到的黄芪甲苷含量均为最高,符合黄芪皂苷转化规律。
2.2 不同提取方法对黄芪总黄酮得率的影响
黄酮类化合物是黄芪中重要的活性物质,不同提取方法对黄芪总黄酮得率的影响如图2所示。
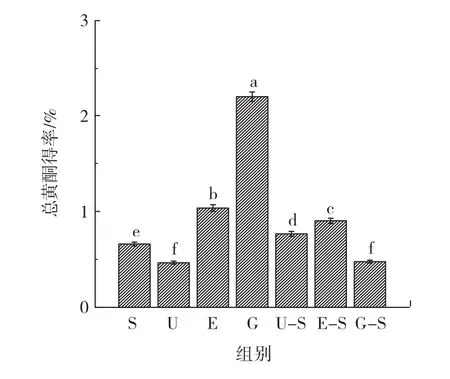
图2 不同提取方法对黄芪总黄酮得率的影响Fig.2 Effects of different extraction methods on the yield of total flavonoids of Astragalus radix
图2结果表明,水磨提取中总黄酮得率最高,为2.20% ,是其它单一和联合提取方法的2倍~4倍,原因可能是水磨提取时仅涉及到对黄芪原材料的机械破坏,在促进黄酮类物质溶出的同时,不会对其造成破坏。其他的单一提取法中,纤维素酶可以破坏植物细胞壁结构,有利于活性成分的溶出,因此酶解中总黄酮得率仅次于水磨提取法,达到了1.04% 。由于黄酮类物质稳定性较差,高温等剧烈条件下易分解,采用超声和其他提取方法联合时,总黄酮得率均较低。而且,与单一提取法相比,联合提取法在总黄酮得率方面并未呈现出明显优势。
不同提取方法对黄芪单体黄酮的影响见表2。
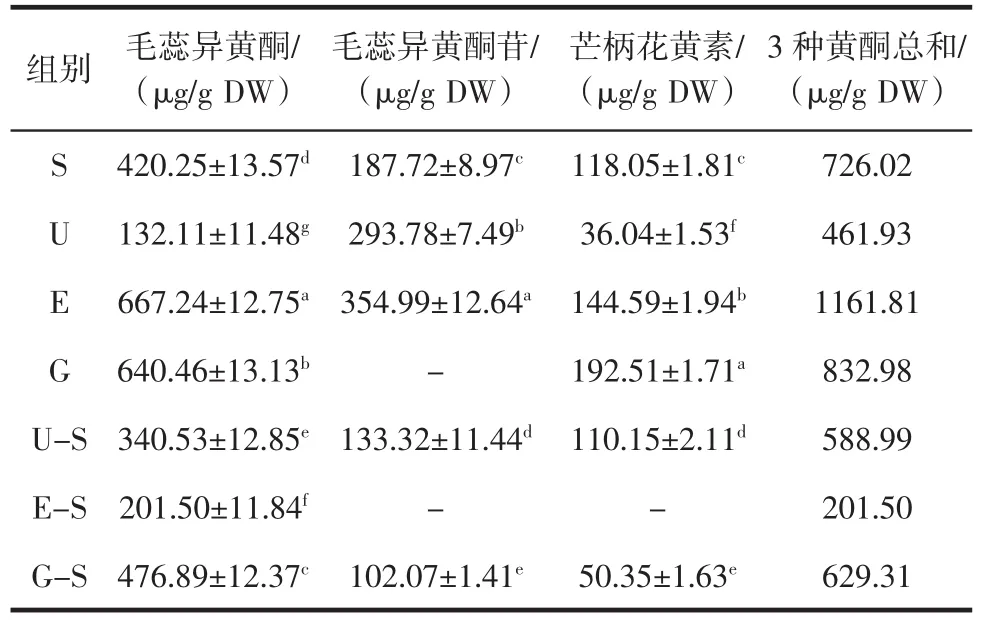
表2 不同提取方法对黄芪单体黄酮的影响Table 2 Effects of different extraction methods on monomer flavonoids of Astragalus radix
毛蕊异黄酮、毛蕊异黄酮苷和芒柄花黄素是黄芪中重要的3种单体黄酮类物质,其中毛蕊异黄酮常和黄芪甲苷共同作为黄芪的特征性成分。从表2中可以得出,采用酶解辅助和水磨提取时,毛蕊异黄酮含量较高;采用水磨提取时,芒柄花黄素含量最高,而毛蕊异黄酮苷为检测出,采用酶解辅助-亚临界提取时,未检测出毛蕊异黄酮苷和芒柄花黄素。另外,从毛蕊异黄酮、毛蕊异黄酮苷和芒柄花黄素3种单体黄酮含量总和发现,单一提取法要优于联合提取法,进一步证明了黄芪中黄酮类化合物的不稳定性。
2.3 不同提取方法对黄芪多糖得率的影响
不同提取方法对黄芪多糖得率的影响如图3所示。

图3 不同提取方法对黄芪多糖得率的影响Fig.3 Effects of different extraction methods on the yield of polysaccharide of Astragalus radix
从图3中可以得出,采用酶解提取时黄芪多糖得率最高,为6.05% 。闫巧娟[21]在纤维素酶法提取黄芪多糖的研究中也发现,纤维素酶处理后,黄芪多糖质量分数不变,但其得率会升高。超声提取中多糖得率最低,仅为1.23% ,可能是长时间的超声处理,破坏了黄芪多糖结构。联合提取法与亚临界和超声提取法相比,多糖得率也有显著提高,原因是联合提取法缩短了提取时间,避免了黄芪多糖长时间处于剧烈环境中而发生降解。岳峥嵘等[22]利用超声-微波联合提取法提取血红铆钉菇多糖发现,联合提取法可以显著提高多糖得率,但是微波辅助、超声辅助的共同作用会造成其单糖组成、形态等结构特征的变化。
2.4 黄芪残渣微观结构
黄芪原料以及经提取后黄芪残渣的微观结构如图4所示。

图4 黄芪残渣微观结构(×1 000)Fig.4 Microstructure of Astragalus radix residue(×1 000)
从图4中可以看出,黄芪原料组织结构紧密,表面附着有颗粒物,可能是蔗糖、淀粉粒等物质;经亚临界提取法提取后的残渣,组织结构破坏严重,使其组织变蓬松,增大了与溶剂的接触面积,提高了提取效率;超声辅助提取中超声波特有的空化效应和机械效应导致黄芪残渣出现了许多空腔,使溶剂更容易向细胞内渗透,且活性成分也可以迅速溶解在溶剂中[23]。酶解提取后的残渣,其纤维束表面出现明显的断裂和破碎,说明纤维素酶对黄芪细胞壁有明显的破碎作用;水磨提取残渣表面结构出现明显的撕裂状,这是机械力作用下纤维断裂造成的;而联合提取过程中黄芪被2种不同的效应共同作用,更加彻底地破坏黄芪表面纤维结构,加快活性成分溶出,提高其得率。从图4中也可以看出,联合提取后黄芪残渣表面松散、破碎程度显著增强。黎英等[24]对百香果皮果胶的提取过程中发现同样的效应,即协同处理使原料断裂、破碎更加彻底,有利于目标产物的溶出。同时结合不同方法提取黄芪活性物质可看出,黄芪活性物质的得率可能与提取后残渣形态和结构的破碎程度密切相关。
2.5 不同提取方法对黄芪提取液体外抗氧化能力的影响
不同提取方法对黄芪提取液抗氧化性影响见表3。

表3 不同提取方法对黄芪提取液抗氧化性的影响Table 3 Effect of different extract methods on antioxidant activity of Astragalus radix extract
本研究采用DPPH自由基清除能力、ABTS+自由基清除能力和铁离子还原能力测定黄芪水提物的体外抗氧化能力。从表3可以得出,不同提取方法得到的黄芪提取液DPPH、ABTS+自由基清除率和铁离子还原能力表现出相同的趋势,即亚临界提取单独或与其他方法联合使用时体外抗氧化能力较强,其中酶解-亚临界提取体外抗氧化能力最强,超声-亚临界提取与水磨-亚临界提取水法较低。
植物提取物的抗氧化性与其多糖、多酚、黄酮及皂苷等活性物质密切相关,Arumugam等[25]的研究也发现黄芪叶片甲醇提取物的抗氧化性与其总酚和木犀草素含量存在显著相关性。另外,植物提取物的抗氧化性也与其美拉德反应产物有关,樊蕊等[26]利用亚临界水萃取甘草抗氧化组分的试验中得出,甘草提取物的抗氧化性是多酚、黄酮与美拉德反应产物的共同作用。
2.6 不同提取方法对黄芪美拉德反应产物水平的影响
不同提取方法对黄芪美拉德反应水平见图5。
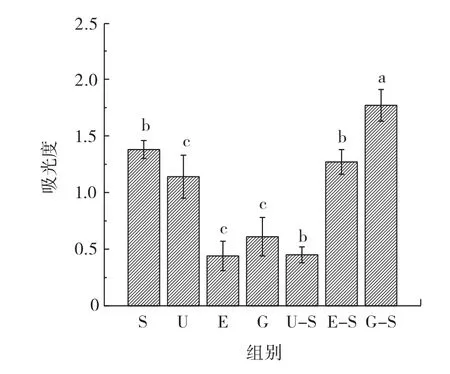
图5 不同提取方法对黄芪提取液美拉德反应水平的影响Fig.5 Effects of different extract methods on Maillard reaction of Astragalus radix extract
药用植物中活性成分的提取通常会伴随加热过程,因此美拉德反应也不可避免。美拉德反应不仅会改变药用植物的色泽、香味,延长其货架期,还会产生新的活性物质,新物质可能比多糖、黄酮、皂苷等具有更强的抗氧化活性[27]。黄芪中含有丰富的氨基酸和还原性糖类,其氨基酸种类多达25种,总氨基酸含量为8.43% ,黄芪中也存在葡萄糖、半乳糖等还原性糖类[28],这为美拉德反应的发生提供了必需的羰基和氨基化合物。从图5可以得出亚临界提取单独或与酶解提取、水磨提取联用后提取液的美拉德反应水平显著高于其他处理组。这是由于美拉德反应程度受加热强度影响较大,亚临界提取过程中,提取温度可达180℃,产生了大量美拉德反应产物。
2.7 相关性分析
黄芪提取液中活性成分与抗氧化活性的相关性分析见表4。

表4 黄芪提取液中活性成分与抗氧化性的相关性分析Table 4 Correlation analysis of active components and antioxidant activity of Astragalus radix extract
通过相关性分析发现黄芪提取液体DPPH自由基清除率与总皂苷得率呈显著正相关,与黄芪皂苷Ⅱ含量、美拉德反应水平呈极显著正相关;ABTS+自由基清除率与黄芪皂苷Ⅱ含量、美拉德反应水平呈极显著正相关;铁离子还原能力与总皂苷得率呈显著正相关,与黄芪皂苷Ⅱ含量及美拉德反应水平呈极显著正相关。综上可以得出黄芪总皂苷和黄芪皂苷Ⅱ含量以及美拉德反应水平对黄芪提取液体外抗氧化能力贡献最大。
3 结论
不同提取方法对黄芪活性成分和残渣组织结构均有显著影响,亚临界及联合提取法对黄芪中总皂苷提取效果较好,酶解辅助提取对黄芪多糖的提取效果较好,酶解辅助和水磨提取对总黄酮提取效果较好。不同提取方法对提取后黄芪残渣的组织结构均具有显著性影响,黄芪残渣的破碎程度与其活性成分的溶出效果有密切关系。不同提取方法对黄芪提取液体外抗氧化能力的影响有显著影响,亚临界及联合提取液DPPH自由基清除率、ABTS+自由基清除率和铁离子还原能力显著高于其他提取方法,由相关性分析得出提取液体外抗氧化能力与总皂苷得率呈显著正相关性,与黄芪皂苷Ⅱ含量以及美拉德反应水平呈极显著正相关性。
