sST2 联合抑郁障碍在心力衰竭患者中的预后价值
2022-08-24何航宇陈文明廖伟亮
何航宇 陈文明 廖伟亮
(化州市人民医院,广东 化州 525100)
心力衰竭(heart failure,HF)是因心肌收缩力下降引起的心泵血量降低的一种严重阶段心血管疾病临床综合征[1]。现阶段患者因心衰导致的死伤率仍十分严重。临床研究表明,HF 患者多伴有抑郁障碍,且患者的抑郁障碍越严重,将导致其生活质量降低、住院率及死亡率上升[2]。有研究表明,抑郁障碍是发生心脏病的危险因素,其影响着HF 的进程及预后。2018《中国心力衰竭诊断和治疗指南》[3]指出,生物标志物检测有利于评估HF 患者预后。在发现的新型心脏标志物中,可溶性肿瘤发生抑制蛋白2(sST2)与心室重构、心肌纤维化及心肌功能障碍密切相关,高水平的sST2 容易造成心衰患者死亡[4]。另外因抑郁症与HF 均具有免疫功能紊乱,由此提示sST2 在两者共病中具有一定的作用。因此本文旨在探讨sST2 联合抑郁障碍在HF 患者中的预后价值,为检测疾发生、发展提供参考依据。具体报道如下。
1 资料与方法
1.1 一般资料
将2020年2月至2022年2月我院诊治的132例HF 患者作为研究对象。患者按照医院抑郁自评量表(HADS-D)及汉密尔顿抑郁量表(HAMD)得分情况分为HADS-D≥8 且HAMD≥8 分观察组(抑郁障碍心力衰竭组)56例,HADS-D<8 或HAMD<8分对照组(无抑郁障碍心力衰竭组)76例。本研究已经我院伦理委员会核准,所有入组对象均签署知情同意书。
纳入标准:(1)年龄>18 岁;(2)具有典型 HF 症状者;(3)左室射血分数在 40%及以内;(4)NYHA分级为II-IV 级者且抗心衰治疗≥3 个月。
排除标准:(1)具有明显心律失常、先天性心脏病、心脏瓣膜病等疾病;(2)伴有恶性肿瘤、血液病及肝肾功能严重不全患者;(3)存在意识不清、语言交流困难者;(4)临床资料不完整。
1.2 方 法
患者入院后 48h 内均依据医院焦虑抑郁量表(HADS)、汉密尔顿焦虑量表(HAMA)汉密尔顿抑郁量表-17 项(HAMD-17)及明尼苏达HF 生活质量量表(MLHFQ)评估患者的抑郁和焦虑症状及生活质量。
采取3mL 患者入院12h 内的空腹静脉血,并于1h 内分离血清然后-80℃保存待测。采用化学发光检测sST2、BNP,试剂均由北京利德曼生化公司提供,并严格按照说明书操作进行。同时采用改良的Simpson 方法对患者左室射血分数进行检测。
对所有出院患者追踪1年,并每3 个月门诊或电话进行随访,观察并统计全因死亡或因心衰再次住院发生率。
1.3 观察指标
1.3.1 两组患者临床变量指标对比 观察并统计两组患者心衰病因、左室射血分数、肾小球滤过率、四碘甲状腺原氨酸(FT4)、促甲状腺素(TSH)、体质指数(BIM)、NYHA 分级 IV 级发生率、双心室扩大率、全心衰率、利尿剂使用率sST2、N-末端脑钠素前体(NT-proBNP)、Ghrelin 及三碘甲状腺原氨酸(FT3)MLHFQ、HAMAHADS 得分情况。
1.3.2 单因素积及多因素分析生物标志物与抑郁障碍间的关系 分析采用Pearson 相关、二元Logistic回归分析单因素积及多因素生物标志物与抑郁障碍间的关系。
1.3.3 终点事件发生追踪分析 随访1年后,观察并统计两组患者全因死亡及因心衰再入院发生率;死亡或再入院患者 NT-proBNP、sST2 及Ghrelin 水平。
1.4 统计学方法
采用SPSS26.0 对本研究的数据进行分析,计数资料用n(%)表示,采用 χ2检验;计量资料用表示,采用t检验比较,log 转换后分析 HADS、HAMA、Ghrelin、NT-proBNP 及 sST2。Pearson 相关分析和二元 Logistic 回归评估评估患者 sST2 与抑郁障碍间的关系。当P<0.05 时,差异有统计学意义。
2 结 果
2.1 两组一般资料比较
两组患者性别、年龄一般资料相比,差异无统计学意义(P>0.05)。见表 1。
表1 两组患者一般资料对比[n(%)/]
表1 两组患者一般资料对比[n(%)/]
组别例数(n) 性别年龄(岁)男女观察组对照组χ2/t 值P 值56 76 36(64.29)49(64.47)20(35.71)27(35.53)0.000 0.982 63.21±8.64 62.87±8.15 0.231 0.818
2.2 两组患者临床变量指标对比
与无抑郁障碍心力衰竭组患者相比,抑郁障碍心力衰竭组患者心衰病因、左室射血分数、肾小球滤过率、FT4 及 TSH,差异无统计学意义(P>0.05);BMI较低,NYHA 分级IV 级发生率、双心室扩大率、全心衰率及利尿剂使用率均显著较高,sST2 及NT-proBNP 水平较高,Ghrelin 及 FT3 水平较低,明尼苏达HF 生活质量量表(MLHFQ)、汉密尔顿焦虑量表(HAMA)及医院焦虑抑郁量表(HADS)得分均较高,差异有统计学意义(P<0.05)。见表2。
表2 两组患者临床变量指标对比 [n(%)/]

表2 两组患者临床变量指标对比 [n(%)/]
变量心衰病因χ2/t 值P 值缺血性心肌病扩张性心肌病瓣膜性心脏病高血压性心肌病4.558 0.207 BMI(kg/m2)NYHA 分级2.7760.006Ⅱ/ⅢⅣ4.415 0.036双心室扩大左室射血分数(%)心衰分类11.105 1.148 0.001 0.253单纯左心衰全心衰22.588 0.000利尿剂肾小球滤过率[mL/(min·1.73m2)]sST2(ng/mL)NT-proBNP(pg/mL)Ghrelin(ng/mL)FT3(pmol/L)FT4(pmol/L)TSH(uU/L)MLHFQ HAMA HADS观察组(n=56)17(30.36)26(46.43)12(21.43)1(1.79)21.9±2.8 29(51.79)27(48.21)29(51.79)31±6 18(32.14)38(67.86)53(94.64)83.6±15.2 49.25±4.71 5729.62±126.87 7.13±1.38 3.6±0.6 15.1±1.8 3.54±1.71 50.9±9.3 8.5±0.9 9.1±0.6对照组(n=76)28(36.84)35(46.05)8(10.53)5(6.85)23.6±3.9 53(69.74)23(30.26)18(23.68)30±4 56(73.68)20(26.32)55(72.37)89.1±16.3 39.17±2.03 2587.91±67.48 8.26±1.51 4.1±0.7 14.6±2.1 3.12±1.06 29.4±10.5 4.6±0.3 3.8±0.2 10.754 1.971 16.688 183.64 4.406 4.305 1.435 1.737 12.196 35.253 71.861 0.001 0.051 0.000 0.000 0.000 0.000 0.154 0.085 0.000 0.000 0.000
2.3 单因素积及多因素分析生物标志物与抑郁障碍间的关系
Pearson 相关分析表明 NT-proBNP 及 sST2 与抑郁障碍呈现正相关,Ghrelin 与抑郁障碍为负相关。多元Logistic 回归分析表明NT-proBNP 及sST2与抑郁障碍独立相关。见表3。
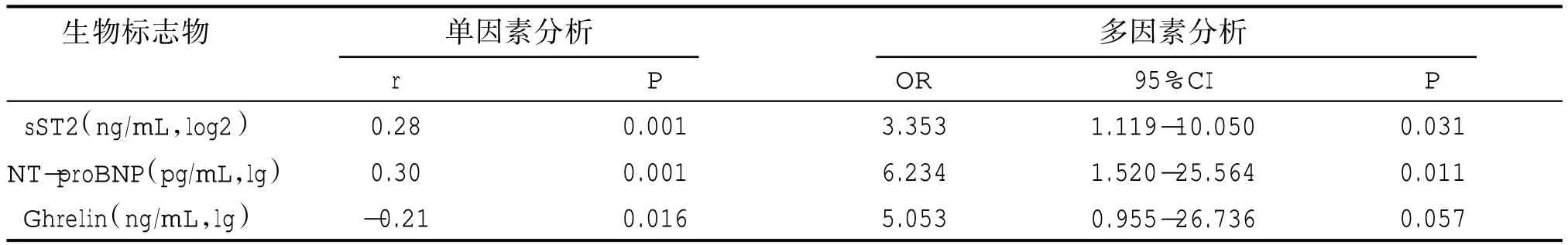
表3 单因素积及多因素分析生物标志物与抑郁障碍间的关系
2.4 终点事件发生追踪分析
随访1年后,抑郁障碍心力衰竭组全因死亡及因心衰再入院发生率均显著高于无抑郁障碍心力衰竭组,差异有统计学意义(P<0.05)。死亡或再入院患者NT-proBNP 及sST2 水平均高于无不良事件发生患者,差异有统计学意义(P<0.05);Ghrelin 无显著差异,差异无统计学意义(P>0.05)。见表 4、表5。

表4 终点事件发生追踪分析[n(%)]
表5 死亡或再入院患者与无不良事件发生患者NT-proBNP 及SST2 水平比较()

表5 死亡或再入院患者与无不良事件发生患者NT-proBNP 及SST2 水平比较()
组别死亡或再入院患者无不良事件发生患者t 值P 值例数(n)72 60 sST2(ng/mL)50.2±6.3 32.7±8.5 13.565 0.000 NT-proBNP(pg/mL)5468±137 2372±116 138.482 0.000 Ghrelin(ng/mL)6.2±0.8 6.5±1.1 1.810 0.073
3 讨 论
HF 为多原因造成的机体心脏泵血功能降低,心排血量不足,进而使全身组织基本代谢得不到满足的综合征,患者在临床上主要有活动受限、呼吸困难、体液潴留等表现[5]。目前现有的与心衰相关的重要通信传导通路尚不能明确解释心衰发生的病理生理机制。
临床研究表明抑郁障碍为HF 的一种常见并发症,其可增高患者的病死率。Ghrelin 为生长激素促泌素受体(GHS-R)的内源性配体,且两者主要分布于中枢神经系统中的海马、下丘脑等区域,该区域与情绪密切相关[6]。有研究表明,心衰患者的Ghrelin水平常低于正常人群,其可对心衰的能量代谢产生影响[7]。本研究结果亦表明观察组Ghrelin 水平低于对照组。除此之外有众多研究[8-10]表明,抑郁障碍组患者的HADS、HAMA 及 MLHFQ 评分均高于无抑郁障碍患者,与本研究结果相一致。此外本研究结果表明抑郁障碍组患者的全因死亡及心衰再入院率均高于无抑郁障碍组患者,提示抑郁障碍为影响心衰患者的重要危险因素。
ST2 属于一种白细胞介素,在机体体内的免疫及炎症反应中起重要作用,其主要有分泌型ST2(sST2)及跨膜型 ST2(ST2L)两种,IL-33 为功能性配体。一旦刺激到机体心肌细胞时,将会增加IL-33、sST2 及 ST2L 的分泌,其中 IL-33 与 ST2L 结合将会起到抗纤维化及抗心肌肥大的作用,另外sST2抢先与IL-33 结合将降低ST2L/IL-33 对心血管系统的保护作用[11]。当机体缺氧时,心肌细胞凋亡将降低IL-33,使心肌细胞收缩功能受到影响,心肌重构加重,因sST2 的存在使IL-33 与ST2L 结合受阻,进而导致心脏保护功能降低[12]。所以,sST2 水平的升高可一定程度上促进心血管疾病的发生。
蔡玉婵学者研究表明,慢性HF 患者的sST2 水平均高于心功能正常者,且HF 患者的sST2 水平升高射血分数及心功能均降低[13]。闫静学者研究结果证实,在评估HF 患者的预后中sST2 升高可作为预测其预后的不良因子;且患者sST2 升高,将增加复合心血管事件、全因死亡的发生风险[14]。另外sST2能够更好地预测射血分数减低型患者。本研究结果亦显示观察组患者的sST2 水平高于对照组;死亡或再入院患者sST2 水平均高于无不良事件发生患者。上述结论提示sST2 水平可评估心衰患者的严重程度。
综上所述,sST2 联合抑郁障碍将提高HF 患者预后预测能力,对疾病的发生、发展及预后意义重大。
