副猪嗜血杆菌血清7型菌株毒力及耐药性分析
2022-08-23王治方徐引弟朱文豪张青娴焦文强李海利王克领
王治方,徐引弟,朱文豪,张青娴,焦文强,李海利,王克领
(河南省农业科学院畜牧兽医研究所,郑州 450002)
副猪嗜血杆菌(Haemophilusparasuis,Hps)是一种革兰氏阴性、形态多变、NAD依赖型细小杆菌,可长期寄生于猪的上呼吸道中,是当前规模化猪场主要的细菌性病原之一。当机体抵抗力降低时,可感染不同年龄、品种的猪,临床上断奶前后和保育仔猪发病率、死亡率较高,主要表现为多发性纤维素性浆膜炎、关节炎等病症[1]。该病呈世界范围内流行,每年给养猪行业带来巨大的经济损失。
Hps致病机制非常复杂,临床可单独感染发病,更多是作为继发病原与猪繁殖与呼吸综合征病毒、猪圆环病毒、猪流感病毒等病原引发混合感染,加重病情和危害程度。其临床血清型较多,已鉴定出15个血清型,还有20%左右的临床菌株无法分型。Hps不同血清型的毒力及致病性存在较大差异,甚至同一血清型不同菌株的致病力也有一定差异,发病情况也不尽相同[2-3]。菌株毒力与其携带的毒力基因有密切关系。有资料表明,Hps血清1、5、10、13、14型为高毒力,2、4、15型为中等毒力,其他血清型划分为无毒力[4-6]。但最近几年,本实验室在临床典型病例中不断分离出Hps血清7型菌株,证明Hps血清7型在临床感染率越来越高。为了解河南地区Hps血清7型流行菌株的相似性、毒力和耐药性,本研究以Hps血清7型参考菌株为对照,对6株Hps血清7型临床菌株进行16S rRNA基因扩增、测序分析、毒力基因检测、致病性试验和药敏试验研究,以期为Hps血清7型的流行病学研究及临床防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 菌株 6株Hps血清7型受试菌株由本实验室临床分离鉴定并保存,菌株信息见表1。Hps血清7型参考菌株,编号0007,由华中农业大学动物医学院农业微生物国家重点实验室惠赠。
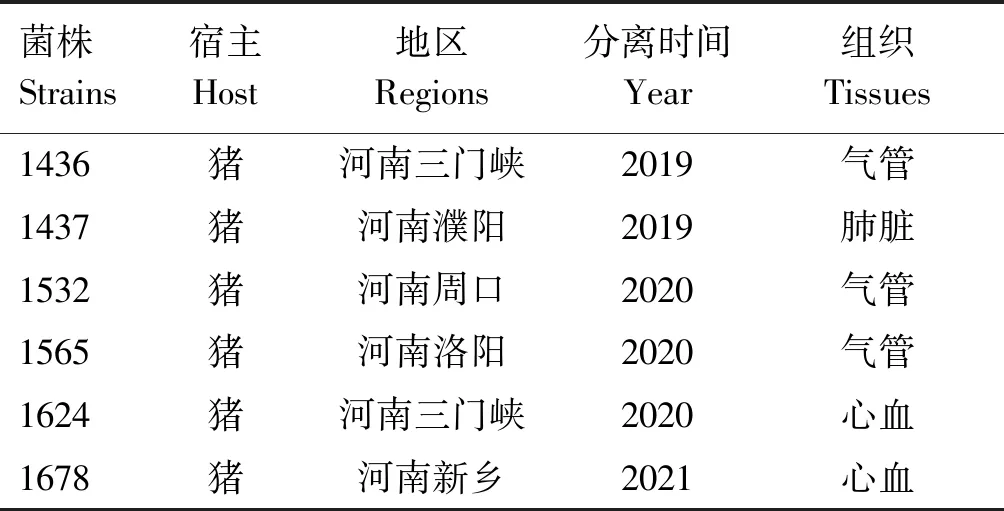
表1 菌株信息
1.1.2 主要试剂及仪器 胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(碧迪医疗器械(上海)有限公司);犊牛血清、50×TAE 浓缩液琼脂糖和DNA提取试剂盒(生工生物工程(上海)股份有限公司);烟酰胺腺嘌呤二核苷酸(辅酶Ⅰ,NAD)(Roche公司);PremixTaqTM(TaKaRaTaqTMVersion 2.0 Plus Dye)、DL2000 DNA Marker、DNA提取试剂盒(宝生物工程(大连)有限公司);药敏片(杭州滨河微生物试剂有限公司)。
Thermo 5020 PCR扩增仪、Thermo 1300SERIES A2生物安全柜(赛默飞世尔科技(中国)有限公司);电泳仪(DYY-6型) (北京市六一仪器厂);凝胶成像系统(沙船(天津)生物科技发展有限公司);5418台式高速离心机(Eppendorf公司)。
1.1.3 试验动物 7周龄体重约250 g健康雄性豚鼠40只,购自郑州大学实验动物中心。
1.2 方法
1.2.1 菌株DNA提取 将参考菌株和6株临床菌株分别接种于TSA平板(含5%的犊牛血清,0.001% NAD)上,于37 ℃、5% CO2培养箱培养36 h,挑取典型菌落,按照DNA提取试剂盒说明书分别提取菌株的DNA,分装备用。
1.2.2 菌株鉴定及序列分析 参照文献[7-10]设计合成Hps 16S rRNA基因特异性引物和Hps血清7型引物,引物信息见表2。引物均由北京擎科生物科技有限公司合成。以提取的菌株DNA为模板,对受试菌株进行PCR扩增鉴定。PCR反应体系25 μL:2×PremixTaqTM13 μL,模板DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 8 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性1 min,退火(退火温度见表2)1 min,72 ℃延伸30 s,共40个循环;72 ℃延伸10 min。反应完成后,取10 μL PCR扩增产物进行1.0%琼脂糖凝胶电泳检测,紫外成像系统观察结果、拍照。

表2 Hps 16S rRNA及血清7型引物信息
将菌株16S rRNA基因PCR扩增产物送北京擎科生物科技有限公司测序,利用DNAStar、Mega 6.0软件将菌株16S rRNA基因测序结果与GenBank数据库中获取的相近的参考菌株基因序列进行比对分析,构建系统进化树。参考菌株信息见表3。
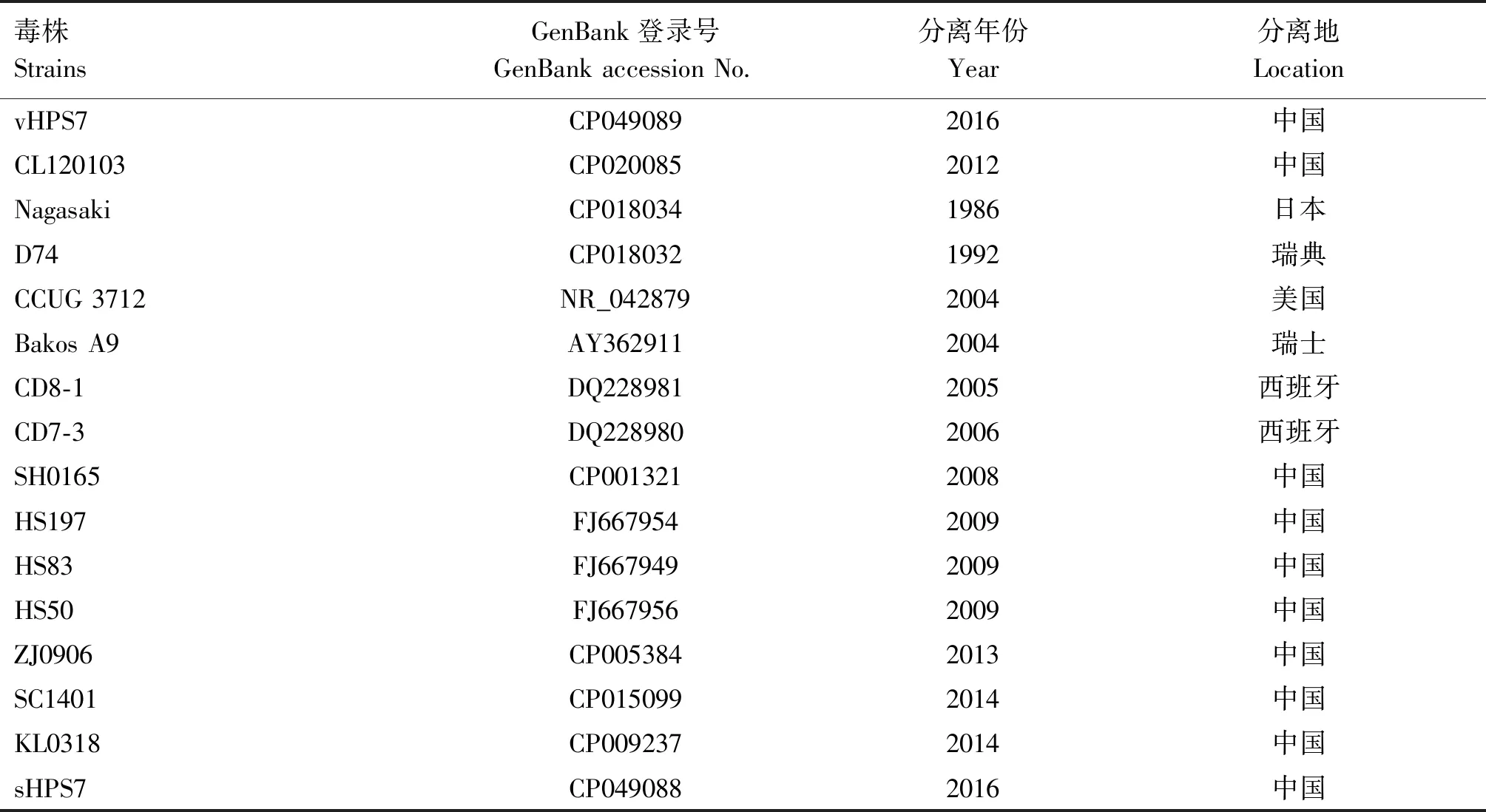
表3 参考菌株信息

续表
1.2.3 毒力基因检测 参照文献[11-13]合成副猪嗜血杆菌相关毒力基因的引物,引物信息见表4。以提取的菌株DNA为模板,进行菌株毒力基因PCR扩增检测,鉴定菌株携带毒力基因情况。PCR反应体系25 μL:2×PremixTaq13 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 2 μL,ddH2O 8 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性1 min,退火(退火温度见表4)1 min,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min。反应完成后,取10 μL PCR扩增产物进行1.0%琼脂糖凝胶电泳检测,紫外成像系统观察结果、拍照。
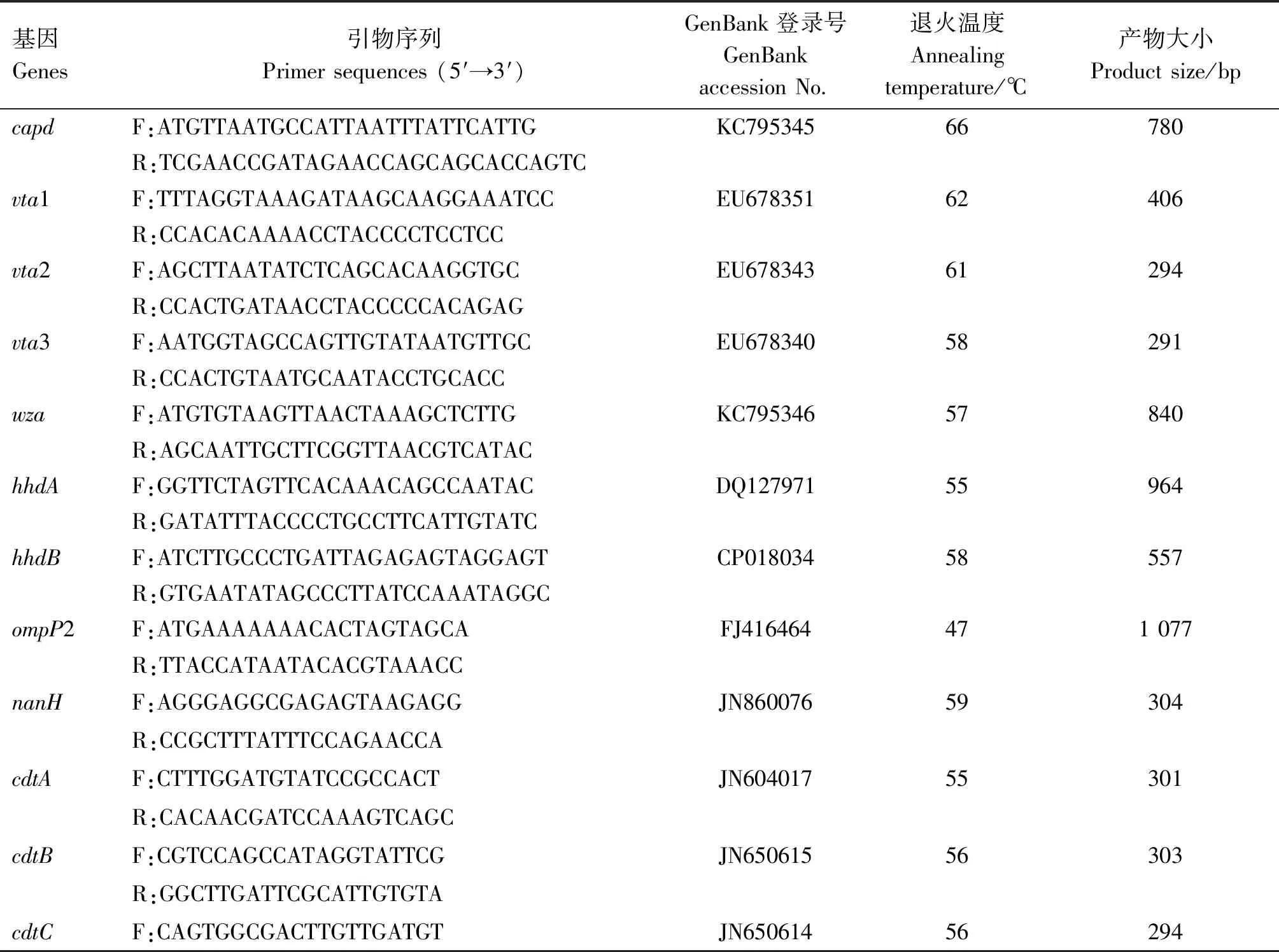
表4 毒力基因引物信息
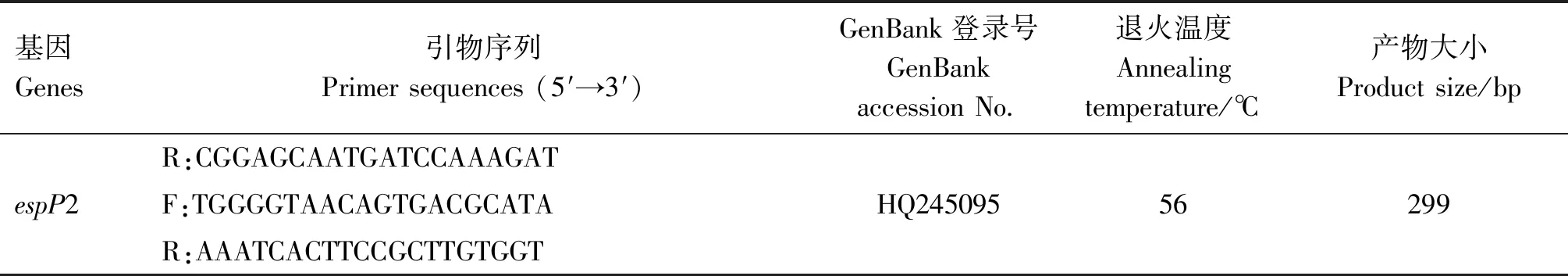
续表
1.2.4 致病性试验 将40只试验豚鼠随机分为试验组和对照组,试验组7组,对照组1组,每组5只。挑选纯化好的单个菌落接种于TSB(含5%的新生牛血清和0.001% NAD)液体培养基中,37 ℃振荡培养24 h,计数备用。调整菌液浓度至2.0×109CFU/mL,试验组豚鼠腹腔注射调整好的菌液0.5 mL/只;对照组豚鼠腹腔注射生理盐水0.5 mL/只。接种后仔细观察记录每组发病情况,连续观察10 d,对发病豚鼠进行细菌分离鉴定。
1.2.5 药敏试验 采用纸片扩散法对受试菌株和参考菌株进行药敏试验。将参考菌株和6株临床菌株分别接种于TSA平板(含5%的犊牛血清,0.001% NAD)上,于37 ℃、5% CO2培养箱培养24 h,分别挑取各菌株的典型菌落,用灭菌PBS液制成浓度为0.5麦氏单位的菌悬液,用灭菌棉签蘸取细菌悬液,均匀涂满TSA平板(含5%的新生牛血清,0.001% NAD)表面;用灭菌镊子夹取药敏纸片均匀贴于TSA平板上,置于5% CO2培养箱37 ℃培养36 h,测量抑菌圈直径大小,参照药敏片说明书进行结果判定,包括敏感、中介和耐药。
2 结 果
2.1 菌株鉴定和分型鉴定
PCR扩增结果显示,参考菌株和6株临床菌株均扩增出1 090和490 bp 2条条带,大小和Hps、Hps血清7型目的条带一致(图1),表明6株菌株均为Hps,血清型为7型。

M,DL2000 DNA Marker;1、2,菌株0007;3、4,菌株1436;5、6,菌株1437;7、8,菌株1532;9、10,菌株1565;11、12,菌株1624;13、14,菌株1678;15、16,阴性对照M,DL2000 DNA Marker;1 and 2,Strain 0007;3 and 4,Strain 1436;5 and 6,Strain 1437;7 and 8,Strain 1532;9 and 10,Strain 1565;11 and 12,Strain 1624;13 and 14,Strain 1678;15 and 16,Negative control图1 菌株血清型PCR鉴定Fig.1 Identification of serotype of strains by PCR
利用Mega 6.0软件,将受试菌株16S rRNA基因测序结果与GenBank数据库中获取的相近的基因序列进行比对分析,结果见图2。由图2可知,受试菌株与参考菌株0007核苷酸相似性在98.6%以上,与其他参考菌株核苷酸相似性在97.7%以上。菌株1436 与参考菌株0007核苷酸相似性最高,达100%;菌株1624与菌株1678核苷酸相似性最低,为97.7%。

图2 菌株16S rRNA基因核苷酸序列相似性分析Fig.2 Similarity analysis of the 16S rRNA gene nucleotide sequence of strains
由16S rRNA基因序列的系统发育树可知,菌株1624与其他菌株亲缘关系较远,单独构成一个分支;菌株1436、1437、1532、1565、1678和参考菌株0007及参考菌株在同一个大分支中,菌株1436与参考菌株0007亲缘关系最近;菌株1437、1532与参考菌株0007在一个小分支中,亲缘关系较近;菌株1565和1678亲缘关系较近,这2菌株分别与西班牙的CD7-3、CD8-1株亲缘关系近(图3)。说明,同一血清型不同菌株亲缘关系存在一定差异性。

图3 基于16S rRNA基因序列的系统发育树Fig.3 Phylogenetic tree based on 16S rRNA gene sequence
2.2 毒力基因测定结果
通过毒力基因PCR扩增,临床菌株和参考菌株检测出了vta1、vta2、vta3、wza、nanH、ompP2、cdtA、cdtB、cdtC和espP2毒力基因(图4),其中临床菌株1565和参考菌株0007毒力基因型一致,为vta1+vta2+vta3+wza+nanH+cdtA+cdtB+cdtC+espP2+;另外5株临床菌株毒力基因型一致,为vta1+vta2+vta3+wza+ompP2+nanH+cdtA+cdtB+cdtC+espP2+(表5)。
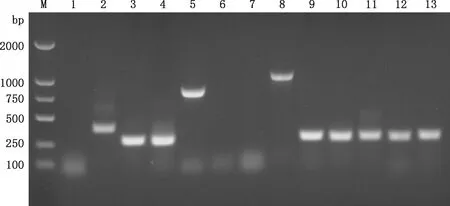
M,DL2000 DNA Marker;1~13,capd、vta1、vta2、vta3、wza、hhdA、hhdB、ompP2、nanH、cdtA、cdtB、cdtC和espP2基因M,DL2000 DNA Marker;1-13, capd,vta1,vta2,vta3,wza,hhdA,hhdB,ompP2,nanH,cdtA,cdtB,cdtC and espP2 genes,respectively图4 毒力基因PCR检测结果Fig.4 PCR results of virulence genes

表5 毒力基因检测结果
2.3 致病性试验结果
由表6可知,接种后,参考菌株0007组5只豚鼠均未表现任何临床症状,生长状态良好;1436株、1437株、1532株、1678株组均有1只出现被毛粗乱、反应迟钝、蜷缩发抖等症状,未发生死亡。1565株、1624株组有2只出现症状,未发生死亡;生理盐水对照组未出现任何症状;至试验结束后对发病豚鼠剖检,可见腹腔内有腹水、纤维素性渗出,程度不一。用心脏血液、肝脏触片,革兰氏染色镜检,均发现革兰氏阴性、长短不一的细丝状菌体。无菌采集试验组发病豚鼠的心脏血液、肝脏接种TSA平板(含5%的新生牛血清,0.001%的NAD),37 ℃培养30 h后,分离获得和接种菌株相一致的单一细菌。
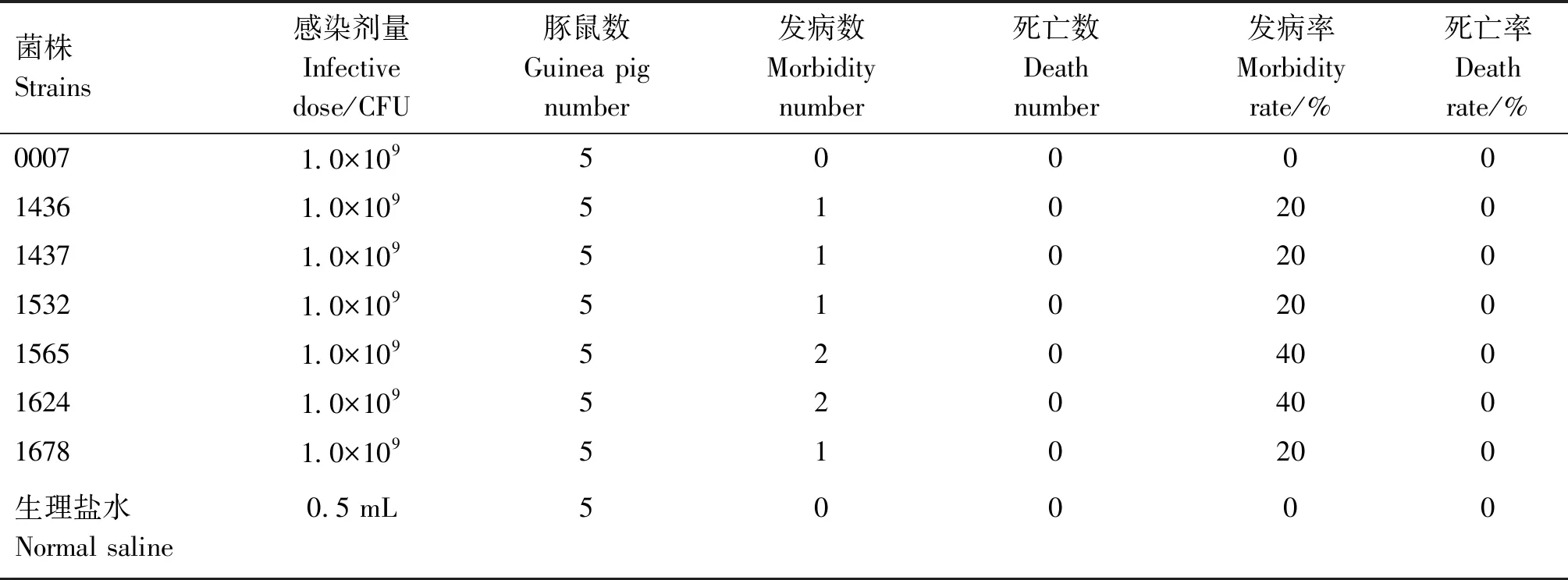
表6 致病性试验结果
2.4 药敏试验结果
选用18种常用抗菌药对参考菌株和受试菌株进行药敏试验,结果见表7。参考菌株和临床菌株表现出不同的耐药谱,均表现出多重耐药。所有菌株对头孢他啶和头孢噻呋敏感性好,只有1株临床菌株对头孢噻呋表现为中介;对强力霉素、氟苯尼考、氧氟沙星、恩诺沙星敏感性较好,分别有1~3株表现为中介或耐药;对青霉素、氨苄西林、阿莫西林、卡那霉素、红霉素、土霉素、四环素、环丙沙星、诺氟沙星敏感性差,均有3株以上菌株表现为中介或耐药;对新霉素、阿米卡星、替米考星敏感性最差,无菌株表现为敏感。
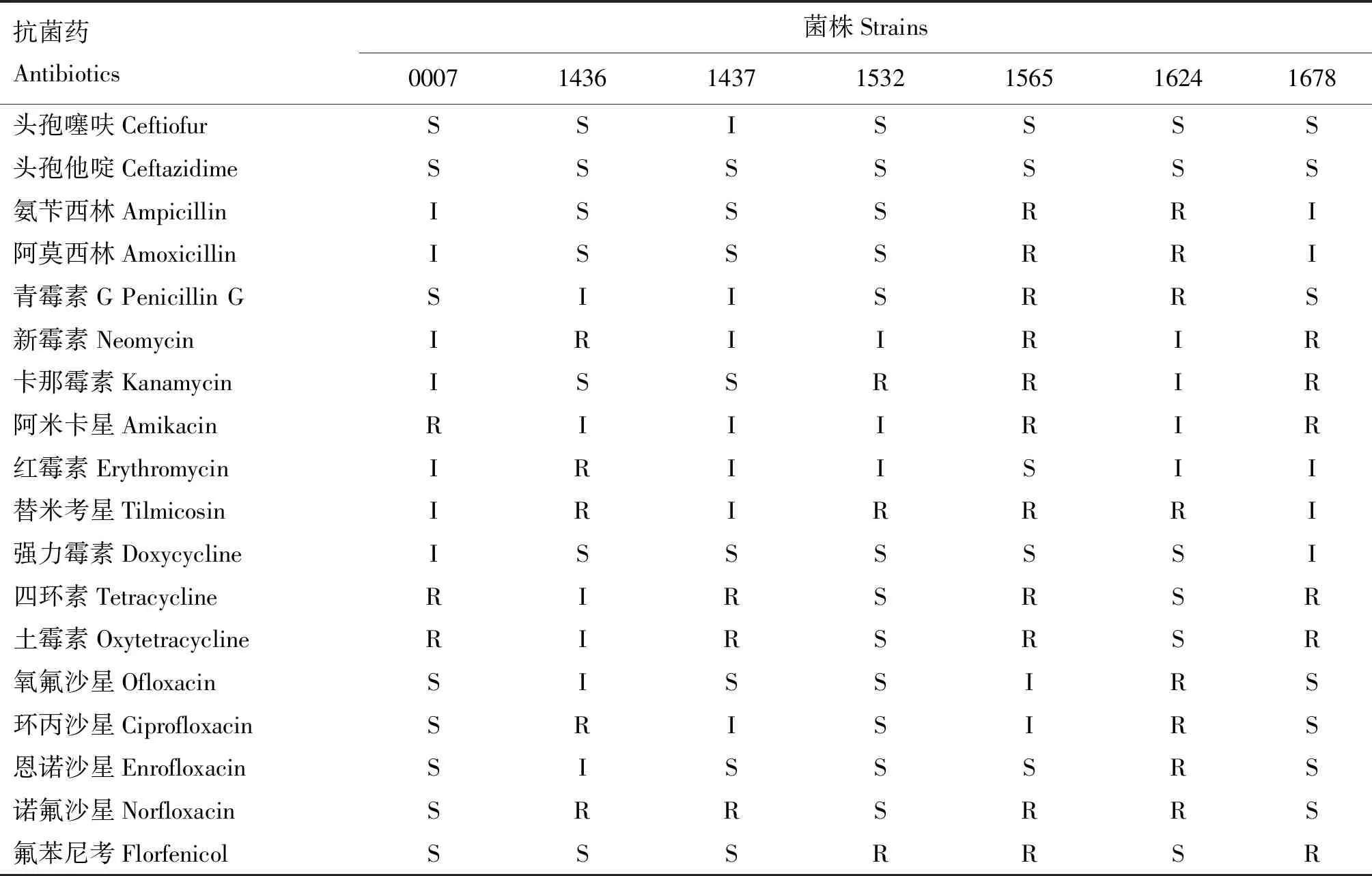
表7 药敏试验结果
3 讨 论
副猪嗜血杆菌病是养猪行业的重要细菌性病原之一,可单一病原感染发病,更多是作为继发病原感染猪群,引起混合感染,给养猪行业造成巨大经济损失[14]。Hps临床血清型较多,不同血清型菌株的毒力及致病性不同,临床感染发病情况也不尽相同。河南地区主要流行菌株为4、5、13和7型[15],4、5和13型相关报道也较多,而先前普遍认为血清7型菌株为无毒力菌株,相关报道较少。近年来,Hps血清7型在临床病例中分离率明显增多,可能与Hps血清7型菌株在临床自然进化过程中菌株毒力增强有关。本试验以Hps血清7型参考菌株为对照,对河南地区6株Hps血清7型临床菌株进行分型鉴定、相似性分析、毒力基因、药敏试验及豚鼠致病性研究,与参考菌株相比,临床菌株在毒力基因、耐药表型方面均表型出一定的差异。分析可能是临床菌株受自然环境和宿主体内某些变化影响,导致菌株在宿主体内感染过程中个别毒力基因表达出现上调或下调;同时由于国内抗生素使用不规范,同一血清型不同菌株在不同猪场受到抗生素选择压力差异较大,导致同一血清的不同菌株临床耐药表型出现一定的差异。
通过16S rRNA基因序列相似性比对及发育树构建发现,6株Hps血清7型菌株与参考菌株相似性及亲缘关系表现出有一定的差异性,其中菌株1436与参考菌株相似性达100%,亲缘关系最近;菌株1624与参考菌株的相似性为98.6%,亲缘关系相对较远。这充分说明同一血清型同一地域分离的菌株也存在一定的差异性。
Hps的致病过程包括感染黏附、侵入宿主、逃避宿主的防御机制、在宿主体内繁殖并对组织产生损伤。该过程是菌体携带所有毒力基因协同参与的复杂过程,每个或每类毒力基因功能作用尚未研究清楚。本试验筛选检测的13个毒力基因是Hps的部分致病关键因子。capd基因编码一种多糖合成蛋白,与菌体荚膜的生物学功能有关。vta1、vta2、vta3属于三聚体自转运蛋白,与病原体逃避宿主免疫系统监视密切关系[16-18]。wza是与Hps荚膜多糖输出蛋白相关的基因,在菌株荚膜多糖转运过程中起重要作用,与菌体黏附和抗吞噬方面有重要关联。神经转氨酶nanH基因与细菌的氧化耐受能力有关,在细菌感染宿主过程重要作用。hhdA、hhdB基因是溶血素修饰蛋白基因,主要参与溶血素的分泌与修饰[16-17]。cdtA、cdtB、cdtC是细胞膨胀毒素,诱导细胞膨胀、细胞核扩大并最终凋亡,是Hps菌株直接发挥细胞毒性的重要武器。ompP2是一种孔蛋白,在Hps外膜中含量最多,与细菌抗吞噬、抗补体介导的血清杀菌作用有关。胞外丝氨酸蛋白酶espP2基因属于自转运蛋白基因,与细菌的黏附、入侵和细胞毒性有关,可介导生物被膜形成和血清抗性的产生等[18]。6株Hps血清7型共检测出2种毒力基因型,其中1株临床菌株与参考菌株相同,为vta1+vta2+vta3+wza+nanH+cdtA+cdtB+cdtC+espP2+;另外5株临床菌株毒力基因型相同,为vta1+vta2+vta3+wza+ompP2+nanH+cdtA+cdtB+cdtC+espP2+。该结果与张青娴等[19]报道有一定差异。临床菌株ompP2基因表达出现明显上调,该基因主要与细菌抗吞噬、抗补体介导的血清杀菌有关,这可能与近年来Hps血清7型临床分离率增多有一定关联。6株临床菌株均分离于典型病例,说明菌株具有一定的致病性;豚鼠致病性试验也表明,6株临床菌株均可感染豚鼠发病,发病率为20%~40%,但死亡率为0。与张青娴等[20]报道Hps血清5型携带14个毒力基因,感染豚鼠发病率80%,死亡率40%比较,Hps血清7型对豚鼠有一定的致病性,但毒力明显较弱,与陶伟杰等[21]试验结果基本一致。毒力基因检测结合致病性试验,携带10种毒力基因的菌株与携带9种毒力基因的菌株相比,在致病性上没有明显差异,说明Hps的致病性不是毒力基因简单的累加,而是多个毒力基因协同参与复杂的动态结果,除本次检测的毒力基因外,可能还有其他毒力基因参与,同时细菌毒力基因在感染过程中启动表达会有一定差异,致病表型也会出现差异。毒力表型与毒力基因型有一定的相关性,但不完全一致,致病机制十分复杂,需更多试验进行深入研究。
抗生素仍是当前防控副猪嗜血杆菌病的有效途径,但由于养殖过程中抗生素长期滥用或不规范使用,导致细菌耐药性越来越严重,使得药物抗菌效果越来越差。从药敏试验结果可看出,菌株1678与参考菌株0007耐药谱相近外,其他菌株耐药谱均有一定差异。总体来说,参考菌株和临床菌株均对头孢他啶和头孢噻呋敏感性好,这与史开志等[22]报道结果较一致;而对青霉素、氨苄西林等β-内酰胺类药物敏感性差,这与陶伟杰等[21]和田昊伦等[23]结果一致,而与Miani等[24]、邓同炜等[25]报道结果不同;对氟苯尼考敏感性较好,这与田昊伦等[23]、Zhao等[26]结果一致。受试菌株对氨基糖苷类、大环内酯类敏感性最差。此外,参考菌株和临床菌株均表现出耐3种以上药物的多重耐药现象。因此,生产实践中对临床分离菌株进行及时、准确的耐药性检测,筛选敏感药物,对防治该病具有重要意义。
4 结 论
Hps血清7型临床菌株和参考菌株表现出2种毒力基因型,临床菌株较参考菌株毒力有一定的增强,可引起20%~40%豚鼠感染发病,表现一定的临床症状,但不能致死豚鼠。临床菌株和参考菌株均对头孢他啶和头孢噻呋敏感性好;对强力霉素、氟苯尼考敏感性较好;但对新霉素、阿米卡星、卡那霉素、红霉素、替米考星耐药性较强,且均表现明显的多重耐药现象。该研究为Hps血清7型流行病学、致病机制研究奠定了基础,为Hps血清7型的临床防控提供了参考依据。
