布鲁氏菌分泌蛋白BspI生物信息学分析及多克隆抗体制备
2022-08-23肖洋洋马忠臣李芮芮陈创夫王鹏雁
肖洋洋,马忠臣,李芮芮,陈创夫,郑 炜,王 勇,王鹏雁
(1.石河子大学动物科技学院,石河子 832003;2.绵羊健康养殖与人兽共患病防控协同创新中心,石河子 832003;3.动物疾病防控兵团重点实验室,石河子 832003)
布鲁氏菌病是由布鲁氏菌感染引起的人畜共患传染性疾病[1]。感染该病后,母畜主要表现为妊娠期流产,早中期最为多见,产死胎、木乃伊胎,还伴有母畜的坏死性胎盘炎、子宫内膜炎等;公畜主要表现为关节肿胀、疼痛,睾丸炎,不育;人则主要发生周期性发热、乏力、多汗、关节炎,孕妇则可发生流产[2]。据调查,近年来该病在中国的发病率逐年上升[3-4]。由于还没有研制出防治布鲁氏菌病的理想疫苗,该病仍对全球的养殖业发展带来挑战[5]。
布鲁氏菌是典型的胞内寄生菌,感染宿主之后,被吞噬细胞吞噬或侵入非吞噬细胞,会隐藏在膜结合室(该膜结合室被称为布氏小体,BCV)中[6-7]。在初期,BCV利用胞吞途径及分泌途径来维持布鲁氏菌的胞内存活;在中期的成熟阶段,BCV将抑制布鲁氏菌与溶酶体的结合,逃避宿主的免疫杀伤作用;在后期,BCV与分泌途径相互作用从而与内质网融合,其还会与内吞途径相互作用触发自噬,满足布鲁氏菌长期在细胞内生长与增殖的条件[8-9]。研究证实,布鲁氏菌在内质网中的增殖过程中可以使细胞内质网结构重组,诱导内质网应激(endoplasmic reticulum stress,ERS),激活未折叠蛋白反应(unfolded protein reaction,UPR),从而促进布鲁氏菌的胞内寄生[10-11]。免疫球蛋白结合蛋白(immunoglobulin-binding protein,Bip/GRP78)是内质网应激的标志分子,ERS发生时,Bip的表达量增加,可以激活UPR[12]。
BspI是一个新的效应蛋白,由布鲁氏菌1号染色体BAB1-1865基因编码,有GTPase活化域(98-220位氨基酸)、信号肽域(1-17位氨基酸)和转膜域(17-33位氨基酸)3个特殊的结构域[13]。GTPase活化域理论上能够调节内质网小G蛋白的活性,影响内质网的组装[14]。研究表明,BspI蛋白可以上调小鼠单核巨噬细胞(RAW264.7)Bip的表达,并可以诱导白介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的分泌增多,剪切型X盒结合蛋白1(spliced X-box binding protein 1,XBP-1S)表达量增加,表明BspI蛋白可以作用于RAW264.7细胞,诱导RAW264.7中的ERS,并激活ERS中的UPR[15],在布鲁氏菌的胞内寄生中发挥了重要的作用。BspI作为分泌蛋白,其分泌途径尚不清楚,因此,本研究通过原核表达系统表达出布鲁氏菌分泌蛋白BspI,免疫试验兔后制备兔抗BspI多克隆抗体,以期为后续进行该蛋白的亚细胞定位及潜在功能研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株、载体和试验动物 大肠杆菌DH5α和BL21(DE3)感受态细胞,灭活羊种16M布鲁氏菌菌株均由新疆疾病预防控制中心提供;pMD19-T克隆载体、pET-28a表达载体均购自TaKaRa公司;2只2月龄雄性新西兰大白兔(约1.5 kg)购自新疆医科大学实验动物中心。
1.1.2 主要试剂 细菌质粒小提中量试剂盒、氨苄青霉素、卡那霉素、DAB显色液均自天根生化科技(北京)有限公司;诱导剂IPTG购自Merck公司;T4 DNA连接酶、2×EsTaqMasterMix、DNA快速琼脂糖凝胶回收试剂盒、限制性内切酶BamH Ⅰ和XhoⅠ均购自TaKaRa公司;绵羊抗兔IgG、脱脂奶粉、PVDF膜均购自北京索莱宝科技有限公司;BCA试剂盒购自Thermo公司。
1.2 方法
1.2.1 BspI蛋白的生物信息学分析 利用TMHMM Server v.2.0在线软件(http:∥www.cbs.dtu.dk/services/TMHMM/)预测BspI蛋白的跨膜区;利用ProtScale在线软件(https:∥web.expasy.org/protscale/)预测BspI蛋白的亲/疏水性;利用件SignalP 5.0 Server在线软件(http:∥www.cbs.dtu.dk/services/SignalP/)预测BspI蛋白的信号肽;利用NetPhos 3.1 Server在线软件(http:∥www.cbs.dtu.dk/services/NetPhos/)预测BspI蛋白的磷酸化位点;利用Predicting Anti-genic Peptides在线软件(http:∥imed.med.ucm.es/Tools/antigenic.pl)预测BspI蛋白的抗原决定簇;利用SOPMA在线软件(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa%20_sopma.html)预测BspI蛋白的二级结构;利用SWISS-MODEL在线软件(http:∥swiss-model.expasy.org/)对BspI蛋白的三级结构自动建立空间模型。
1.2.2 引物设计与PCR扩增 根据布鲁氏菌菌株16MBspI基因序列(GenBank登录号:DK63_1233,675 bp),利用Primer Premier 5.0软件设计引物BspI-F/R,BspI-F:5′-GGATCCATGCTTGGCG-
TTCTCGTGGC-3′(下划线为BamH Ⅰ酶切位点);BspI-R:5′-CTCGAGCTATTGCATGTCGCGG-
ATGC-3′(下划线为XhoⅠ酶切位点)。引物由生工生物工程(上海)股份有限公司合成。
以灭活羊种布鲁氏菌菌株16M菌液为模板,进行目的基因BspI的PCR扩增。PCR反应体系25 μL:2×EsTaqMasterMix 12.5 μL,上、下游引物各0.4 μL,模板2.0 μL,ddH2O 9.7 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性40 s,60 ℃退火30 s,72 ℃延伸70 s,共30个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物进行琼脂糖凝胶电泳分析,并对鉴定正确的产物进行切胶回收。
1.2.3 pMD19-T-BspI克隆载体的构建与鉴定 回收纯化的BspI基因与pMDl9-T克隆载体连接,16 ℃水浴过夜,转化大肠杆菌DH5α感受态细胞,涂含氨苄抗性的固体LB培养基过夜培养,挑菌活化进行菌液PCR鉴定并送昆泰锐生物技术有限公司(武汉)测序,连接成功后的产物命名为pMD19-T-BspI。
1.2.4 pET-28a-BspI重组表达载体的构建 将pMD19-T-BspI和pET-28a载体摇菌提取质粒,同时用BamH Ⅰ和XhoⅠ双酶切,回收pET-28a载体及目的片段。pET-28a载体与目的片段用T4 DNA连接酶连接,转化大肠杆菌BL21(DE3)感受态细胞,涂含卡那抗性的固体LB培养基过夜培养,挑菌活化进行菌液PCR并送昆泰锐生物技术有限公司(武汉)测序,连接成功后的产物命名为pET-28a-BspI。
1.2.5 BspI的诱导表达及纯化 将重组质粒转化大肠杆菌BL21(DE3)感受态细胞,活化后接种于含卡那抗性的LB液体培养基中,摇菌至D600 nm值为0.7。加入诱导剂1 mmol/L IPTG,分别于0、2、4、6及8 h取出对应的菌液,12 000 r/min离心1 min,加入80 μL蒸馏水和20 μL蛋白上样液混匀,100 ℃沸水浴10 min,进行12% SDS-PAGE分析。
将菌液扩大培养600~800 mL,摇菌至D600 nm值为0.7,加入诱导剂1 mmol/L IPTG,诱导至最佳时间收菌,置于液氮中反复冻融3次,超声破碎离心,取上清和沉淀进行SDS-PAGE分析。利用His标签蛋白纯化柱进行表达蛋白的纯化,纯化后的蛋白进行SDS-PAGE分析,并使用BCA试剂盒测定浓度,-80 ℃保存备用。
1.2.6 BspI多克隆抗体的制备 将纯化后的蛋白混合弗氏佐剂免疫试验兔,免疫前耳动脉采血1~2 mL做阴性对照,首免按每800 μg/只混合等体积弗氏完全佐剂,乳化后皮下5点注射;间隔3周,耳动脉采血1~2 mL后进行二免,800 μg蛋白混合等体积弗氏不完全佐剂,乳化后皮下5点注射;间隔3周,耳动脉采血1~2 mL用作Western blotting及ELISA检测,同时三免,500 μg蛋白混合等体积弗氏不完全佐剂,乳化后皮下5点注射;间隔2周四免,500 μg蛋白混合弗氏不完全佐剂,乳化后皮下5点注射;间隔1周,耳中动脉采血1~2 mL用于Western blotting及ELISA检测,3 d后颈动脉采血50 mL。
1.2.7 多克隆抗体的鉴定 取纯化后的BspI蛋白进行SDS-PAGE分析,切下目的胶块将蛋白转到PVDF膜上,5%脱脂奶粉4 ℃封闭过夜,以制备的兔抗BspI蛋白多克隆抗体(稀释比1∶100)为一抗,37 ℃孵育2 h;山羊抗兔IgG-HRP(稀释比1∶3 500)为二抗,37 ℃孵育2 h,用DAB显色液显色,拍照留存。
1.2.8 多克隆抗体效价的间接ELISA检测 取纯化后的BspI蛋白稀释为1.5、2、2.5 μg/mL包被酶标板,4 ℃过夜;以制备的多克隆抗体为一抗,稀释为1∶200、1∶250、1∶300和1∶350,37 ℃避光孵育1 h;以山羊抗兔IgG-HRP为二抗,稀释度为1∶10 000、1∶20 000、1∶30 000和1∶40 000,37 ℃避光孵育30 min,同时设置阴性对照,TMB显色15 min,用酶标仪测定D450 nm值。
2 结 果
2.1 BspI蛋白的生物信息学分析
2.1.1 跨膜区、亲/疏水性和信号肽预测 BspI蛋白分子式为C1151H1835N339O292S6,编码220个氨基酸,根据TMHMM Server v.2.0在线软件分析,BspI蛋白有1个跨膜结构(图1)。利用ProtScale在线软件预测发现,BspI蛋白亲水性平均系数为0.789,为亲水性蛋白(图2)。利用SignalP 5.0 Server在线软件预测显示,BspI蛋白无信号肽(图3)。
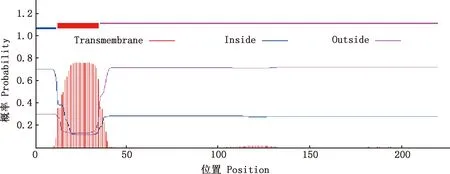
图1 BspI蛋白跨膜结构预测Fig.1 Transmembrane structure prediction of BspI protein

图2 BspI蛋白亲/疏水性预测Fig.2 Hydrophilicity and hydrophobicity prediction of BspI protein

图3 BspI蛋白信号肽预测Fig.3 Signal peptide prediction of BspI protein
2.1.2 磷酸化位点预测 运用NetPhos 3.1 Server在线软件预测BspI蛋白的磷酸化位点,高于阈值0.5的为潜在磷酸化位点,经分析发现,该蛋白在第1、42、49、76、111、127、208位丝氨酸处,第52、78、91、112、206位苏氨酸处,以及第68位酪氨酸处发生了磷酸化(图4)。
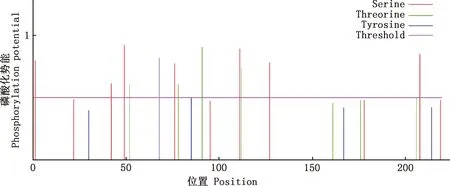
图4 BspI蛋白磷酸化位点预测Fig.4 Phosphorylation site prediction of BspI protein
2.1.3 抗原决定簇预测 通过在线软件Predicting Anti-genic Peptides进行预测,该蛋白有7个抗原决定簇,分别在7-49、79-89、98-111、113-142、165-171、175-183、205-216位氨基酸处(表1)。

表1 BspI蛋白抗原决定簇预测
2.1.4 二级结构和三级结构预测 根据SOPMA在线软件分析,BspI蛋白二级结构中α-螺旋、延伸链、β-转角、无规则卷曲占比分别为30.45%、29.55%、10.45%和29.55%(图5)。根据SWISS-MODEL在线软件对BspI蛋白的三级结构自动建立空间模型,显示以α-螺旋为主(图6),与二级结构预测结果一致。

线条从长到短依次为α-螺旋、延伸链、β-转角和无规则卷曲The order of lines from long to short are alpha helix,extended chain,beta turn and random coil图5 BspI蛋白二级结构预测Fig.5 Secondary structure prediction of BspI protein

图6 BspI蛋白三级结构预测Fig.6 Tertiary structure prediction of BspI protein
2.2 BspI蛋白多克隆抗体制备
2.2.1BspI基因PCR扩增 以布鲁氏杆菌菌株16M为模板,以特异性引物BspI-F/R进行PCR扩增,结果显示BspI基因片段大小为675 bp(图7),与预期相符。

M,DL2000 DNA Marker;1,阴性对照;2~4,BspI基因PCR扩增产物M,DL2000 DNA Marker;1,Negative control;2-4,PCR amplification products of BspI gene图7 BspI基因PCR扩增结果Fig.7 PCR amplification results of BspI gene
2.2.2 重组克隆质粒pMD19-T-BspI的菌液PCR鉴定 用琼脂糖凝胶回收试剂盒回收扩增产物后,将其连接到pMD19-T克隆载体上,经菌液PCR鉴定发现,条带大小为675 bp(图8),与预期相符。测序比对表明重组质粒pMD19-T-BspI构建成功。
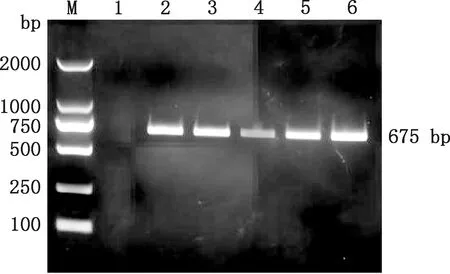
M,DL2000 DNA Marker;1,阴性对照;2~6,pMD19-T-BspI的菌液PCR产物M,DL2000 DNA Marker;1,Negative control;2-6,PCR products of bacterial solution of pMD19-T-BspI图8 pMD19-T-BspI菌液PCR验证Fig.8 PCR results of pMD19-T-BspI bacterial solution
2.2.3 重组表达质粒pET-28a-BspI的菌液PCR鉴定 重组质粒pMD19-T-BspI和载体pET-28a分别被BamH Ⅰ和XhoⅠ双酶切后连接,转化大肠杆菌BL21(DE3)感受态细胞,经菌液PCR鉴定发现,条带大小为675 bp(图9),与预期相符。表明BspI基因已成功插入pET-28a表达载体中。

M,DL2000 DNA Marker;1,阴性对照;2、3,pET-28a-BspI的PCR产物M,DL2000 DNA Marker;1,Negative control;2 and 3,PCR products of pET-28a-BspI图9 pET-28a-BspI菌液PCR验证Fig.9 PCR results of pET-28a-BspI bacterial solution
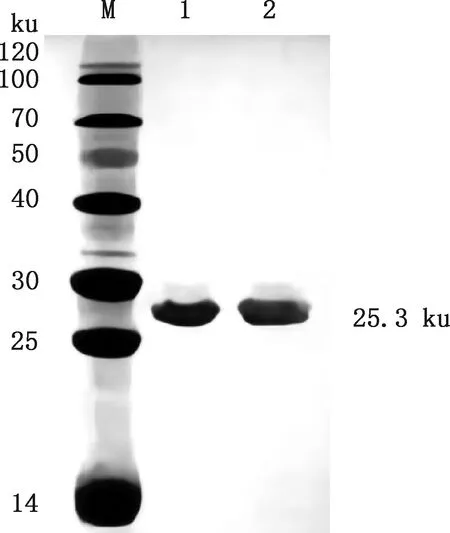
2.2.4 BspI蛋白的诱导表达及纯化 分别取未诱导及诱导2、4、6、8 h的菌液及菌液超声后的上清和沉淀进行SDS-PAGE分析,结果显示,BspI蛋白(25.3 ku)会形成包涵体,在上清中不表达,37 ℃诱导8 h左右蛋白的表达量最高(图10);经His标签镍柱纯化后进行SDS-PAGE分析,结果显示,在约25.3 ku处出现单一的条带(图11),表明BspI蛋白纯化成功,且浓度为1.5 mg/mL。

M,蛋白质分子质量标准;1,空菌对照;2~5,表达菌诱导2、4、6、8 h;6,超声后的上清液;7,超声后的沉淀M,Protein Marker;1,Control of empty bacteria;2-5,The expression bacteria were induced for 2,4,6 and 8 h,respectively;6,Supernatant after ultrasound;7,Precipitate after ultrasound图10 BspI蛋白诱导表达后的SDS-PAGE分析Fig.10 SDS-PAGE analysis of induced expression of BspI protein
2.2.5 BspI多克隆抗体的Western blotting鉴定 将纯化后的BspI蛋白转到0.45 μm的PVDF膜,以免疫后的兔血清为一抗、山羊抗兔IgG-HRP为二抗孵育,用DAB显色液显色,在25.3 ku左右出现了一条特异性、较粗的条带(图12),表明兔血清里面含有抗BspI蛋白的抗体,可以与纯化后的蛋白发生特异性结合,因蛋白浓度较高,所以条带较粗。Western blotting结果表明,BspI免疫兔后,兔体内产生了针对BspI蛋白的抗体,因此利用采集的血清作为一抗时,血清内抗体可以与BspI蛋白进行特异性结合,表明多克隆抗体制备成功。
M,蛋白质分子质量标准;1、2,经His标签镍柱纯化、浓缩后的蛋白M,Protein Marker;1 and 2,The protein was purified and concentrated over the His tagged nickel column图11 BspI蛋白纯化结果Fig.11 Purification results of BspI protein

1、2,BspI蛋白的DAB显色;M,蛋白质分子质量标准1 and 2,DAB color rendering of BspI protein;M,Protein Marker图12 BspI多克隆抗体的Western blotting鉴定Fig.12 Western blotting identification of BspI polyclonal antibody
2.2.6 BspI多克隆抗体的间接ELISA抗体效价分析 首先通过方阵滴定法确定蛋白的最佳包被浓度,三免后收集血清,以免疫前的兔血清作阴性对照,得到蛋白的最佳包被浓度为1.5 μg/mL,在BspI蛋白的最佳包被浓度为1.5 μg/mL、一抗稀释度为1∶350、二抗稀释度为1∶40 000时,P/N值最大为8.696(表2)。通过倍比稀释对BspI蛋白的抗体效价进行分析发现,在一抗稀释度为1∶12 800时,血清中的抗体与BspI蛋白的结合度达到最高;在一抗稀释度为1∶409 600时,P/N值开始<2,表明制备的抗体可以很好地与BspI蛋白结合,抗体效价为1∶409 600(图13)。

表2 方阵滴定结果(P/N)
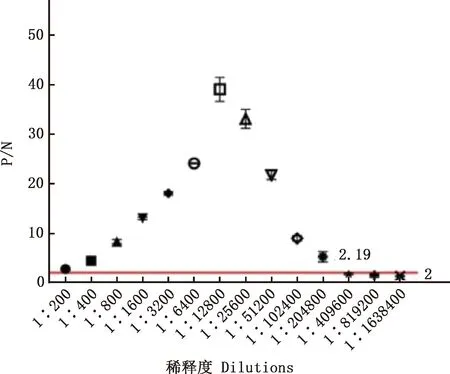
图13 兔抗BspI蛋白多克隆抗体效价测定Fig.13 Titer determination of rabbit polyclonal antibody against BspI protein
3 讨 论
布鲁氏菌是胞内寄生菌,侵入机体后分布于各个组织器官,胎衣、胎儿、胎盘以及乳腺、网状内皮系统、淋巴结最有利于其增殖[16]。研究发现,布鲁氏菌的胞内寄生机制与Ⅳ型分泌系统(T4SS)有密切的联系[17]。T4SS的表达是布鲁氏菌在宿主细胞内发挥毒力的一个重要标志[18-19]。布鲁氏菌的效应蛋白分泌有两种:依赖T4SS和非依赖T4SS[20]。目前,对依赖T4SS的蛋白研究已经很成熟,依赖型效应蛋白在布鲁氏菌感染宿主及诱发ERS反应中发挥着调节作用,而非依赖型效应蛋白的研究较少[21]。BspI蛋白是非依赖T4SS的分泌蛋白,能参与布鲁氏菌胞内感染引起宿主细胞的ERS[22]。本实验室前期对布鲁氏菌分泌蛋白BspG和BspJ的研究发现,这2个蛋白都可以进入宿主细胞的细胞核,能够在细胞核到细胞质间穿梭,而BspI具有和这2个蛋白相似的分泌方式,因此推测BspI也可能会进入宿主细胞的细胞核,影响宿主细胞的转录和基因的表达,进而影响宿主细胞的生存与繁殖,使布鲁氏菌能在胞内长期生存。然而该推测还需要对BspI进行更进一步的分析及验证。
本研究利用在线软件分别对BspI蛋白的跨膜结构、亲/疏水性、信号肽、磷酸化位点、抗原决定簇进行了分析,结果显示,BspI蛋白编码220个氨基酸,有1个跨膜结构域,不含信号肽,有13个磷酸化位点和7个抗原决定簇,是一个不稳定的亲水性蛋白。该蛋白被预测为跨膜的亲水蛋白,但不含信号肽,表明该蛋白可能定位于细胞膜上,而Myeni等[23]通过CyaA报告子融合试验发现,当在C-端融合报告子时,BspI的分泌是依赖VirB T4SS的;当标记在N-端时,BspI的分泌不依赖于VirB T4SS。在布鲁氏菌的效应蛋白中,BspD、BspH、BspJ都与BspI分泌方式相似[24]。表明布鲁氏菌中可能存在另一种未发现的分泌系统,而BspI蛋白可能是通过T4SS和这种分泌系统混合分泌到宿主细胞。同时,有研究显示,费氏弧菌可以通过鞭毛调控外膜蛋白的分泌来影响细菌对宿主细胞的毒力[25],而布鲁氏菌和费氏弧菌都是单极鞘鞭毛[26],推测布鲁氏菌的鞭毛能够和T4SS共同调控一些效应蛋白的分泌,但仍有待进一步研究。对BspI蛋白的二级结构预测发现,该蛋白主要由α-螺旋、β-转角、延伸链和无规则卷曲组成,α-螺旋占比最大(30.45%)。生物信息学分析还发现,BspI蛋白具有7个抗原决定簇,表明该蛋白作为抗原可以引起宿主良好的免疫反应。
本研究还通过大肠杆菌原核表达系统对BspI蛋白进行表达,免疫试验兔制备了多克隆抗体。在表达及纯化试验中发现BspI蛋白在上清中基本没有表达,在沉淀中形成包涵体,包涵体蛋白的纯化过程非常繁琐,且在复性过程中BspI蛋白极易变性析出,这与生物信息学分析时得出的该蛋白不稳定性较高的结果一致。因此在试验过程中尝试在蛋白中加入10%甘油,增加溶液的黏性,减少蛋白质之间的相互碰撞而沉淀,发现可以明显减少蛋白的析出变性。使用纯化后的蛋白免疫兔后,在2周左右即可通过Western blotting检测到抗体;三免后用间接ELISA法测定制备的多克隆抗体效价,结果显示抗体效价在1∶409 600左右,表明该蛋白具有较好的免疫原性及反应原性,为今后亚单位疫苗的研发提供试验数据。通过BspI蛋白的生物信息学和多克隆抗体的效价分析表明,BspI蛋白可能对布鲁氏菌在宿主细胞内的生存与繁殖有一定的影响,从而有利于布鲁氏菌在细胞内的长期生存,也可为进一步研究BspI蛋白的亚细胞定位和布鲁氏菌鞭毛对分泌蛋白的调控提供材料,为研究BspI蛋白的结构和功能提供参考。
4 结 论
BspI蛋白为亲水性蛋白,有跨膜区,无信号肽,有13个磷酸化位点和7个抗原决定簇,二级结构以α-螺旋、延伸链和无规则卷曲为主要组成部分;成功构建了布鲁氏菌分泌蛋白BspI的原核表达载体,表达纯化出25.3 ku的蛋白,并免疫试验兔获得了多克隆抗体,抗体效价为1∶409 600,具有较好的反应原性和免疫原性。
