中药联合益生菌对大肠杆菌性小鼠腹泻的保护作用
2022-08-23李春亭王沙沙葛冰洁张雪梅
李春亭,王沙沙,赵 欣,王 巍,葛冰洁,张雪梅
(延边大学农学院,延吉 133002)
腹泻是一种多因素引起的肠道疾病,主要包括细菌性腹泻、病毒性腹泻、寄生虫腹泻等[1],其中危害最严重的是细菌性腹泻。多种细菌菌株已被确认是细菌性腹泻的病原体,其中致病性大肠杆菌是造成动物细菌性腹泻最常见的病原菌之一[2-3],可感染所有种类及年龄的家禽和哺乳动物[4]。当饲养环境受到污染或机体免疫力下降时,致病性大肠杆菌菌群数量发生改变,导致炎症发生,髓过氧化物酶(MPO)活性升高等[5],从而引起机体腹泻、脱水并伴随其他脏器损伤[6]。大肠杆菌引起的腹泻会导致动物机体生理功能紊乱、生产性能下降,甚至引起动物死亡,目前兽医临床上对细菌性腹泻多采用抗生素疗法,但易产生细菌抗药性,同时抗生素残留也会危害人类健康[7]。
中药在治疗腹泻类疾病中展现出不可替代的优势,益生菌也为调节肠道菌群提供了新的策略[8]。与抗生素相比,中药副作用小且兼具抗菌消炎作用[9]。蒲公英、黄芪等多种中药活性成分都具有良好的抑菌效果和免疫调节作用[10-11]。益生菌也可通过生物夺氧、生物颉颃等改善肠道菌群[12-13],其中枯草芽孢杆菌应用较为广泛[14]。但在临床应用中,单味中药很难完全取代抗生素[15],长期单独服用益生菌也容易使机体产生依赖性,丧失繁殖益生菌的能力[16]。中药和益生菌在治疗疾病的过程中能相互作用、相互影响,一方面益生菌可以促进中药的吸收和利用,另一方面中药可以促进益生菌的增殖、抑制有害菌增殖、维持肠道微生态平衡[17],两者协同可提高药效。本试验通过建立致病性大肠杆菌小鼠腹泻模型,利用中药蒲公英、黄芪与益生菌枯草杆菌等联合处理,检测小鼠腹泻、体重、采食量、脏器系数、粪便隐血和MPO活性等,研究其联合应用对大肠杆菌性腹泻的保护作用,为中药联合益生菌在兽医临床上的应用提供科学依据,同时为动物养殖中细菌性腹泻提供有效的临床药物。
1 材料与方法
1.1 材料
1.1.1 试验动物 5~6周龄清洁级昆明小鼠110只,体重(20±2)g,购自延边大学实验动物中心。饲养于隔离笼中,自由采食、饮水,实验室温度(24±1)℃,相对湿度40%~80%,适应性饲养1周后进行试验。
1.1.2 主要试剂 亚硒酸盐胱氨酸増菌液(SC)、月桂基硫酸盐胰蛋白胨肉汤(LST)、HE琼脂、营养肉汤(NB)、伊红美蓝琼脂(EMB)、LB肉汤等均购自青岛海博生物公司;人粪便隐血测试盒(联苯胺法)购自南京建成生物工程研究所;小鼠MPO活性测定试剂盒购自Biolegend公司。
1.1.3 菌株 枯草杆菌标准菌株(编号:63501)购自中国农业科学院微生物研究所。大肠杆菌为从延边地区养殖场疑似大肠杆菌病病鸡的心脏、盲肠和直肠中分离、纯化鉴定得到的,并经致死性试验得到用于制作小鼠腹泻模型的注射剂量为1×107CFU/kg。
1.1.4 药物制备及正交试验 蒲公英和黄芪均购自延吉同仁堂大药房。蒲公英干草采用水煎法,合并滤液后旋转蒸发仪70 ℃浓缩制备蒲公英提取物;黄芪采用水提醇沉法,无水乙醇洗涤沉淀,60 ℃烘干制备黄芪多糖,采用乙醇回流石油醚萃取法,80%乙醇、80 ℃水浴回流2 h,石油醚萃取取下层液制备黄芪总黄酮;按照4因素3水平(表1)、L9(34)正交表设计正交试验,以细菌计数为指标分析各因素对大肠杆菌的抑菌效果,通过极差分析方法筛选中药联合益生菌各因素的最佳配比。
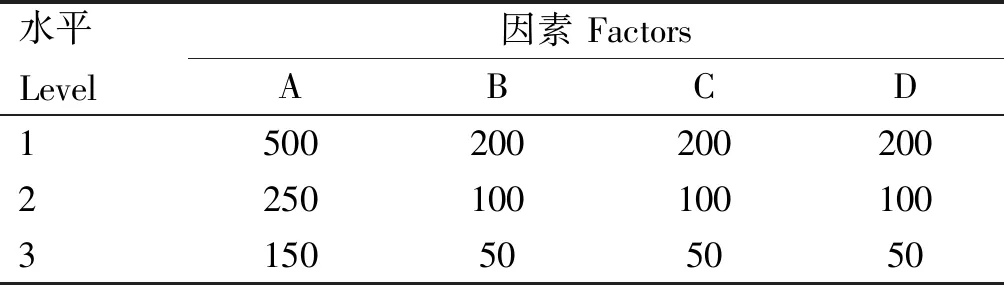
表1 因素水平表
1.2 小鼠分组及处理
将60只小鼠随机分为空白组(Blank)、模型组(Model)、中药组(TCM)、益生菌组(Prob)和中药联合益生菌组(TCM+Prob),每组12只。空白组小鼠腹腔注射生理盐水(0.2 mL/只),模型组、中药组、益生菌组和中药联合益生菌组均先腹腔注射分离菌悬液1×107CFU/kg,然后中药组按10 mL/kg灌胃中药液(其中蒲公英提取物浓度为0.25 g/mL,黄芪总黄酮和黄芪多糖浓度均为0.05 g/mL),益生菌组按4 mL/kg灌胃枯草杆菌悬液(菌含量5×107CFU/mL),中药联合益生菌组按上述量灌胃中药液和枯草杆菌混合液,每天定时灌胃给药1次,连续3 d。
建模判定标准:体重下降,饮食量减少,眼睑分泌物增多,动作迟缓,反应迟钝,屁股有明显污迹等。
1.3 测定指标与方法
1.3.1 样品采集 各试验组于末次给药12 h后进行采样。小鼠经眼球采血,一部分血液立即进行血液学指标分析;一部分血液分离血清于-20 ℃保存。处死后取小肠组织于-80 ℃保存,用于MPO活性测定;取其心脏、肝脏、脾脏、肾脏、肺脏用于脏器系数测定,取小鼠肠内粪便用于粪便隐血及肠内大肠杆菌数测定。
1.3.2 临床症状 注射分离菌悬液后开始每日记录各组小鼠体重、采食量及临床症状,连续3 d,试验结束计算小鼠腹泻率、稀便率、死亡率、治愈率和腹泻指数。
腹泻率(%)=腹泻小鼠数/小鼠总数×100%
死亡率(%)=死亡小鼠数/小鼠总数×100%
治愈率(%)=治愈小鼠数/腹泻小鼠数×100%
稀便率(%)=每只动物稀便数/每只动物总便数×100%
腹泻指数=稀便率×稀便级[18]
1.3.3 脏器系数测定 分离小鼠心脏、肝脏、脾脏、肾脏、肺脏,称量并计算脏器系数。
脏器系数(%)=脏器重量/小鼠体重×100%
1.3.4 血液学指标检测 采用全自动血细胞分析仪分析各组小鼠淋巴细胞比率(LYM)、中间细胞比率(MID)、粒细胞比率(GRAN)和白细胞总数(WBC)等血液学指标。
1.3.5 粪便隐血检测及肠内容物大肠杆菌计数 取各组小鼠粪便涂在白瓷板上,滴加邻联苯胺液后再滴加过氧化氢液,观察粪便隐血结果。取各组小鼠肠内容物0.1 mL加入0.9 mL生理盐水中混合静置,取上清液,用生理盐水稀释至适宜浓度。取100 μL上清液涂在EMB平板上37 ℃培养24 h,进行菌落计数。
1.3.6 MPO活性检测 采集血清和小肠组织匀浆,参照ELISA试剂盒说明书检测血清和小肠组织MPO活性。
1.4 数据统计分析
用SPSS 17.0软件进行单因素方差分析,组间差异采用t检验进行比较,结果以平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 正交试验结果
由表2可知,各因素体外抑制大肠杆菌的效果为A(蒲公英粗提物)>B(黄芪多糖)>D(枯草杆菌)>C(黄芪总黄酮);中药联合益生菌各因素最佳配比为A1B2C2D2,后续试验中所用的中药联合益生菌药液均根据此配比配制。
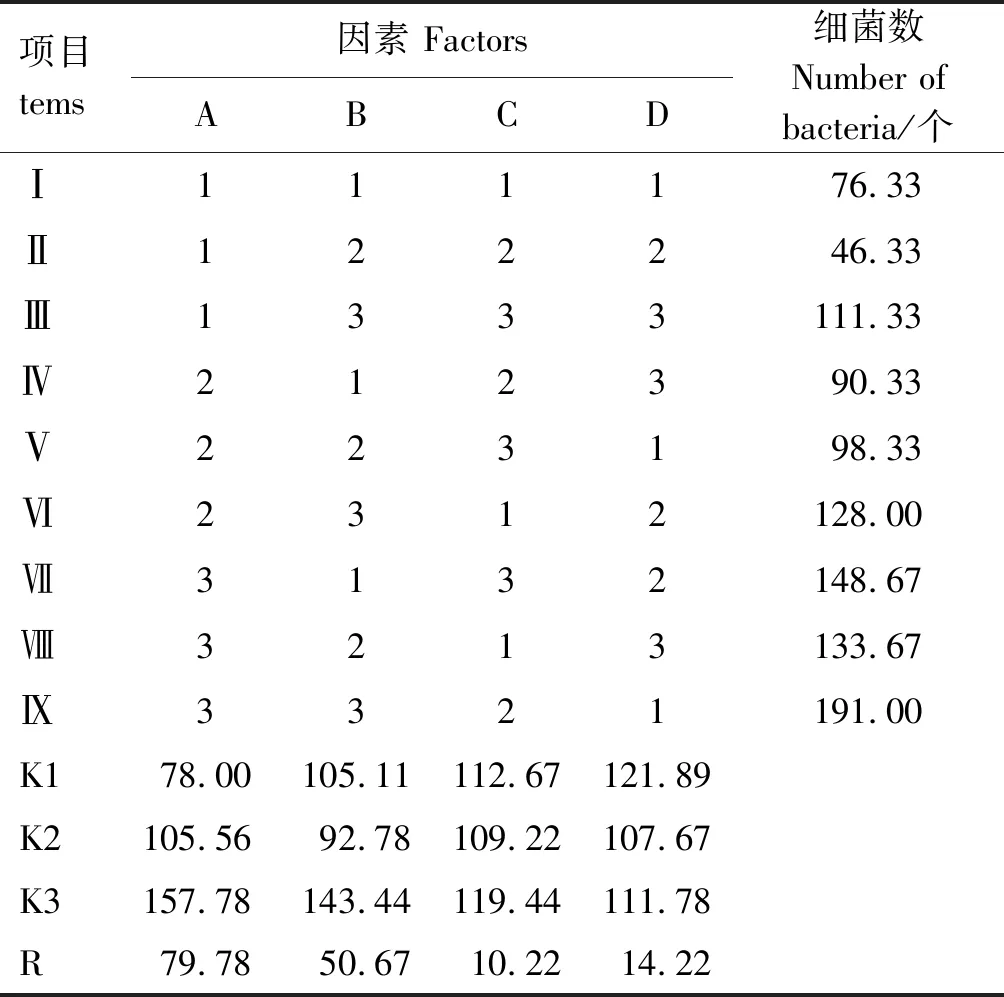
表2 正交试验结果
2.2 中药联合益生菌对大肠杆菌性腹泻小鼠临床指标的影响
由表3可知,给药3 d后空白组小鼠无腹泻症状,模型组腹泻率100%、无自愈现象,中药组和中药联合益生菌组腹泻率均为35%,益生菌组腹泻率为75%,益生菌组和中药组治愈率分别为50%和75%,中药联合益生菌组治愈率达100%。试验期间小鼠无死亡现象。由图1可知,与空白组相比,模型组腹泻指数极显著上升(P<0.01);与模型组相比,中药组、益生菌组、中药联合益生菌组腹泻指数均极显著下降(P<0.01),中药联合益生菌组治疗效果最明显。
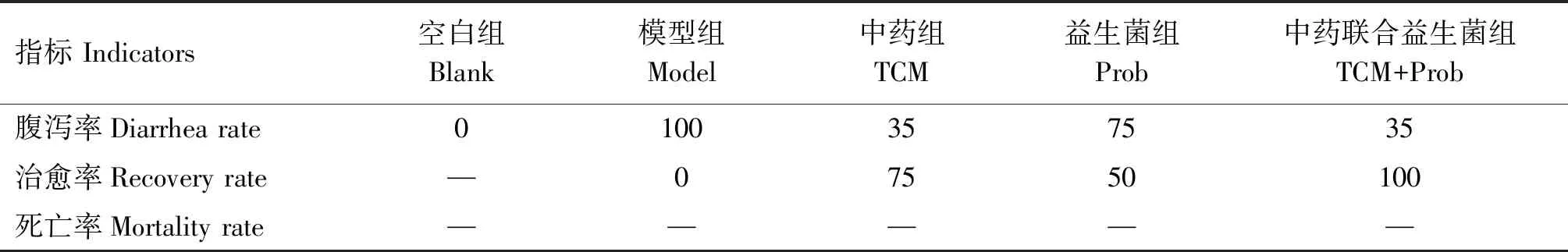
表3 各组小鼠临床指标
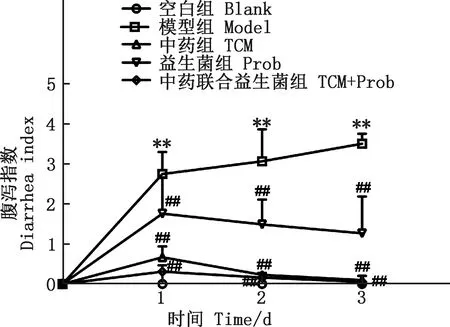
①模型组与空白组比较,*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。②药物组与模型组比较,#,差异显著(P<0.05);##,差异极显著(P<0.01);无#,差异不显著(P>0.05)。下同①Model group was compared with blank group, *, Significant difference (P<0.05); **, Extremely significant difference (P<0.01); No *, No significant difference(P>0.05). ②Drug treatment groups were compared with model group, #, Significant difference (P<0.05); ##, Extremely significant difference (P<0.01); No #, No significant difference(P>0.05). The same as below图1 各组小鼠的腹泻指数Fig.1 Diarrhea index of mice in each group
2.3 中药联合益生菌对大肠杆菌性腹泻小鼠体重及采食量的影响
由图2可知,与空白组相比,模型组小鼠体重极显著下降(P<0.01);与模型组相比,中药组小鼠体重在第2、3天显著性上升(P<0.05),中药联合益生菌组体重在第1天显著上升(P<0.05),第2、3天极显著上升(P<0.01),益生菌组体重无显著差异(P>0.05)。由图3可知,与空白组相比,模型组小鼠采食量极显著下降(P<0.01),与模型组相比,中药组、中药联合益生菌组采食量极显著上升(P<0.01),益生菌组采食量无显著差异(P>0.05)。
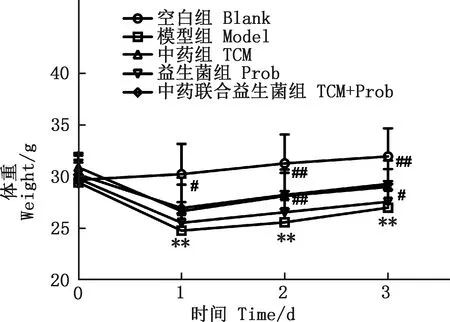
图2 各组小鼠的体重Fig.2 Body weight of mice in each group
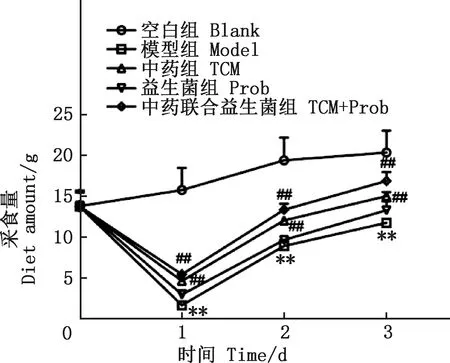
图3 各组小鼠的采食量Fig.3 Diet quantity of mice in each group
2.4 中药联合益生菌对大肠杆菌性腹泻小鼠脏器系数的影响
由图4可知,与空白组相比,模型组小鼠肝脏指数显著升高(P<0.05),脾脏指数极显著升高(P<0.01),心脏、肺脏、肾脏器官指数无显著差异(P>0.05);与模型组相比,中药组小鼠肝脏、脾脏指数显著下降(P<0.05),中药联合益生菌组小鼠肝脏、脾脏指数极显著下降(P<0.01),心脏、肺脏、肾脏指数无显著差异(P>0.05),益生菌组各脏器系数均无显著性差异(P>0.05)。
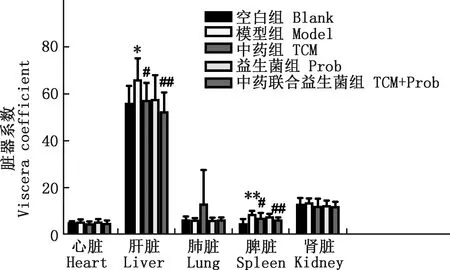
图4 各组小鼠的脏器系数Fig.4 Viscera coefficient of mice in each group
2.5 中药联合益生菌对大肠杆菌性腹泻小鼠血液学指标的影响
由表4可知,与空白组相比,模型组LYM极显著下降(P<0.01),MID显著下降(P<0.05),GRAN极显著上升(P<0.01),WBC无显著差异(P>0.05);与模型组相比,中药组、益生菌组、中药联合益生菌组LYM显著上升(P<0.05),GRAN显著下降(P<0.05),WBC、MID无显著差异(P>0.05)。
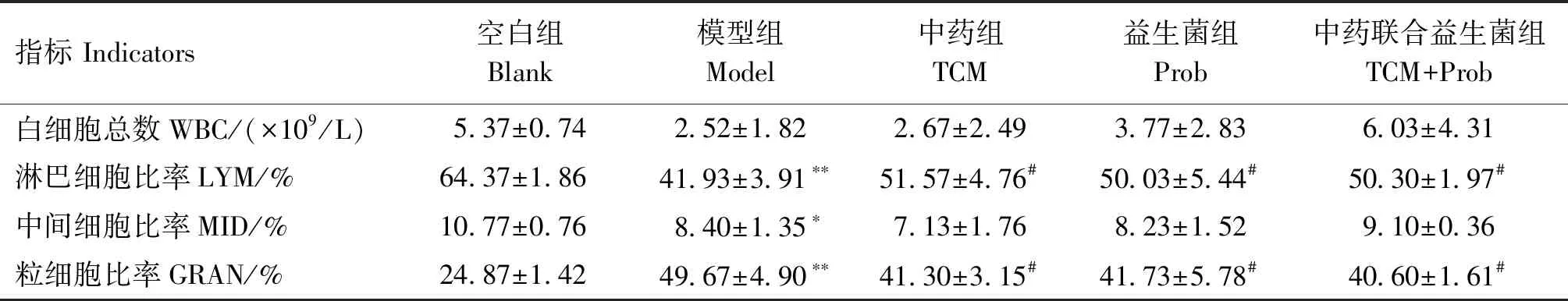
表4 各组小鼠的血液学指标
2.6 中药联合益生菌对大肠杆菌性腹泻小鼠粪便隐血和肠内容物大肠杆菌数量的影响
由表5可知,模型组小鼠粪便隐血检测结果均呈现强阳性,而中药组、益生菌组呈现弱阳性,空白组、中药联合益生菌组结果均为阴性;对肠内容物进行细菌计数,结果显示,与空白组相比,模型组大肠杆菌数量极显著升高(P<0.01);与模型组相比,中药组、益生菌组、中药联合益生菌组大肠杆菌数量均极显著降低(P<0.01)。

表5 各组小鼠粪便隐血情况和肠内容物大肠杆菌数量
2.7 中药联合益生菌对大肠杆菌性腹泻小鼠MPO的影响
由图5可知,与空白组相比,模型组小鼠血清、小肠组织MPO活性均极显著上升(P<0.01);与模型组相比,中药组、益生菌组和中药联合益生菌组血清MPO活性极显著下降(P<0.01),中药组小肠组织MPO活性显著下降(P<0.05),益生菌组、中药联合益生菌组小肠组织MPO活性极显著下降(P<0.01)。

图5 各组小鼠MPO活性Fig.5 MPO activity of mice in each group
3 讨 论
大肠杆菌等多种致病菌株能引起动物腹泻,导致腹泻率和腹泻指数增高[19]。腹泻率和腹泻指数可直接表明感染分离菌后的腹泻程度,体重、饮食量、临床症状在一定程度上可以反应机体的发育状况及病理变化。谷巍等[20]研究表明,嗜酸乳杆菌中药复方发酵液对小鼠大肠杆菌腹泻有治疗效果,小鼠腹泻率和腹泻指数均低于模型组。Ma等[21]研究表明,麒麟菜解聚硫酸多糖可降低腹泻小鼠的腹泻率和腹泻指数。本试验结果显示,中药联合益生菌可明显降低小鼠腹泻率和腹泻指数、提高腹泻小鼠的体重及饮食量,说明中药联合益生菌可减轻和改善大肠杆菌性小鼠腹泻情况。
脏器系数是动物试验中的常用指标,当脏器病理性萎缩或水肿时,脏器系数大小发生改变从而反映出器官功能的强弱。有研究表明,四君子汤[22]和白头翁复方[23]对大肠杆菌性腹泻小鼠预防效果显著,模型组小鼠肝脏、脾脏肿大明显减轻。血液学指标也是鉴别和诊断细菌性腹泻的重要参考指标,研究表明,大肠杆菌可以减少白细胞数量,造成免疫力下降,引起机体炎症反应[24]。本试验结果表明,致病性大肠杆菌可诱导小鼠肝脏和脾脏肿大,而中药联合益生菌可逆转大肠杆菌引起的小鼠脏器系数的改变,同时也明显恢复了模型组小鼠血液学指标的异常变化。粪便隐血是消化道异常的早期预警,对肉眼不能辨别的消化道少量或慢性出血应进行粪便隐血检测,已成为肠道疾病的早期诊断指标[25]。本试验结果表明,中药联合益生菌使大肠杆菌性腹泻小鼠粪便隐血由强阳性转阴性且肠内容物大肠杆菌数量减少。说明中药联合益生菌可改善小鼠腹泻及肠道出血症状。
MPO是氧化应激的重要产物,可反映脂质过氧化损伤的程度[26]。研究表明,MPO的在动物机体的外周淋巴细胞中表达,在腹泻类疾病急性期的肠组织和粪便中增加[27],可作为肠类疾病的生物标志物[28]。赵宝凯等[29]在金香颗粒预防小鼠大肠杆菌性腹泻试验中发现,与模型组相比,给药组小鼠小肠组织中MPO活性显著降低。张亚辉[30]用鹳榆止泻散治疗大肠杆菌性腹泻小鼠,给药组MPO活性明显低于模型组。Xu等[31]用黄柏提取物治疗大肠杆菌性腹泻小鼠发现MPO活性降低。本试验结果显示,各试验组大肠杆菌性腹泻小鼠小肠组织及血清中的MPO活性均低于模型组且血液学指标恢复,其中中药联合益生菌组效果最好,表明中药联合益生菌通过降低MPO活性对大肠杆菌性小鼠腹泻产生协同保护作用。
4 结 论
中药联合益生菌明显减轻致病性大肠杆菌腹泻小鼠临床症状,降低腹泻指数,提高体重、饮食量,降低肝脏、脾脏器官指数,改善血液学指标,使粪便隐血转阴并降低肠内大肠杆菌数、血清及小肠组织中MPO活性,从而对大肠杆菌性小鼠腹泻产生协同保护作用。
