梅花鹿成纤维细胞因子受体2基因多态性及其与茸重性状的关联分析
2022-08-23张禾垟刘琳玲李浩东郑军军王桂武
周 雅,张禾垟,刘琳玲,李浩东,郑军军,王桂武
(中国农业科学院特产研究所,长春 130112)
鹿茸具有抗疲劳、增强免疫力和改善性功能等多种药理作用,是重要的动物药材之一[1]。梅花鹿是中国茸鹿养殖的主体,其产茸量是直接关系到养殖业经济收益的重要经济性状,因此该性状在育种中备受关注。研究表明,鹿茸的再生是包括软骨、皮肤、血管和神经等组织的完全再生,因而茸重性状受多基因控制,依靠传统的育种方法,存在周期长、效率低等问题[2]。随着分子生物学技术的发展,梅花鹿育种进入分子育种是必然的趋势,相关分子标记的研究对推动其分子育种进程、提高动物产品产量等具有重要意义。
成纤维细胞因子受体2(fibroblast growth factor receptor 2,FGFR2)是成纤维细胞生长因子受体家族(fibroblast growth factor receptor,FGFR)的一员,由3个胞外免疫球蛋白结构域、1个疏水跨膜结构域和1个胞内酪氨酸激酶结构域组成[3]。其中第二和第三免疫球蛋白结构域是配体、成纤维细胞生长因子(fibroblast growth factors,FGFs)和肝素的主要结合位点[4-5]。而第3个免疫球蛋白结构域的mRNA存在2个可变剪切体,形成FGFR2b和FGFR2c 2个亚型[6]。在上皮细胞中编码FGFR2b亚型,主要与FGF7、FGF10结合,而在间质细胞中编码FGFR2c亚型,主要与FGF2、FGF4、FGF6、FGF8、FGF9等亲和力较高[6-7]。FGFR2与相关的FGF结合可激活多个信号通路调节血管内皮细胞、上皮细胞、成骨细胞和成纤维细胞等的增殖和分化,在皮肤和骨等多个组织发育中起重要作用,其中1个配体FGF2已被证明与梅花鹿鹿茸快速生长密切相关[8-9]。此外,FGFR2还可能通过与FGF21的受配体作用,产生相关信号分子,诱导毛囊由生长期和退化期进入静止期,而FGFR2b缺失会导致毛囊形成迟钝并减少[10-11]。FGFR2的多种功能与鹿茸生长过程相关,故推测该基因可能是促进鹿茸生长的关键基因。Hu等[12]通过梅花鹿产茸量相关的全基因组关联分析(genome-wide association study,GWAS)筛选到该基因,推测为茸重性状候选基因,但尚未进一步证明。
本研究以梅花鹿为研究对象,通过PCR直接测序检测FGFR2基因外显子上的突变,并使用飞行质谱法分析基因型,与茸重性状进行关联分析,旨在筛选梅花鹿茸重性状相关的分子标记,为梅花鹿分子育种提供依据。
1 材料与方法
1.1 试验动物
在吉林省长春市某鹿场选取314头24月龄饲养管理条件一致的梅花鹿作为研究对象。对314头梅花鹿进行颈静脉采血,经EDTA抗凝处理,准确记录编号后暂存至冰盒内带回实验室进行分装,置于-20 ℃保存备用。使用电子秤称量生长45 d左右的二杠茸重量,精确到1 g。所有样本茸重经平均值±3倍标准差(μ±3σ)剔除异常值,近似符合正态分布。
1.2 主要试剂
血液DNA提取试剂盒和2×TransStart®FastPfu PCR SuperMix (-dye)均购自北京全式金生物技术有限公司;2×EsTaqMasterMix(Dye)购自北京康为世纪生物科技有限公司;DNA Marker、6×Loading Buffer和10×Loading Buffer均购自TaKaRa公司。
1.3 DNA提取与PCR扩增
按照血液DNA提取试剂盒操作步骤提取血液样品DNA。用NanoDrop 2000检测所提取DNA 的纯度和浓度,并用1.2%琼脂糖凝胶电泳检测DNA完整性,将质量合格的DNA样品保存备用。根据梅花鹿基因组中FGFR2基因序列[13],使用NCBI中的Primer-BLAST设计FGFR2基因第1~17外显子扩增引物,扩增产物包含全部外显子和部分内含子序列,引物序列见表1。引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系25 μL:2×EsTaqMasterMix 12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,ddH2O补充至25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,退火(各引物退火温度见表1)30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸7 min;4 ℃保存。PCR产物用2.0%琼脂糖凝胶电泳检测合格后送生工生物工程(上海)股份有限公司测序。测序结果利用DNAMAN和Chromas 2软件进行比对,筛选SNPs位点。

表1 梅花鹿FGFR2基因各外显子的引物信息
1.4 基因分型
FGFR2基因候选位点利用MassARRAY®技术进行分型,该步骤交由北京阅微基因技术股份有限公司完成,相关分型引物信息如表2所示,具体操作步骤如下:①将质检合格的DNA样本放入384孔板进行PCR扩增,PCR反应体系5 μL/孔:PCR Buffer(含15 mmol/L MgCl2) 0.625 μL,MgCl2(25 mmol/L) 0.325 μL,dNTP Mix(4种dNTP 各自浓度为25 mmol/L) 0.1 μL,扩增引物Mix(上、下游引物各自浓度为500 nmol/L) 1 μL,HotStarTaq(5 U/μL) 0.1 μL,DNA模板(10 ng/μL) 1 μL,ddH2O 1.850 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性20 s,56 ℃退火30 s,72 ℃延伸1 min,共45个循环;72 ℃延伸3 min;4 ℃保存。②PCR产物进行SAP纯化反应,反应体系2 μL/孔:SAP Buffer(10×) 0.17 μL,SAP Enzyme(1 U/μL) 0.3 μL,ddH2O 1.53 μL。PCR反应程序:37 ℃温育40 min,85 ℃热失活5 min,4 ℃保存。③单碱基延伸反应,反应体系2 μL/孔:iPLEX buffer plus 0.2 μL,iPLEX terminator 0.2 μL,扩增引物Mix 0.940 μL,iPlex Enzyme 0.041 μL,ddH2O 0.619 μL。反应程序:94 ℃预变性30 s;94 ℃变性5 s,52 ℃退火5 s,80 ℃延伸5 s,共40个循环;72 ℃延伸180 s,4 ℃保存。④树脂纯化:将反应产物(共9 μL)稀释3倍,使用树脂进行脱盐,脱盐处理后的样品点在样品靶上,自然结晶。⑤上机进行质谱检测,并收集数据。
1.5 数据统计分析
利用Excel 2019计算梅花鹿FGFR2基因的基因型频率、基因频率及相关遗传多样性参数:观测杂合度(heterozygosity observed,Ho)、期望杂合度(expected heterozygosity,He)、有效等位基因数(effective number of alleles,Ne)和多态信息含量(polymorphism information content,PIC),并进行χ2适合性检验,检测是否符合Hardy-Weinberg平衡定律。利用Haploview 4.2软件进行单倍型分析。利用SPSS 25.0软件中一般线性模型(general linear model,GLM)单因素方差分析对梅花鹿群体中各位点基因型以及单倍型与茸重性状进行关联分析,存在群体数量低于5%的基因型的位点采用非参数检验Kruskal-Wallis H检验方法进行分析,使用最小显著差异法(least significant difference,LSD)进行多重比较,结果用平均值±标准误表示,以P<0.05为差异显著性判断标准。模型:Yij=μ+Gi+eij。其中,Yij为茸重性状观察值,μ为群体均值,Gi为基因型固定效应,eij为随机残差效应。

表2 SNPs引物信息
2 结 果
2.1 PCR扩增
PCR扩增结果显示,17对引物的PCR扩增产物均呈现清晰、明亮的特异性条带(图1),且与预期产物大小一致,可用于后续试验。

M,DL2000 DNA Marker;1~17分别为FGFR2基因第1~17外显子扩增产物M,DL2000 DNA Marker;1-17,Amplification products of exons 1 to 17 of FGFR2 gene图1 梅花鹿FGFR2基因PCR扩增结果Fig.1 PCR amplification results of FGFR2 gene in sika deer
2.2 测序验证
经检测发现,梅花鹿FGFR2基因存在12个SNPs,其中g.80998742 G>A、g.80987708 G>A、g.80975864 T>G、g.80936928 C>T和g.80928230 C>T位点分别位于外显子2、外显子4、外显子5、外显子12和外显子15上;g.80943673 T>C和g.80943683 C>A位点均位于内含子8;g.80940697 T>G、g.80938545 G>A、g.80938352 C>T、g.80928299 C>T和g.80928115 A>G分别位于内含子9、内含子10、内含子11、内含子14和内含子15(部分结果见图2,外显子2为反向测序其余均为正向测序)。80998742 G>A、g.80987708 G>A、g.80975864 T>G、g.80936928 C>T和g.80928230 C>T 5个外显子上的突变均未引起氨基酸改变,为同义突变。

图2 梅花鹿FGFR2基因部分SNPs位点测序结果Fig.2 Sequencing results of partial SNPs in FGFR2 gene in sika deer
2.3 质谱分型
分型结果显示,g.80975864 T>G位点未分型成功,其余11个位点可做后续分析。其中g.80940697 T>G和g.80936928 C>T仅存在2种基因型,其余位点均存在3种基因型(部分结果见图3)。

图3 梅花鹿FGFR2基因部分SNPs位点分型结果Fig.3 Typing results of partial SNPs in FGFR2 gene in sika deer
2.4 梅花鹿FGFR2基因多态性分析
梅花鹿FGFR2基因各位点基因型频率、基因频率、相关遗传多样性参数及χ2检验结果见表3。由表3可知,各位点Ho和He基本一致,g.80943673 T>C、g.80943683 C>A及g.80938352 C>T位点属于中度多态(0.25
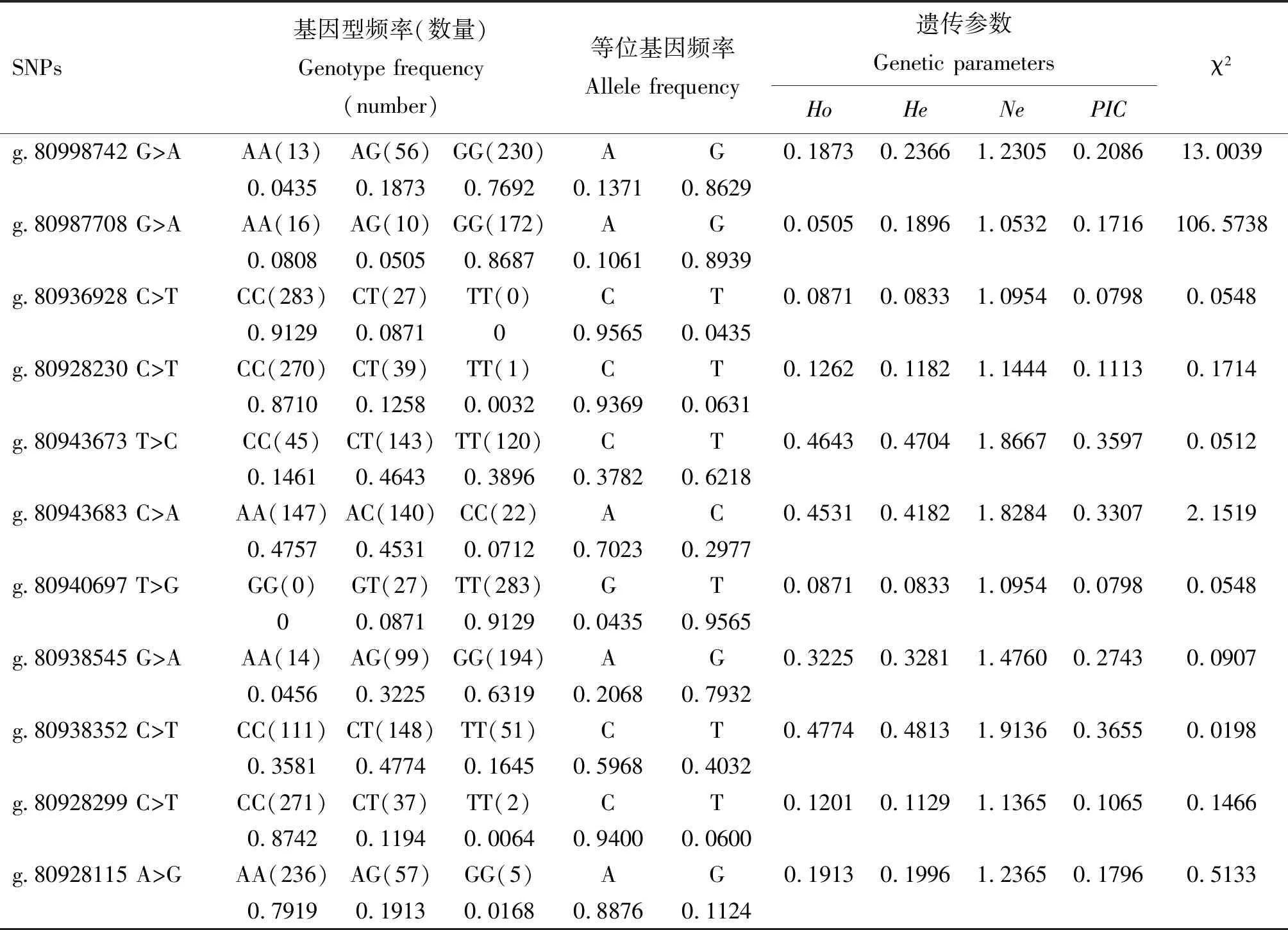
表3 梅花鹿FGFR2基因SNPs位点的群体遗传学分析
2.5 FGFR2基因多态性与梅花鹿茸重性状的关联分析
FGFR2基因11个SNPs位点的不同基因型与梅花鹿茸重性状的关联分析结果见表4。结果显示11个位点各基因型之间茸重差异均不显著(P>0.05)。

表4 梅花鹿FGFR2基因SNPs位点各基因型与茸重的关联分析
2.6 FGFR2基因单倍型与梅花鹿茸重性状的关联分析
对梅花鹿群体FGFR2基因11个SNPs位点进行连锁不平衡和单倍型分析,结果见图4。FGFR2基因g.80987708 G>A位点检出率较低,在分析中剔除,g.80938545 G>A、g.80940697 T>G、g.80943673 T>C和g.80943683 C>A位点之间处于强连锁不平衡状态(D′>0.96,r2>0.72)。
通过连锁不平衡分析发现,梅花鹿群体中存在5种单倍型,分别为GTCA、GTTA、ATTC、GTTC和GGTC。由表5可知。FGFR2基因各单倍型间茸重差异均不显著(P>0.05)。
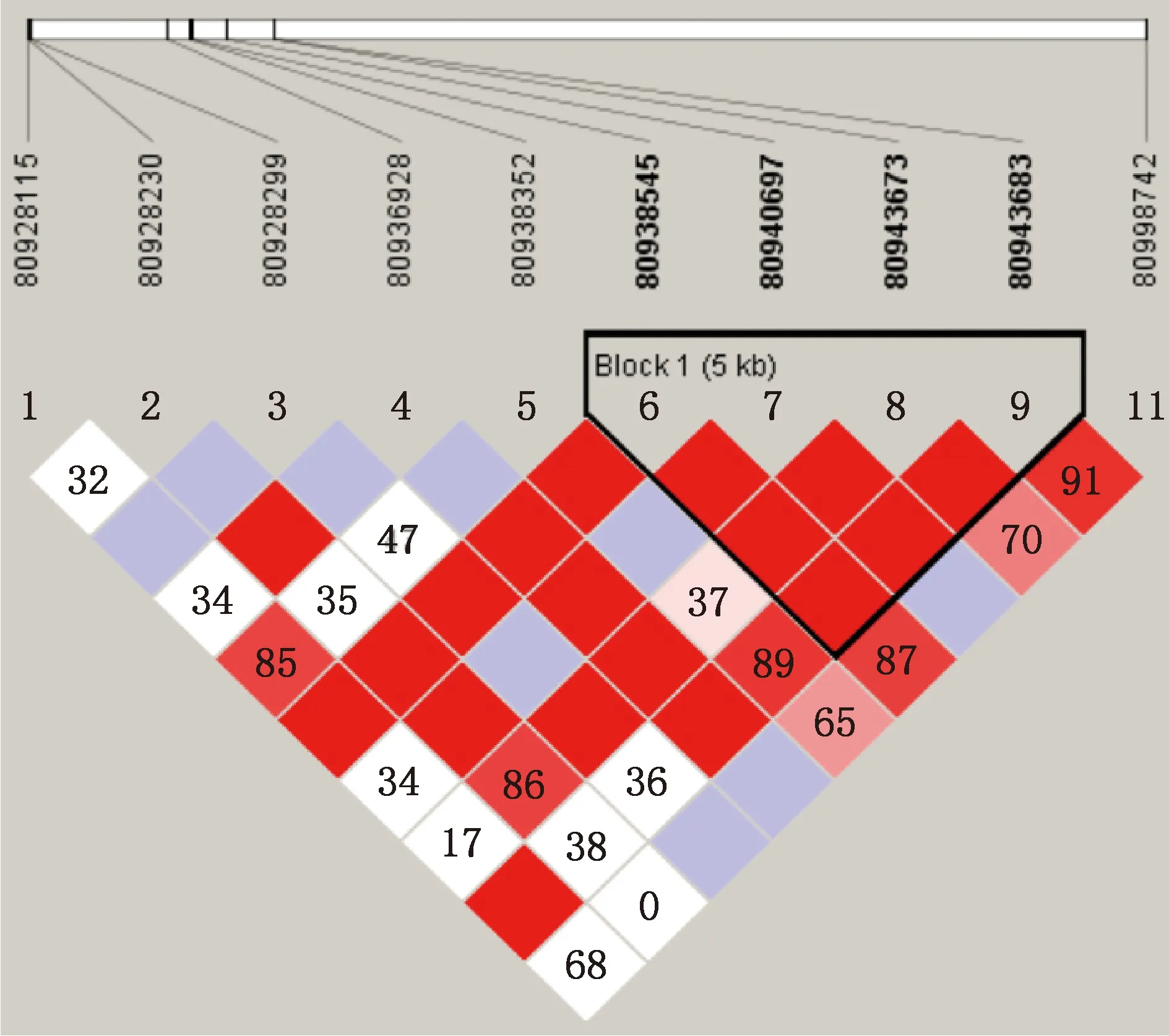
图4 梅花鹿FGFR2基因SNPs连锁不平衡分析Fig.4 Linkage disequilibrium analysis of SNPs of FGFR2 gene in sika deer

表5 FGFR2基因单倍型对梅花鹿茸重的影响
3 讨 论
鹿茸具有很高的药用价值,价格昂贵,故茸重性状也广受关注。近年来,随着分子生物技术的发展,分子育种技术已广泛应用于畜禽育种中,并取得了良好的效果。鹿茸属于限性性状,通过传统的育种方法具有很大的局限性,利用分子遗传标记对梅花鹿鹿茸生长特性进行研究,可以有效地克服传统育种方法的不足,提高梅花鹿鹿茸产量。鹿茸生长机制复杂,其相关分子标记也相当匮乏。胡鹏飞等[14]选用饲养条件基本一致的高、低产梅花鹿各50只做重测序的全基因组关联分析,筛选出与茸重性状显著相关的SNPs位点96个。Jia等[15]通过转录组测序挖掘梅花鹿茸重性状相关的表达序列标签(expressed sequence tag,EST)微卫星,筛选出了8个EST微卫星,特别是M009和M027,可作为二杠茸茸重性状的分子标记。二者分别从基因组测序和转录组测序挖掘与茸重性状相关的分子标记,丰富了筛选高产梅花鹿的遗传资源。杜志恒等[16]对生长激素(growth hormone 1,GH1)基因进行多态性检测,结果表明,其内含子2上存在G→A突变,存在3种基因型,各基因型在第五锯产茸量存在一定差异。Yang等[17]发现,褪黑激素Ⅰ型受体a亚型(melatonin receptor 1A,MTNR1A)基因外显子2上存在G629C突变,存在3种基因型,CC基因型产茸估测值显著高于GC基因型,GC基因型产茸估测值显著高于GG基因型。
FGFR2基因位于梅花鹿第9号染色体,共17个外显子,编码区长2 460 bp,编码819个氨基酸。既往研究发现FGFR2在骨发育中发挥重要作用,可促进间充质干细胞的募集和增殖,通过正向调节Wnt/β-catenin信号通路促进成骨细胞的分化,在骨损伤后修复中研究广泛[18]。FGFR2还可调节癌症干细胞的增殖和凋亡,在乳腺癌[19-20]、胃癌[21]、食管鳞癌[22]和胆管癌[23]等多种癌症的发展中发挥重要作用。本研究采用直接测序法检测FGFR2基因17个外显子及部分内含子的多态性,共发现12个SNPs位点,进一步分析发现,g.80943673 T>C、g.80943683 C>A及g.80938352 C>T位点杂合度较高,多态信息含量为0.3597、0.3307及0.3655,为中度多态位点,这3个位点的群体遗传变异程度较大,遗传多样性比较丰富,具有一定的选择潜力,而其余8个位点杂合度较低,为低度多态位点,选择潜力较小。χ2检验结果显示,g.80998742 G>A和g.80987708 G>A位点偏离Hardy-Weinberg平衡状态,其他位点均处于Hardy-Weinberg平衡状态。连锁不平衡和单倍型分析结果显示,FGFR2基因4个位点处于强连锁不平衡状态,产生5种单倍型。关联分析结果显示,11个位点各基因型及5种单倍型之间茸重差异均不显著。
4 结 论
本研究梅花鹿群体中FGFR2基因存在12个SNPs,其中5个为同义突变,有1个同义突变位点(g.80975864 T>G)未分型成功。该基因有4个SNPs处于强连锁不平衡状态,产生5种单倍型。FGFR2基因各位点基因型及单倍型间茸重差异均不显著,说明这11个SNPs均不适用于梅花鹿茸重性状的选育。
