可量化的益生菌与茶多酚复配模型的抑菌机理及其在牙膏中的功效研究
2022-08-22陈健芬宋云云孙东方张莉慧
陈健芬 宋云云 孙东方 张莉慧
(1.苏州市金茂日用化学品有限公司,江苏 苏州 215341;2.江苏大学,江苏 镇江,212013;3.黑龙江省轻工科学研究院,黑龙江 哈尔滨 150010)
引言
口腔疾病的发生与口腔致病菌的粘附定殖以及生物膜的形成密切关联[1,2]。尤其是致病菌形成的生物膜,对外界环境有很强的适应性[3]。口腔致病菌不仅能够引起口腔微生态失衡,从而诱发口腔疾病,也是阿尔茨海默症、肺炎、肿瘤和糖尿病等疾病的诱发因素之一[4]。伴放线放线杆菌是一种具有高致病潜力的革兰氏阴性口腔致病细菌,易在口腔中滋生定殖形成结构复杂的牙菌斑生物膜,引发牙周病[5]。另外,伴放线放线杆菌能够分泌合成多种高毒力因子,引起牙周炎的发生和发展,进而造成牙龈出血,牙齿松动、口臭等症状[6,7]。有研究报道,伴放线放线杆菌与胃癌、白血症等病症也有一定相关性[8,9]。近年来,运用益生菌预防和治疗口腔疾病受到越来越多的关注[10,11]。相比于传统的机械疗法及药物疗法,益生菌能够起到调节口腔微生态平衡、抑制生物膜以及破坏致病菌毒力等作用[12]。
茶多酚作为绿色无污染的天然抑菌剂在食品中应用广泛。现有研究表明茶多酚对口腔致病菌有抑制作用,目前已经广泛用于牙膏产品中[13,14]。然而,将茶多酚与益生菌复配使用对抑制口腔致病菌的协同抑菌机理研究目前未见报道。因而探索研究益生菌和茶多酚的最佳复配比例,建立在口腔清洁护理用品中运用的益生菌和茶多酚的复配抑菌模型,通过研究伴放线放线杆菌的降低量和生物膜抑制量等特性指标,多维度地评价益生菌和茶多酚的复配抑菌模型对致病菌的抑制效能,探索益生菌与茶多酚复配抑菌模型对口腔致病菌抑菌作用的科学有效性。
益生菌改善口腔健康主要是通过与口腔致病菌竞争结合位点,阻碍致病菌的定殖,从而使致病菌从口腔中排出。益生菌产生的代谢物质,如有机酸、细菌素等,能够有效抑制致病菌的生长以及生物膜的形成[15]。有研究表明将益生菌进行灭活处理后仍可对机体发挥相应的功效,且效果优于活菌[16,17]。副干酪乳杆菌是口腔微生物群中最常见的乳杆菌,其灭活菌粉能与口腔致病菌产生凝聚沉淀[18]。有研究同时表明益生菌与致病菌共凝聚能力与益生菌的疏水性有很大关系,可能是因为菌体表层蛋白影响了菌体表面性质[19]。茶多酚能够抑制口腔致病菌生物膜的形成,通过破坏细菌膜和细菌壁、抑制核酸合成等方式杀死致病菌,而且能够抑制致病菌产生有害代谢产物及促炎相关基因表达[20]。然而,益生菌灭活菌粉对口腔致病菌的共凝聚机理目前尚不清楚,且益生菌与茶多酚复配后对口腔致病菌的协同抑菌机理研究未见有报道。
因此,本研究探索性地运用多种材料学和生物化学相关理论与专业知识相结合的手段,可量化地探测益生菌和致病菌的表面形态、化学组分、菌体表面电荷和表面粗糙度等微观动态。傅里叶近红外光谱检测结果表明了益生菌与致病菌表面同时具有-CH2-和-CH3低表面能官能团,具有相似低表面能基团的益生菌和致病菌会发生共凝聚。同时益生菌表面粗糙度为Ra=19.5nm,比伴放线放线杆菌表面更粗糙,因此益生菌粘附作用更强,在口腔内能与致病菌竞争粘附位点从而减少致病菌数量。茶多酚具有杀菌作用,通过益生菌的共凝聚与茶多酚的杀菌双重特性,达到显著抑制伴放线放线杆菌滋生的目的。据此发现并分析研究益生菌与天然茶多酚协同对伴放线放线杆菌的抑菌机理。比对益生菌、茶多酚单独添加以及益生菌和茶多酚复配抑菌模型在牙膏中对3种常见致病菌(伴放线放线杆菌、变异链球菌和具核梭杆菌)的抑菌作用结果的差异性,为益生菌干粉复配茶多酚抑菌模型在牙膏等口腔清洁护理用品中的应用,提供充分的理论依据与运用技术的支撑。
1 方法与结果
1.1 材料与分析
1.1.1 试剂与仪器
选用现牙膏中常用的两款益生菌:副干酪乳杆菌干粉、复合益生菌干粉(嗜酸乳杆菌、副干酪乳杆菌、唾液乳杆菌);血平板和0.5%结晶紫染色液购于常德比克曼生物科技有限公司,2.5 L厌氧罐C-31、二氧化碳产气袋C-3和厌氧产气袋购于上海创凌生物科技有限公司;LIVE/DEAD® BacLightTM细菌活性检测试剂盒7012购于陕西捷科达科技有限公司;磷酸盐缓冲液(pH=7.2~7.4)、2.5%戊二醛固定液(分析纯)、氯化钠(分析纯)、茶多酚(95%)购于国药集团化学试剂有限公司,牙膏样品由苏州市金茂日用化学品有限公司提供。
菌液制备:本试验中选用的伴放线放线杆菌ATCC 29523购自广东省科学院微生物研究所,使用血平板培养基(TSA+5%脱纤维蛋白羊血)进行培养,在37℃、5% CO2环境下培养48h,用磷酸缓冲盐液(PBS,pH=7.2~7.4)调节菌体浓度至 1×109CFU/mL备用。
主要仪器设备如表1所示。

表1 主要仪器
1.1.2 数据分析
试验中,使用SPSS 18.0软件以 5%的显著性水平对数据进行统计分析,试验数据表达形式为平均值±标准偏差,所有试验均设置3个重复试验。
1.2 建立益生菌和茶多酚复配抑菌模型
1.2.1 确定益生菌最佳有效添加量
通过测定两种益生菌干粉产品的抑菌性能,以选取抑菌效果胜出的益生菌。采用Lv等[21]所用的牛津杯双层平板法,首先配置浓度为0.02g/mL的副干酪乳杆菌和复合益生菌菌液。配置含100μL伴放线放线杆菌菌液(浓度约为1×109CFU/mL)的血平板(TSA+5%脱纤维蛋白羊血),吸取100μL制备好的益生菌菌液加入牛津杯孔中,培养皿于37℃培养48h后测量抑菌圈直径。
同时,通过共凝聚试验方法进一步测定益生菌对伴放线放线杆菌的作用效果。在Arellano-Ayala和Fadare等[22,23]所用的方法基础上进行优化:将副干酪乳杆菌益生菌干粉和复合益生菌干粉配置成浓度为0.02g/mL的菌液,分别与制备好的伴放线放线杆菌菌悬液按照1∶1体积混合,静置0.5h和1h后轻轻吸取100μL上清液,用十倍稀释法稀释,吸取100μL不同比例的稀释液涂布,37℃下培养48h后计数。最后,通过比较抑菌圈直径以及伴放线放线杆菌降低量,选出作用效果较好的益生菌进行下一步试验,试验重复3次。
结果显示:相同浓度下,副干酪乳杆菌与复合益生菌对伴放线放线杆菌的抑制作用没有显著差异(表2),但是抑菌效果均明显小于茶多酚(P<0.05)。如图1所示,将浓度均为0.02g/mL的副干酪乳杆菌和复合益生菌与伴放线放线杆菌菌悬液等比例混合放置0.5h后,伴放线放线杆菌的降低量没有显著差异(P>0.05)。放置1h后,经副干酪乳杆菌处理后的伴放线放线杆菌降低量为0.22±0.02 Log10CFU/mL,显著高于复合益生菌作用后伴放线放线杆菌的降低量(0.17±0.02 Log10CFU/mL),(P<0.05)。据此,选用副干酪乳杆菌进行下一步研究。

表2 不同物质对伴放线放线杆菌的抑制作用

不同的小写字母表示数据之间具有显著差异性,P<0.05。
将筛选出的益生菌(副干酪乳杆菌)干粉按照0.3%、0.5%、0.7%、1%、1.5%、2%、2.5%、3%和4%(m/v)的添加量用PBS缓冲液配置成不同浓度的益生菌溶液。按照上述方法操作,通过比较静置1h后伴放线放线杆菌的菌落降低量选出合适的益生菌添加量,试验重复3次。
结果表明:将不同浓度的副干酪乳杆菌与伴放线放线杆菌混合作用1h后,当益生菌添加量小于1.0%(0.01g/mL)时,伴放线放线杆菌的降低量没有显著差异(P>0.05),随着益生菌浓度增高,伴放线放线杆菌的降低量增加(图2)。然而,当益生菌添加量大于3.0%(0.03g/mL)时,伴放线放线杆菌的降低量逐渐减少。因此,副干酪乳杆菌最适的添加量范围为1.0%~3.0%。
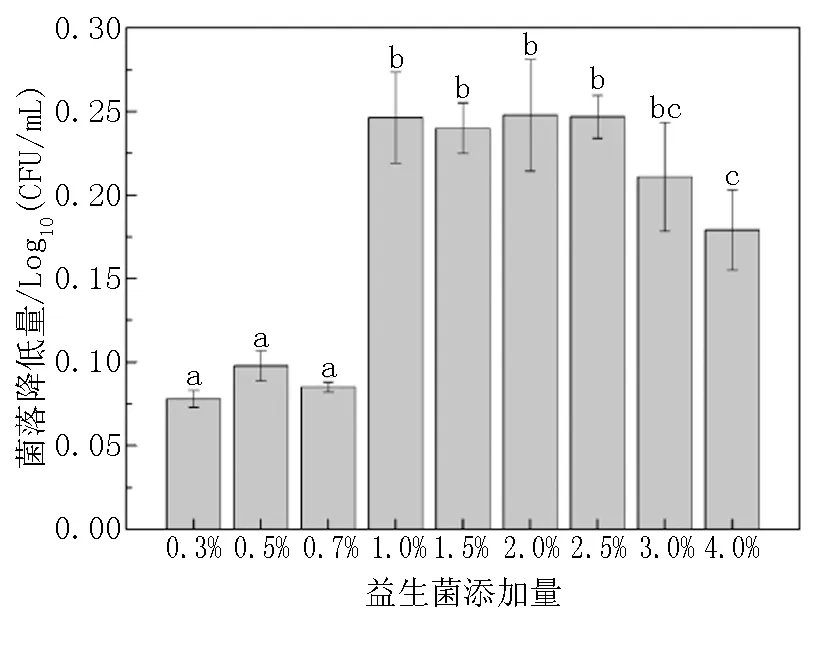
不同的小写字母表示数据之间具有显著差异性,P<0.05。
1.2.2 建立益生菌和茶多酚最佳抑菌模型
测定茶多酚对伴放线放线杆菌的最小抑菌浓度(MIC),配置浓度为0.02g/mL的茶多酚溶液,按照两倍稀释法稀释[24],与伴放线放线杆菌的菌悬液按照1∶1的比例混合,置于96孔板中于37℃培养48h,以肉眼观察无细菌生长为最小抑菌浓度。结果表明:茶多酚的最小抑菌浓度(MIC)为 2.5mg/mL。
另外,按照副干酪乳杆菌的添加量为1%配置益生菌溶液,配置最小抑菌浓度的茶多酚溶液,与益生菌溶液按2∶1、1∶1、1∶2、1∶3的比例混合,之后与伴放线放线杆菌的菌悬液按照1∶1的比例混合,静置1h, 轻轻吸取上清进行计数,阳性对照为添加等量的益生菌或茶多酚,阴性对照为添加等量的PBS缓冲液。通过比较伴放线放线杆菌的降低量确定益生菌与茶多酚的最佳比例,试验重复3次。
结果表明:当益生菌(0.01g/mL)和最小抑菌浓度的茶多酚比例为2∶1时,茶多酚和益生菌协同作用下伴放线放线杆菌的降低量显著高于单独的益生菌或茶多酚(图3)。另外,随着茶多酚量的增加,茶多酚作用后伴放线放线杆菌的降低量显著增加,这是因为茶多酚具有杀菌作用[25],随着茶多酚浓度增加,茶多酚和益生菌复配以后的抑菌效果低于单独的茶多酚。这和上述益生菌和茶多酚的抑菌试验结果一致,进一步表明益生菌的抑菌作用主要依靠共凝聚作用,而茶多酚依靠杀菌作用抑制伴放线放线杆菌的生长。因此,益生菌和茶多酚最佳抑菌模型为益生菌(0.01g/mL)和茶多酚比例为2∶1。
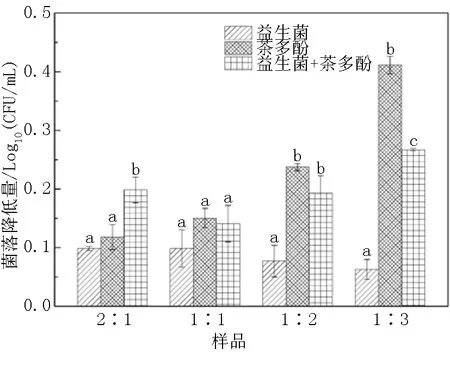
不同的小写字母表示数据之间具有显著差异性,P<0.05)。
1.3 益生菌和茶多酚复配抑菌模型的抑菌机理研究
1.3.1 对伴放线放线杆菌生物膜量分析测定
参照秦苏佳和Phumat等[26,27]采用的方法,对伴放线放线杆菌生物膜量作分析测定。用TSB液体培养基配置最佳配比的益生菌和茶多酚溶液,将配置的益生菌、茶多酚以及益生菌和茶多酚最佳复配模型溶液吸取100μL置于96孔板中,与100μL的伴放线放线杆菌菌悬液等比例混合。阴性对照为TSB培养基与伴放线放线杆菌菌悬液按照等比例混合,37℃下培养48h。之后吸取出培养液,用PBS清洗两遍,加入50μL浓度为0.5%的结晶紫避光染色15min,洗涤晾干后用200μL 95%乙醇溶解结晶紫,用酶标仪在OD595nm下测吸光度,试验重复三次。生物膜抑制率计算公式为:
牙菌斑生物膜是引起牙周炎的初始因素,抑制致病菌生物膜的形成能够有效治疗牙周病[28]。通过生物膜形成量的测定,可知益生菌和茶多酚均能有效抑制致病菌生物膜的形成,抑制率分别达到62.3%和61.4%(图4)。益生菌和茶多酚最佳配比抑菌模型对伴放线放线杆菌生物膜量的抑制率上升为71.7%,显然高于单独益生菌或茶多酚的抑制率(图4)。
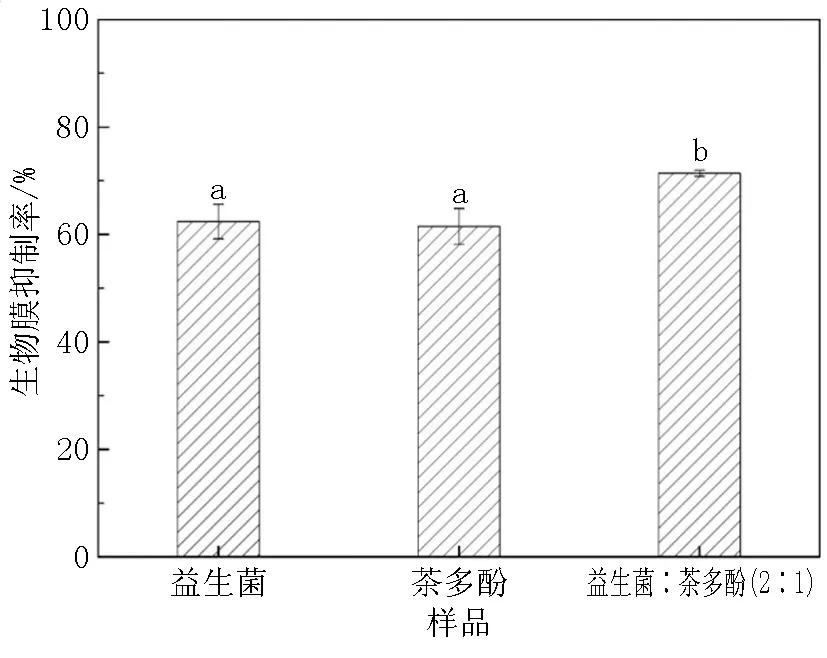
不同的小写字母表示数据之间具有显著差异性,P<0.05。
1.3.2 扫描电镜形貌分析
利用扫描电镜观察用益生菌和茶多酚处理后伴放线放线杆菌细胞表面形态。参考Song等[29]描述的方法,将益生菌和茶多酚最佳配比抑菌模型与伴放线放线杆菌菌悬液等比例混合,静置1h后弃去上清。阳性对照为添加等量益生菌或茶多酚,阴性对照为添加等量的PBS缓冲液。处理组和对照组的菌体沉淀用2.5%戊二醛4℃过夜固定,接着用PBS(0.1mol/L,pH=7.2)清洗两次,然后用30%、50%、70%、80%、90%和100%的乙醇脱水,最后干燥喷金并进行形态观察。
如图5a所示,单独的伴放线放线杆菌菌体比较完整,表面较为平整。大部分益生菌菌体完整,少部分菌体有轻微凹陷(5b),分析是因为益生菌制备成干粉时,对菌体有部分损伤。然而,单独的益生菌和伴放线放线杆菌菌落分散或者单纯叠加一起,没有共凝聚现象。经过益生菌处理以后,益生菌和致病菌菌体粘连一起,表明益生菌与致病菌菌体之间产生共凝聚现象(图5c)。而茶多酚处理以后,菌体表面变得凹凸不平,有部分菌体破裂,细胞内物质流出(图5d),说明茶多酚对致病菌具有杀菌作用,破坏了细菌细胞完整性[30]。当益生菌和茶多酚协同作用时,既能观察到共凝聚现象,也有细菌破裂的现象(图5e)。扫面电镜结果进一步证实了抑菌试验结果,说明益生菌对伴放线放线杆菌主要为共凝聚作用,加入茶多酚以后,其杀菌作用能够提高益生菌对伴放线放线的抑菌作用。

a,伴放线放线杆菌;b,益生菌;c,益生菌+伴放线放线杆菌;d,茶多酚+伴放线放线杆菌;e,益生菌:茶多酚(2∶1)+伴放线放线杆菌。
1.3.3 菌体表面电荷测定
将益生菌和茶多酚最佳抑菌模型与伴放线放线杆菌菌悬液等比例混合,静置1h后弃去上清,得到的菌体沉淀用PBS(pH=7.2~7.4)重新溶解后用zeta电位仪测定菌体表面电荷。阳性对照为添加等量的益生菌或茶多酚,阴性对照为添加等量PBS缓冲液的益生菌和伴放线放线杆菌。
细菌表面电荷较高时会提供排斥力,增加细胞的稳定性。当zeta电位绝对值减小时,细胞之间因为排斥力下降而发生凝聚沉积作用[31]。表3结果表明:益生菌与伴放线放线杆菌作用以后,zeta电位绝对值下降,说明菌体之间发生了共凝聚作用。另外,益生菌与茶多酚协同作用以后,zeta电位绝对值降低,降低量小于单独的益生菌作用效果,这与茶多酚杀菌作用使得伴放线放线杆菌细胞破裂,细胞质及细胞内离子等物质流出,从而影响菌体表面电位值有关联。

表3 不同处理下菌体表面电荷的变化
1.3.4 傅里叶近红外光谱测定菌体表面成分
参照Song等[32]采用的红外光谱技术测定细菌表面官能团的变化,具体方法为:益生菌和茶多酚最佳抑菌模型与伴放线放线杆菌菌悬液等比例混合,静置1h后弃去上清,得到的菌体沉淀用PBS(pH=7.2~7.4)重新溶解后用傅里叶近红外光谱仪测定。阳性对照为添加等量的益生菌或茶多酚,阴性对照为添加等量的PBS缓冲液。
由以上结果可知,益生菌抑制伴放线放线杆菌主要依靠共凝聚作用。通过傅里叶红外光谱测定可知(图6),益生菌在2855cm-1处观察到的峰值属于-CH2-官能团,-CH3官能团在2920cm-1处产生峰值。众所周知,表面能为24 mJ m-2的-CH3基团和表面能为31 mJ m-2的-CH2-基团都具有较低的表面能,这在疏水性聚合物中非常丰富。伴放线放线杆菌表面也同时具有-CH2-和-CH3官能团。因此具有相似低表面能基团的益生菌和伴放线放线杆菌会发生共凝聚,二者共凝聚后未测出-CH2-和-CH3基团,说明含有低表面能基团的位点由于物质共凝聚被遮挡,红外光谱只能检测表面官能团,难以准确测定物质内部基团。而茶多酚和伴放线放线杆菌共凝聚后依然能检测出-CH2-和-CH3基团,说明二者共凝聚不是由于低表面能官能团,而是静电吸附作用。
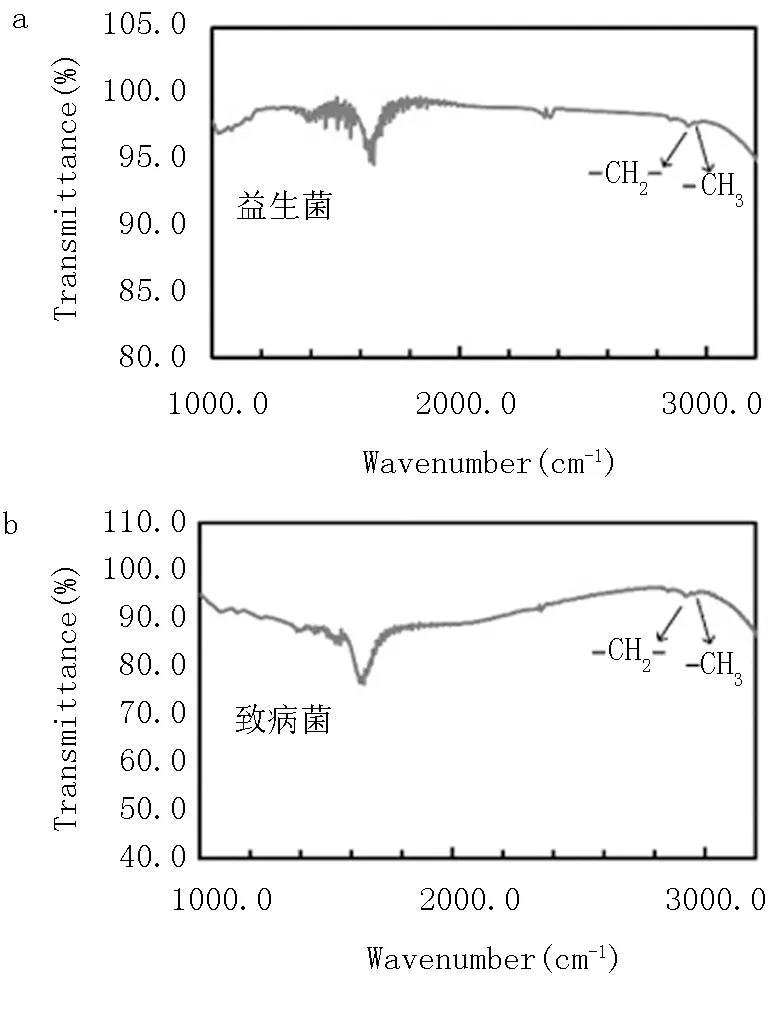
a,益生菌;b,致病菌;c,益生菌和致病菌共凝聚;d,茶多酚和致病菌共凝聚。
1.3.5 细菌表面粗糙度测定
细菌表面粗糙度与细菌粘附力大小有关。除了表面成分,本研究进一步从表面结构上分析了共凝聚机理。配置浓度为0.02g/mL益生菌溶液,参考Sandin等和韦蕾[33,34]所用的方法测定细菌表面粗糙度。具体方法为:将益生菌溶液与伴放线放线杆菌(109CFU/mL)菌液分别用2.5%戊二醛固定30min,随后取5μL滴在云母片上,自然晾干后用原子力显微镜测定两株细菌表面粗糙度。
图7a和c是致病菌的2D原子力显微镜光学图片和3D粗糙度轮廓图。致病菌表面的平均面粗糙度Ra=11.5 nm;图7b和d是益生菌的2D原子力显微镜光学图片和3D粗糙度轮廓图。益生菌表面的平均面粗糙度Ra=19.5nm。益生菌比伴放线放线杆菌菌体表面更为粗糙,结果表明益生菌粘附作用更强,在口腔内能与致病菌竞争粘附位点,减少致病菌的粘附。
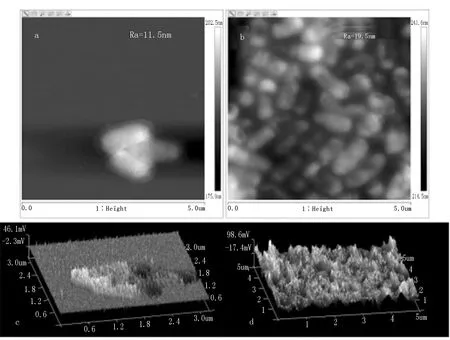
(a, 致病菌;b,益生菌)和3D粗糙度轮廓图(c, 致病菌;d,益生菌)。
因此综合上述分析,益生菌和茶多酚的协同抑菌机理如图8所示,共有的疏水基团导致益生菌和致病菌发生共凝聚,将致病菌从牙面上带走,同时天然抑菌物质茶多酚也能够辅助杀死致病菌,与益生菌起到协同抑菌的增强叠加效应。

图8 益生菌和茶多酚的协同抑菌机理示意图
1.4 益生菌与茶多酚复配抑菌模型在牙膏中抑菌作用评价
1.4.1 试验方法
为了评价益生菌与茶多酚在牙膏中对致病菌的抑菌效果,将益生菌与茶多酚按照最佳配比加入牙膏中。除了伴放线放线杆菌 ATCC 29523,同时选取变异链球菌CGMCC 12499和具核梭杆菌ATCC 25586,两株菌均由江苏大学食品学院提供,将两株菌接种于血平板上,置入含有80%N2、10%H2、10%CO2的厌氧袋中37℃培养48h,调节菌体浓度为109CFU/mL。采用高鹰等[18]的方法稀释牙膏样品,具体方法为:称取0.5g牙膏溶于1mL PBS(pH=7.2~7.4)溶液中,充分振荡溶解,去除溶液中气泡。之后分别与三株致病菌菌悬液按照1∶1比例混合,静置培养1h后轻轻吸取上清进行涂布计数,阳性对照为添加等量的益生菌或茶多酚牙膏,阴性对照为未添加益生菌和茶多酚的牙膏。通过检测致病菌降低量来评价益生菌与茶多酚复配抑菌模型在牙膏中的抑菌效果,试验重复三次。
1.4.2 试验结果
表4为益生菌、茶多酚单独添加以及益生菌和茶多酚复配抑菌模型在牙膏中对口腔常见三种致病菌的作用结果。牙膏中添加益生菌或者茶多酚后,其抑制作用均有不同程度的增强(表4),并具显著性差异。将益生菌与茶多酚复配抑菌模型运用在牙膏中,与单独添加益生菌或茶多酚的牙膏相比,能够进一步提升致病菌的降低量。从而更有效地发挥抑制口腔常见牙周炎等致病菌的功效作用。
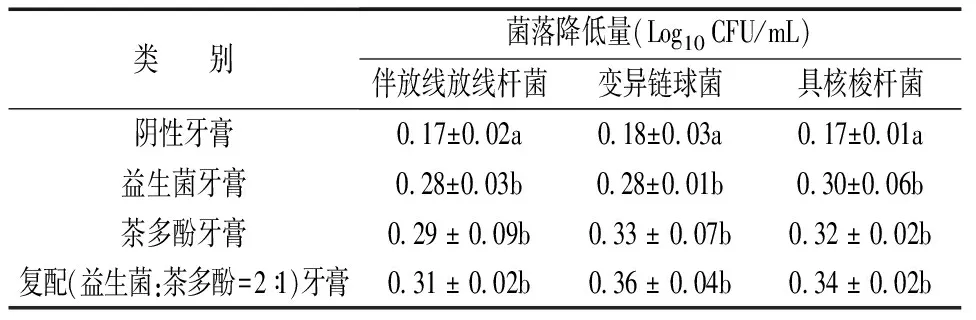
表4 不同物质在牙膏中对伴放线放线杆菌的抑制作用
2 讨论与结论
2.1 口腔致病菌会引发牙周炎等多种疾病,在牙膏等产品中添加益生菌用于预防口腔疾病受到越来越多的关注[35]。本研究选用的副干酪乳杆菌能与伴放线放线杆菌产生共凝聚作用,减少致病菌在口腔中的定殖。当与茶多酚协同作用时,不仅能够与致病菌产生共凝聚作用,还能够起到杀灭致病菌的作用。
2.2 本研究通过运用多种材料学和生物化学手段,可量化地观测益生菌和致病菌的表面形态、化学组分和表面粗糙度,多维度分究并阐明了益生菌与茶多酚对伴放线放线杆菌的抑菌机理:通过SEM形貌观测结果和菌体表面zeta电位绝对值的下降,表明益生菌对伴放线放线杆菌主要为共凝聚作用;傅里叶近红外光谱结果更进一步说明了益生菌与致病菌表面同时具有-CH2-和-CH3低表面能官能团,具有相似低表面能基团的益生菌和致病菌会发生共凝聚;益生菌表面粗糙度为Ra=19.5nm,比致病菌表面更粗糙,因此益生菌粘附作用更强,在口腔内能与致病菌竞争粘附位点从而减少致病菌数量。添加茶多酚后,菌体表面变得凹凸不平,有部分菌体破裂,细胞内物质流出,破坏了细菌细胞完整性,其杀菌作用能提高益生菌对伴放线放线的抑菌作用。研究建立的益生菌和茶多酚复配抑菌模型,通过共凝聚和杀菌双重协同作用,对伴放线放线杆菌生物膜量的抑制率可上升至71.7%,明显高于单独益生菌或茶多酚的抑制率。
2.3 将建立的益生菌与茶多酚复配抑菌模型运用在牙膏中,同时与单独添加益生菌或茶多酚的牙膏比对,益生菌与茶多酚复配抑菌模型对口腔常见的三株致病菌(伴放线放线杆菌、变异链球菌和具核梭杆菌)的抑菌作用增强。由此可见,益生菌协同茶多酚具有显著的口腔益生特性。为日后进一步探究益生菌等天然微生态抑菌成分在口腔清洁护理用品中对口腔致病菌的抑菌作用机理,提供了可靠的方法依据与研究思路。
