高效液相色谱法测定天然本草牙膏中绿原酸含量
2022-08-22陈杰锋
陈杰锋 高 艳
(无限极(中国)有限公司,广东 广州 510000)
金银花为忍冬科植物,是一种常用的清热去火中草药,具有清热解毒、疏散风热的功效,多用于虚火上升、痈肿疔疮、温病发热、热毒血痢、风热感冒等治疗[1]。中草药牙膏是我国口腔清洁护理用品行业的特色,牙龈炎、牙周炎、牙龈出血等炎症而多为“上火”引起,在牙膏中添加金银花,作为日常护理用品,可以辅助起到清热去火、消炎等作用。现代药理研究表明金银花提取物的主要成分是绿原酸,监测牙膏中绿原酸含量,可以间接反应金银花中草药在牙膏中的含量以及稳定性。因此,研究了牙膏中绿原酸含量的测定方法,用于检测牙膏中绿原酸含量。
1 实验和方法
1.1 仪器与材料
1)Agilent 1200Series高效液相色谱仪系统(G1329A ALS,G1311A Quat Pump,G1322A Degasser,G1316A TCC,G1315D DAD);
2)梅特勒-托利多XSE205型电子天平(感量0.01mg);
3)梅特勒-托利多ML204T型电子天平(感量0.1mg);
4)昆山市超声仪器有限公司KQ-400DE型数控超声波清洗器;
5)Thermo Fisher Sorvall ST 16R离心机;
6)IKA MS3涡旋振荡器;
7)绿原酸标准品(中国食品药品检定研究所,含量以96.1%计);
8)植雅牙膏(规格:140克/支,无限极(中国)有限公司生产);
9)乙腈(色谱纯,默克股份两合公司);
10)甲醇(色谱纯,默克股份两合公司);
11)磷酸(优级纯,天津市科密欧化学试剂有限公司);
12)石英砂(分析纯,广州化学试剂厂);
13)超纯去离子水。
1.2色谱条件
1)色谱柱:Waters Xbridge C18(250mm×4.6mm,5μm);
2)流动相:A相(乙腈),B相(0.1%磷酸溶液),梯度洗脱,见表1;
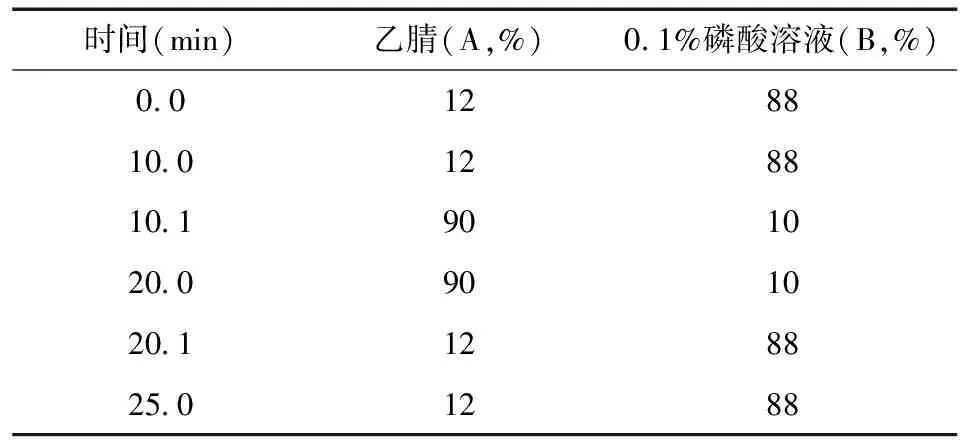
表1 流动相梯度洗脱表
3)流量:1.0 mL/min;
4)柱温:30℃;
5)进样量:20μL;
6)检测波长:327nm。
1.3 标准品溶液的制备
绿原酸标准储备溶液(1):精密称取绿原酸标准品10mg(精确至0.01mg)至50mL容量瓶中,用50%甲醇水溶液溶解并定容至刻度,摇匀,配制成200μg/mL标准储备溶液(1)。
绿原酸标准储备溶液(2):准确吸取5mL浓度为200μg/mL的绿原酸标准储备溶液(1),于100mL容量瓶中,用50%甲醇水溶液定容至刻度,摇匀,配制成10μg/mL标准储备溶液(2)。
1.4 供试品溶液的制备
称取试样1g(精确至0.1mg)于50mL具塞刻度离心管中,加入约1g石英砂,再准确加入甲醇-磷酸混合溶液(甲醇+磷酸+水=50+2+48,体积比)20mL,称定质量,涡旋振荡2min,35℃水浴中超声提取30min,冷却至室温后用甲醇-磷酸混合溶液补足损失质量,5000r/min离心分离10min,取上清液经0.22μm微孔滤膜过滤,滤液作为试样溶液上机待测。
1.5 测定和计算
按上述条件测定标准工作溶液和待测溶液,根据色谱峰的保留时间和紫外光谱图定性,根据标准工作溶液浓度和色谱峰面积回归直线方程定量,按公式(1)计算样品中绿原酸的含量。
(1)
式中:X——试样中绿原酸的含量,mg/kg;
C——从标准曲线中得出的绿原酸浓度,μg/mL;
V——试样溶液的体积,mL;
m——试样质量,g。
2 结果与讨论
2.1 前处理条件的确定
2.1.1 提取溶剂的选择
根据绿原酸的结构以及理化性质,对提取溶剂和提取方法进行考察,筛选合理的提取方法。考虑到牙膏试样在水中分散效果较好,本方法采用有机溶剂-水体系作为提取溶剂。考察了不同比例的甲醇水溶液和乙醇水溶液(30%,50%,70%,90%,100%)对含有绿原酸的牙膏试样的提取效果,结果见图1。使用甲醇水溶液作为溶剂时,甲醇比例从30%增大到50%,测得试样中绿原酸含量逐渐增多,在50%时,测得含量最大值,继续增大甲醇比例,测得绿原酸含量逐渐减少。使用乙醇水作为溶剂时,乙醇比例在30%时,测得含量最大值,继续增大乙醇比例,测得绿原酸含量逐渐减少。综合两个溶剂体系对绿原酸的提取情况,使用50%甲醇水溶液测得的绿原酸含量最高。同时,考虑到牙膏一般具有较好的水分散性,提取溶剂中有机溶剂的比例越高,牙膏在提取溶剂中的分散效果越差。因此选择50%甲醇-水溶液作为绿原酸的提取溶剂。另外,为了提高牙膏在提取溶剂中的分散效果,本次实验选择加入适量石英砂对牙膏试样进行辅助分散。
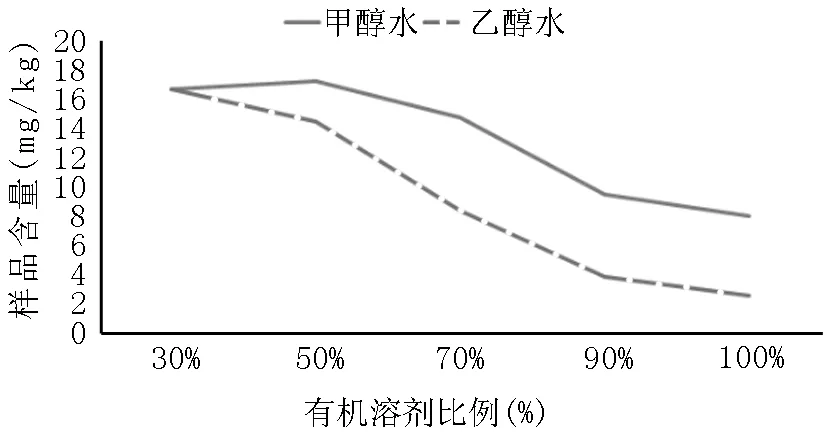
图1 不同比例有机溶剂水溶液的提取效果对比
2.1.2 提取溶剂中磷酸浓度的选择
在提取溶剂中添加一定浓度的磷酸可使碳酸钙基质牙膏溶解更充分,提高绿原酸的提取效率。本次实验考察了在提取溶剂中添加不同浓度的磷酸(0%,0.5%,1%,2%,4%,6%)(体积分数)对含有绿原酸的牙膏试样的提取效果,结果见图2。随提取溶剂中磷酸浓度逐渐增大,测得试样中绿原酸含量逐渐增多,磷酸浓度在2%时,测得含量最大值,继续增大磷酸浓度,测得绿原酸含量有所下降。因此选择在提取溶剂添加磷酸的浓度为2%,即甲醇-磷酸-水溶液(50+2+48)(体积比)作为绿原酸的提取溶剂。
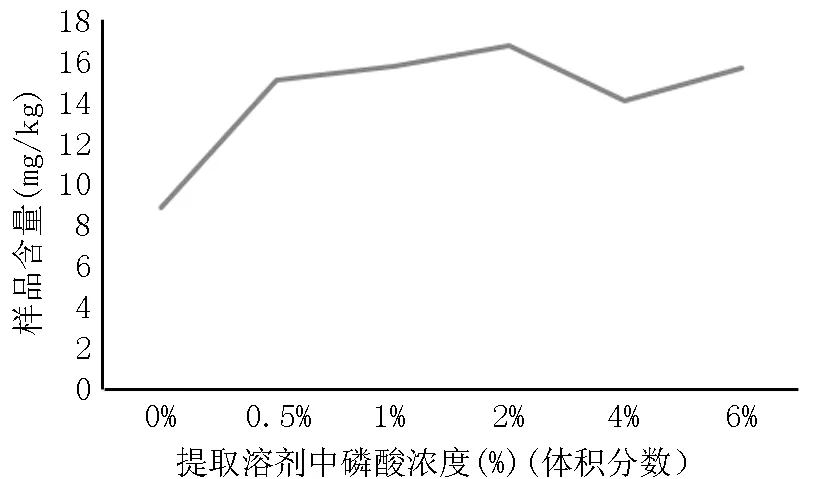
图2 提取溶剂中不同磷酸浓度的提取效果对比
2.2 仪器色谱条件的确定
2.2.1 检测波长的选择
通过使用二极管阵列检测器(DAD)对绿原酸标准品溶液在190~400nm波长范围内进行扫描,结果显示(见图3),绿原酸在紫外光327nm波长处有最大特征吸收,故本方法选择327nm作为检测波长。

图3 绿原酸标准溶液的紫外吸收光谱图
2.2.2 色谱柱的选择
本实验考察了Waters Xbridge C18、Agilent Eclipse Plus C18、Kromasil C18和 Acclaim 120 C18等不同型号相同规格(250mm×4.6mm,5μm)的C18色谱柱对绿原酸和试样基质的分离效果。结果显示,在优化的流动相条件下各种C18色谱柱能实现绿原酸和试样基质的有效分离,尤其使用Waters Xbridge C18(250mm×4.6 mm,5μm)色谱柱时,峰形尖锐对称。综合考虑,最终选择使用C18色谱柱作为分离色谱柱。
2.2.3 流动相中磷酸浓度的选择
绿原酸为含有羟基和邻二酚羟基的强极性有机酸[2],溶于水后会出现部分解离,容易产生主峰拖尾现象,在流动相中加入一定比例的酸,能抑制酸解离,有助于提高主峰与干扰峰的分离度,改善峰形[3,4]。本实验考察了乙腈-0.1%磷酸溶液、乙腈-0.2%磷酸溶液、乙腈-0.4%磷酸溶液3种流动相体系对绿原酸和试样基质的分离效果。结果显示,三种磷酸浓度的流动相体系采用梯度洗脱均能够实现绿原酸和试样基质的良好分离,考虑到流动相的酸性较大可能会对色谱柱的性能和使用寿命造成一定影响。因此,本方法采用乙腈-0.1%磷酸为流动相。
2.3 线性范围与检出限
分别精密量取1.3步骤中绿原酸标准储备溶液(2)0.3mL、0.5mL、1.0mL、2.0ml、5.0mL置于10mL容量瓶中,用50%甲醇水溶液稀释至刻度,配制成浓度为0.3μg/mL、0.5μg/mL、1.0μg/mL、2.0μg/mL、5.0μg/mL标准工作溶液系列,依前述色谱条件进行测定。记录色谱峰峰面积,以标准工作溶液浓度(μg/mL)为横坐标,峰面积为纵坐标,进行线性回归,得出绿原酸的回归方程为:
y=36.11088x-0.51537
R2=0.9999
由以上回归方程可知绿原酸在0.3μg/mL~5.0μg/mL之间呈良好线性关系。
取牙膏试样按1.4步骤制备待测溶液,通过将该测试溶液逐级稀释并上机测试,测定目标物的信噪比(S/N),将所得信噪比大于3时对应的稀释后浓度作为方法的检出浓度。结果显示,本方法的检出浓度为0.026μg/mL。当试样称样量为1g,溶液定容体积为20mL时,方法检出限为0.52mg/kg(此检出限为采用安捷伦品牌二极管阵列检测器测试所得,如采用其他品牌二极管阵列检测器开展测试,应重新确定检出限,以实际测试值为准)。
2.4 方法特异性
本实验分别考察了3种基质牙膏(二氧化硅基质、碳酸钙基质和磷酸氢钙基质)阴性样品和添加绿原酸标准品后的色谱图。结果如图4~9所示,表明三种基质中存在的物质对本方法目标检测物质没有干扰。
图4 二氧化硅基质(阴性样品)牙膏溶液谱图
2.5 重复性试验
分别平行称取三种不同基质牙膏试样6份,依照1.4步骤制备的供试品溶液,依前述色谱条件进样测定绿原酸含量,结果见表2。6次进样测得三种不同基质牙膏中绿原酸含量平均值分别为16.6mg/kg、16.2mg/kg、10.6mg/kg,RSD分别为1.6%、1.1%、2.4%。结果表明,该方法重复性良好。
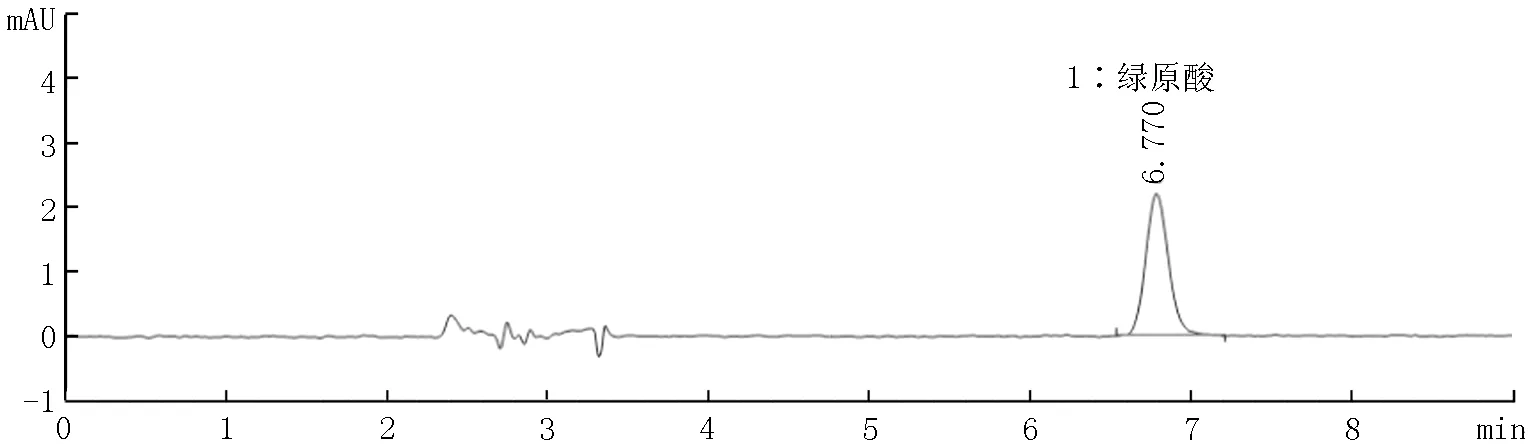
图5 二氧化硅基质(阴性样品)牙膏加标溶液谱图
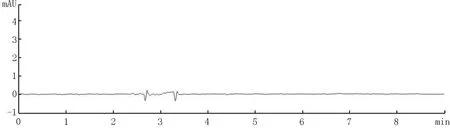
图6 碳酸钙基质(阴性样品)牙膏溶液谱图
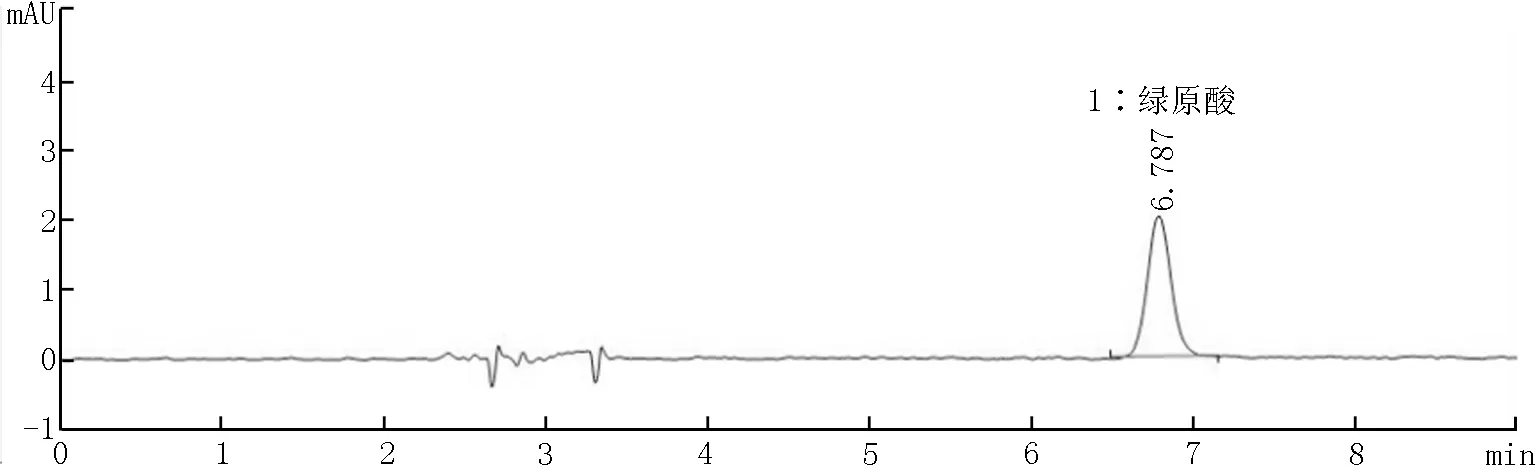
图7 碳酸钙基质(阴性样品)牙膏加标溶液谱图
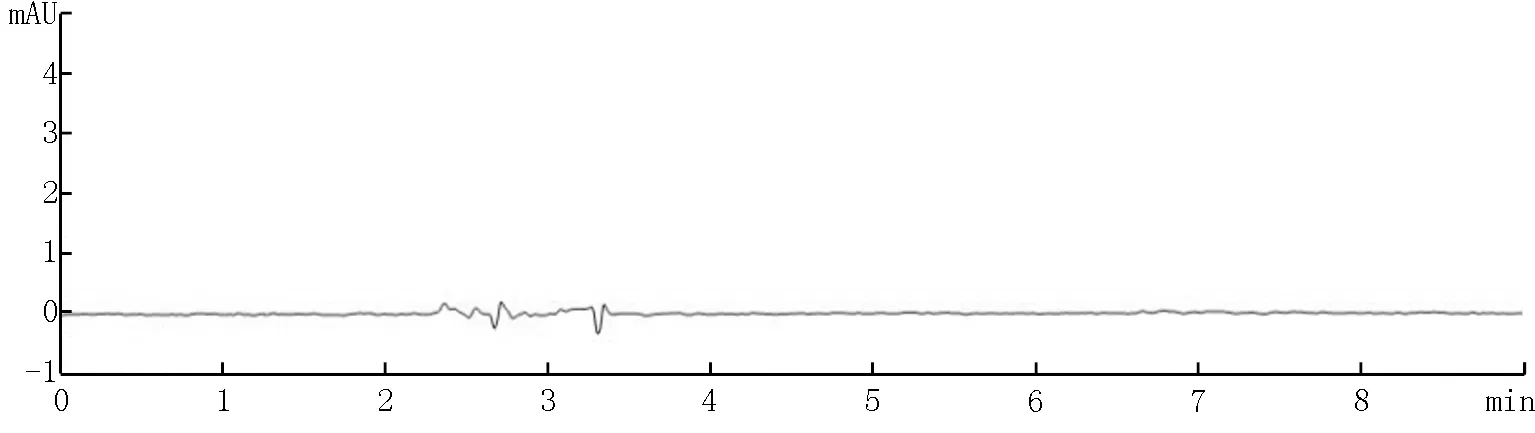
图8 磷酸氢钙基质(阴性样品)牙膏溶液谱图
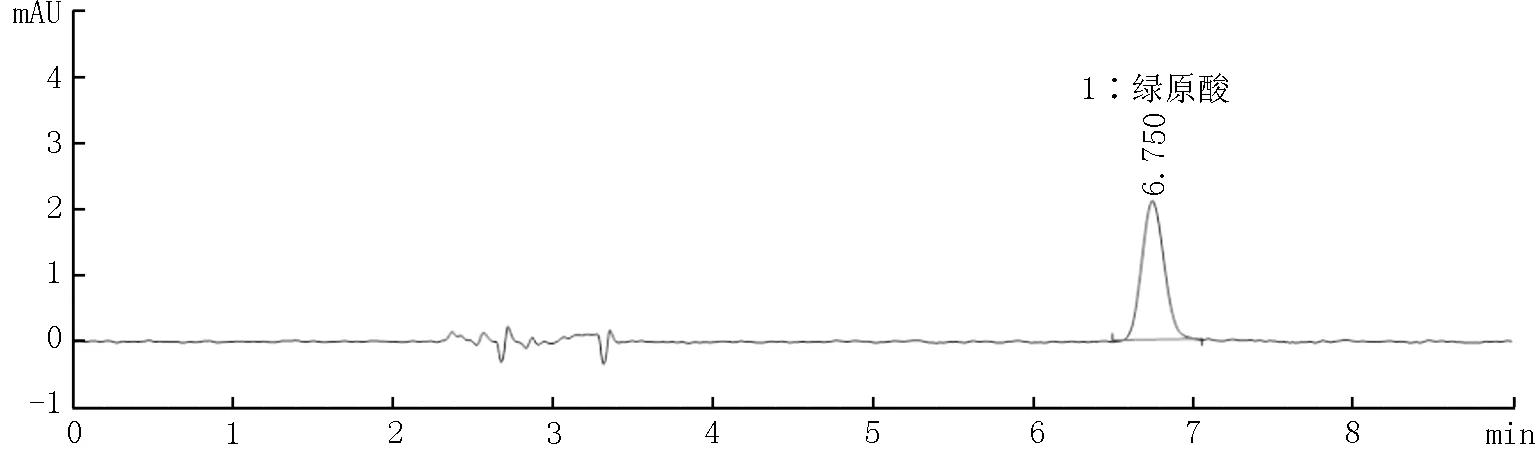
图9 磷酸氢钙基质(阴性样品)牙膏加标溶液谱图
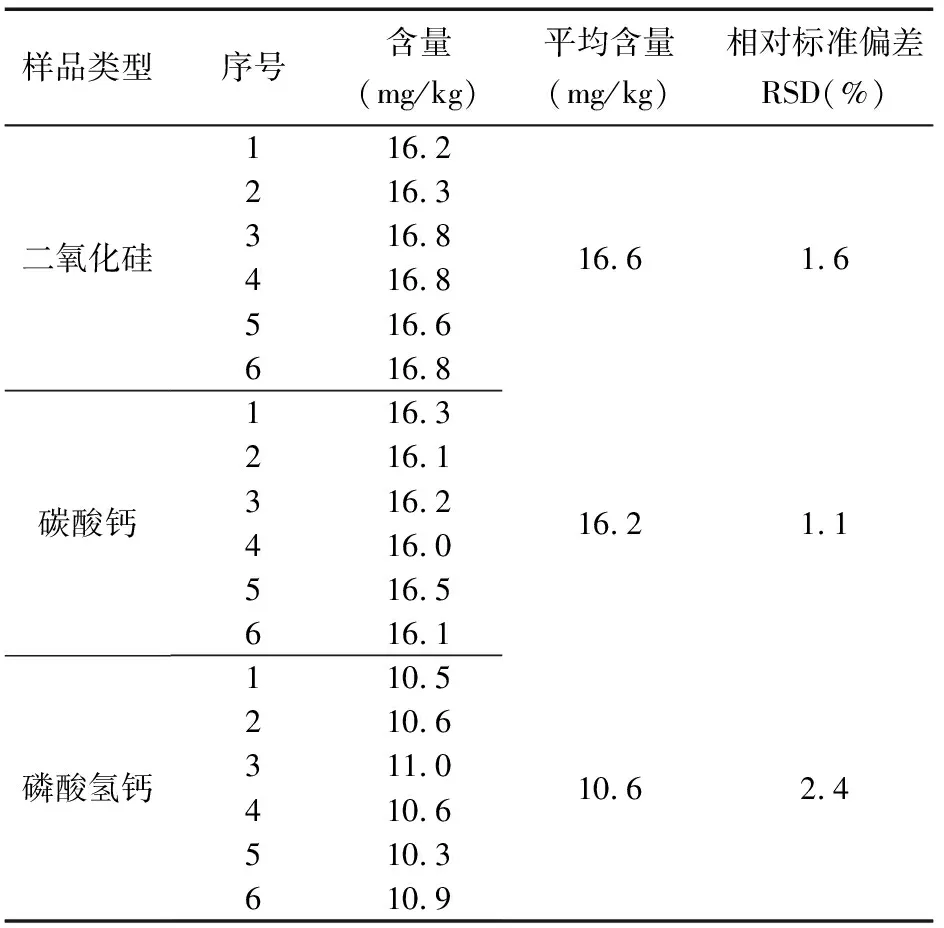
表2 试样重复性测定结果
2.6 中间精密度试验
由不同操作人员A、B,分别对同一批次牙膏试样平行称取试样6份,依照1.4步骤制备供试品溶液,依前述色谱条件进样测定绿原酸含量,结果见表3。测得牙膏试样中绿原酸含量的平均值分别为16.2mg/kg和16.3mg/kg,RSD为1.0%。结果表明,该方法中间精密度良好。
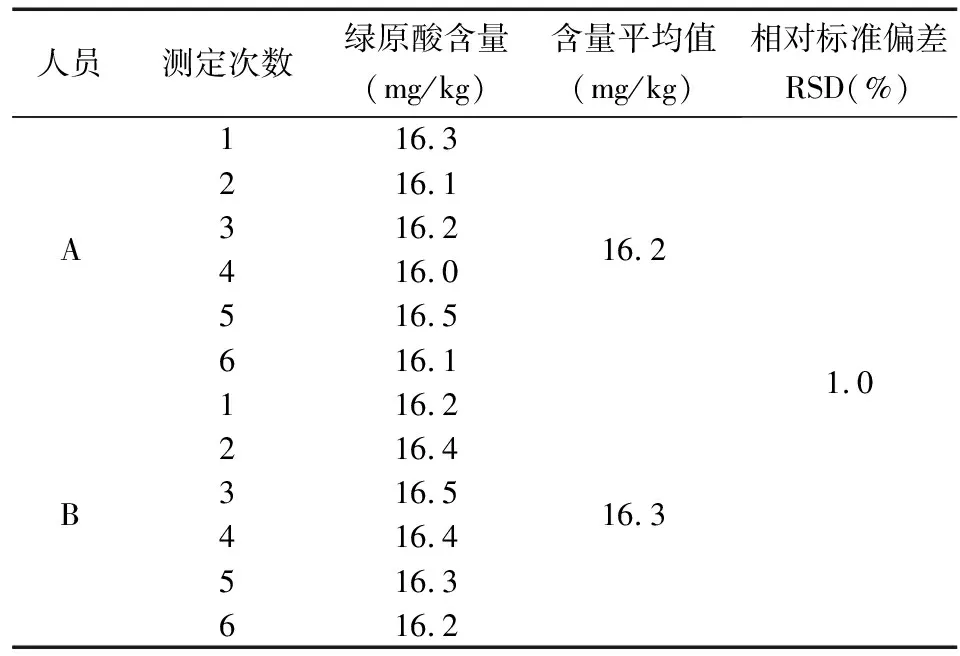
表3 绿原酸含量测定的中间精密度实验数据
2.7 准确度(回收率)试验
分别平行称取3种基质(二氧化硅、碳酸钙、磷酸氢钙)牙膏试样(阳性样品)各9份,每份约0.5g(称样量减半),共3组,分别定量加入绿原酸标准溶液,添加浓度水平为试样本底含量的50%、100%、150%,按1.4步骤处理后进行上机测定,结果见表4~6。从表中可看出,三种基质牙膏试样在不同浓度下的平均加标回收率为95.8%~101.7%,相对标准偏差为0.7%~2.3%。结果表明,本方法准确可靠,精密度高。
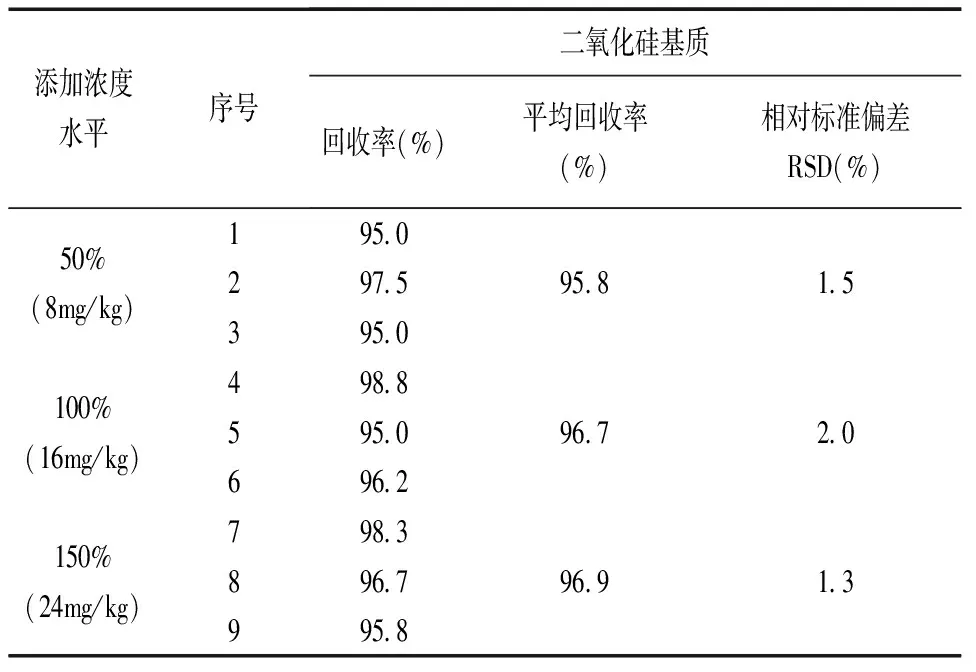
表4 二氧化硅基质牙膏试样加标回收率测定结果
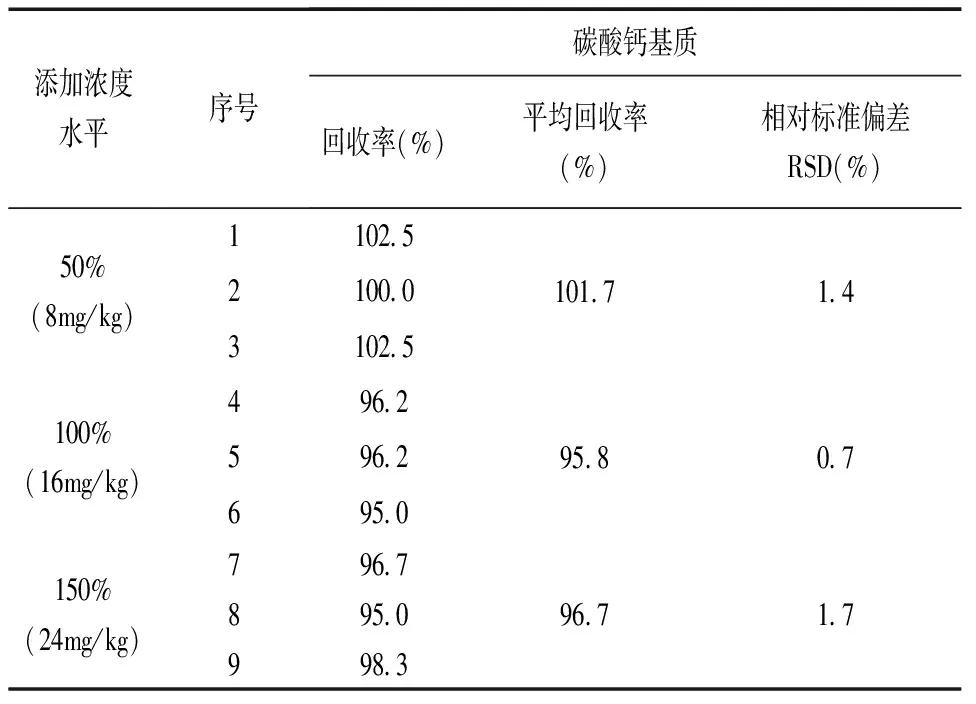
表5 碳酸钙基质牙膏试样加标回收率测定结果
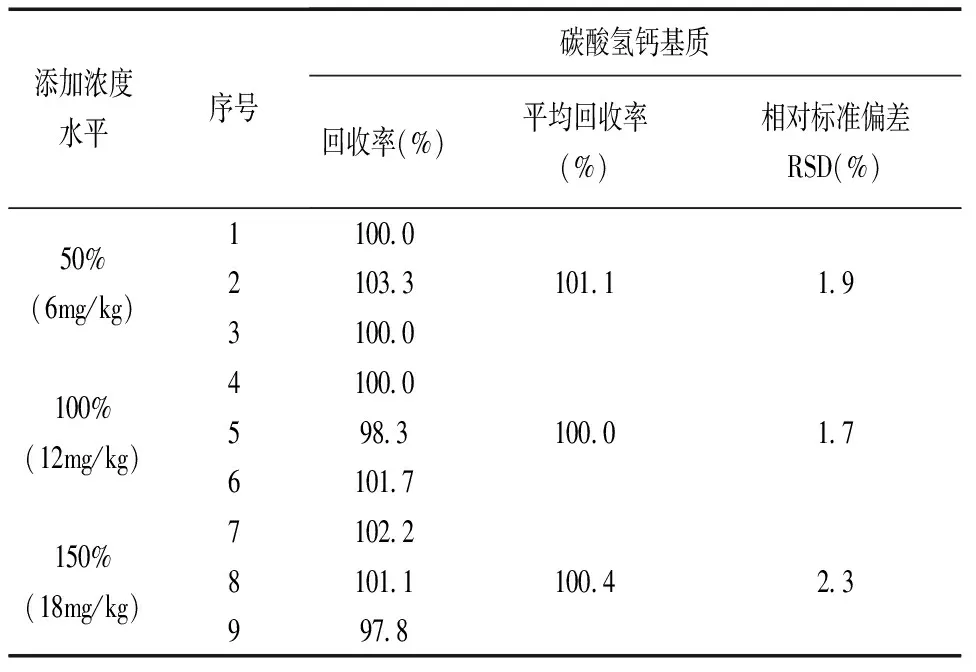
表6 磷酸氢钙基质牙膏试样加标回收率测定结果
2.8 稳定性试验
取牙膏试样按1.4步骤制备供试品溶液,依前述的色谱条件在0h、6h、12h、18h、24h分别进样,测定绿原酸含量,结果见表7。牙膏试样中绿原酸含量平均值为16.1mg/kg,RSD为1.0%,结果表明,在24小时内供试品溶液稳定性良好。
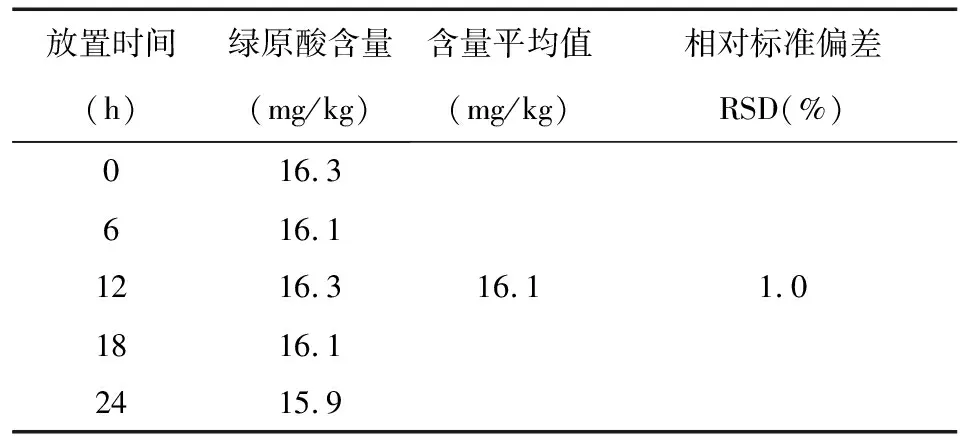
表7 放置时间对绿原酸测试结果的影响
2.9 样品测试
分别取6个不同批次牙膏试样,依照1.4步骤制备供试品溶液,上机进样测定绿原酸含量,结果分别见表8。
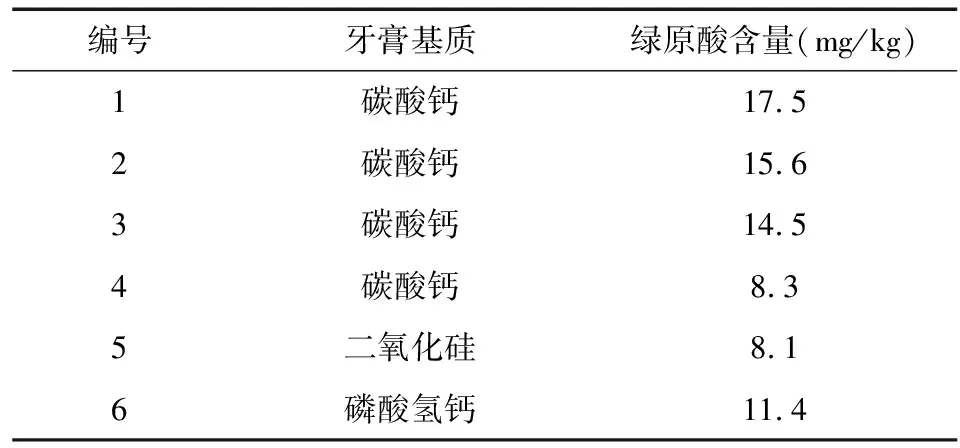
表8 牙膏试样中绿原酸含量测定结果
3 讨论
本研究根据绿原酸的结构及理化性质,对提取溶剂和提取方法进行了系统考察,并结合牙膏试样在水中分散效果较好的特点,通过实验最终选择50%甲醇-水溶液作为提取溶剂。同时,通过实验证明,在提取溶剂中添加2%磷酸(体积分数)可使碳酸钙基质牙膏溶解更充分,有效提升绿原酸的提取效率。
经反复实验,最终确定使用Waters Xbridge C18(250mm×4.6mm,5μm)色谱柱;流动相为乙腈(A)-0.1%磷酸(B),梯度洗脱:0~10min(12%A),10~20min(90%A),20~25min(12%A);流速1.0mL/min;柱温:30℃;检测波长327nm;进样量:20μL。结果表明,此方法条件下绿原酸色谱峰形较理想,分离效果好,绿原酸质量浓度在0.3μg/mL~5.0μg/mL范围内与其峰面积呈良好的线性关系(R2= 0.9999),将该方法应用于牙膏试样的测定,其方法特异性、重复性、中间精密度、稳定性、准确度良好,添加3个浓度水平的平均加标回收率为95.8%~101.7%,RSD为0.7%~2.3%。
本实验针对不同基质的牙膏试样,利用高效液相色谱法(HPLC)建立了灵敏、准确、简便测定牙膏中绿原酸含量的检测方法,可作为天然本草牙膏中关键功效成分的质量控制方法,在中草药牙膏产品的安全质量和应用研究领域发挥作用。
