大豆内生细菌的分离及其作用效果研究
2022-08-22田振祥丁伟程茁戴航宇
田振祥,丁伟*,程茁,戴航宇
(1.东北农业大学农学院,哈尔滨 150030;2.东北农业大学资源与环境学院,哈尔滨 150030)
大豆作为中国重要的粮食作物,当前面临国内生产不足、依赖进口的严峻形势。化学肥料的大量施用会导致生态环境恶化。大豆中存在丰富的内生菌种群,具有多种生理生态学功能,如生物固氮、调节植物激素分泌、产生抑菌代谢物质等[1]。探索大豆内生菌作为环境友好型生物刺激素应用于农业生产,对大豆生产中减少化学肥料的使用具有重要意义。
当前从植物中分离和鉴定的内生细菌主要包括根瘤菌属(Rhizobium)、土壤杆菌属(Agrobacterium)、假 单 胞 菌 属(Pseudomonas)、葡 萄 球 菌 属(Staphylococcus)、芽孢杆菌属(Bacil l us)等[2]。大豆种子内生细菌研究开展较晚[3],目前国内外对大豆内生细菌的研究多是从根、茎或根瘤内进行分离和鉴定,具体作用表现为具有分泌细胞素酶、果胶酶、植物生长素(IAA)能力和对某些植物病原菌具有拮抗作用[4-5]。从大豆根部分离获得的赖氨酸芽孢杆菌与微杆菌能分泌大量的IAA内生细菌,对大豆的生长具有显著促进作用[6]。衡楠楠等[7]把大豆根瘤中分离获得的内生菌株SCAUS8接种到大豆植株上,对大豆生长和产量均有显著促进作用。王玉霞等[8]从不同大豆品种的根、茎、叶中分离获得芽孢杆菌,其对尖孢镰孢菌、菌核病菌等病原菌具有良好生物防治效果。种子中也存在丰富的内生菌,并具有合成植物激素、溶磷、固氮和抗逆等功能[9]。从水稻和田菁种子中分离得到柠檬色短小杆菌K12G2和BacillusSC60,该菌株具有产IAA、溶解无机磷、固氮及提高淀粉酶活性的促生特性,对种子萌发与幼苗生长具有促进作用[10-11]。如今生物刺激素在农业领域的研究与应用发展迅速[12],已有多项研究表明,应用植物促生细菌作为生物刺激素具有促进植株生长和提高产量的作用[13-14]。大豆体内具有丰富的内生细菌,并具有多种生理生态学功能[15-17],但目前关于内生细菌的研究对象大多为禾本科植物和林木,关于大豆内生细菌的相关研究相对较少,因此发掘并应用大豆内生细菌作为环境友好型生物刺激素,对减少化学肥料使用、促进大豆生长发育、提高大豆抗逆能力和产量等具有重要的理论和实践意义。
1 材料与方法
1.1 供试材料
1.1.1 供试种子 转基因抗草甘膦大豆呼交06-698及其受体蒙豆12由中国农业科学院作物科学研究所提供,转基因抗旱大豆T-DREB3-1及其受体东农50由东北农业大学大豆生物学教育部重点实验室提供。
1.1.2 供试培养基 营养肉汤(NA)培养基:牛肉粉3 g、蛋白胨10 g、NaCl 5 g、蒸馏水1 000 mL,pH 7.0~7.4。
营养琼脂(NB)培养基:牛肉粉3 g、蛋白胨10 g、NaCl 5 g、琼脂18 g、蒸馏水1 000 mL,pH 7.2~7.4。
Pikovskava无机解磷固体培养基:葡萄糖10 g、(NH4)2SO40.5 g、NaCl 0.3 g、MgSO4·7H2O 0.3 g、MnSO4·7H2O 0.03 g、FeSO4·7H2O 0.3 g、Ca3(PO4)25 g、琼脂18 g、蒸馏水1 000 mL,pH 7.0~7.5。
1.2 大豆种子内生细菌的分离及纯化
每个大豆品种各取10粒,分别装入2层无纺布袋内,埋藏于20 cm深土层中,试验地点位于东北农业大学农学院北侧人烟稀少的树林内,在第3、第7天观察种子有无腐烂变质,若种子健康则放回深土层中,至第10天后取出种子,种子取出后用95%乙醇消毒1 min,0.5%升汞消毒2 min,70%乙醇消毒1 min,然后用无菌水清洗5~7次,用无菌滤纸吸干水分,用灭菌镊子分别取出大豆放入NB培养基内,每个培养皿放置5粒大豆种子。置于37℃恒温培养箱中进行暗培养,胚根伸出后每天观察种子和胚根周围菌落生长情况。另取无菌水100μL涂于培养基表面作为对照。从胚根周围出现菌落的培养皿中挑取单菌落至NB培养基划线纯化,纯化后单菌转到NB培养基斜面试管中保存。
1.3 促生细菌的初步筛选
挑选籽粒饱满的大豆种子,取200 mL所得内生菌悬液进行浸种4 h处理,使用不含内生菌的灭菌NA培养基作为对照。把浸种后的种子置于垫有滤纸的培养皿中,保持滤纸湿润,于25℃恒温培养箱中培养,3 d后测定发芽势,7 d后测定发芽率、芽长,每处理3次重复;另取上述2种方法处理的种子播种在装有灭菌土的小盆中,置于光照培养箱中培养,昼夜温度为25℃/20℃,光照时间12 h/12 h,分别于14、21 d测定大豆株高,每处理3次重复。从中筛选优势菌株进行16s rRNA鉴定和后续的作用效果研究。
宏波的画风恰恰兼容了海派与新浙派绘画的一些特质与精髓,既重视浙派花鸟画的写意精神与美学传统,又照顾到了海派艺术的色彩明丽与雅俗共赏,呈现出潇洒飘逸,古朴雄厚的绘画特色,将新浙派的风骨与海派的浓艳合二为一,因而其笔下的花鸟画作品无论是何种题材,均能体现出一种艳而不俗,清而不媚,秀而不寒,多而不乱,清丽超脱的可人姿致。
1.4 内生细菌的鉴定
按照细菌基因组提取试剂盒说明书(天根生化科技有限公司)提取大豆内生菌株DNA。采用引 物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGCTACCTTGTTACGACTT-3’)扩增16S rRNA序列,引物由北京六合华大基因科技有限公司合成。PCR扩增体系:模板1μL,引物各1μL,PCR Super Mix 15μL,加入双蒸水补足30μL。PCR扩增程序:96℃预变性5 min;96℃变性20 s,62℃退火20 s,72℃延伸1 min,循环35次;72℃延伸10 min,16℃保温。PCR产物利用1.0%的琼脂糖凝胶进行检测,观察条带性状。将纯化后的PCR产物交由北京六合华大基因科技有限公司进行测序,获得拼接序列后在NCBI数据库进行BLAST比对,选择相似度较高的菌株序列使用Mega 7.0软件以Neighbor-joining邻接法进行系统发育树的构建,确定菌株种属。
1.5 产IAA能力测定
取0.5 mol·L-1FeCl3溶液10 mL,加入500 mL 35%的HClO4溶液中,获得Salkowski比色液。将优势菌株接种到NA液体培养基中培养24 h(30℃、180 r·min-1)后,分别取100μL KC-1与MD12-2菌悬液接种至含200 mg·L-1色氨酸的NA培养基中培养48 h(30℃、180 r·min-1),每锥形瓶含100 mL培养液,设3次重复。将菌株培养液8 000 r·min-1离心1 min,取上清液与Salkowski比色液等量混合,使用未接菌NA培养基与Salkowski比色液混合作为阴性对照,使用IAA水溶液与Salkowski比色液混合作为阳性对照,室温下避光静置30 min,观察其变色情况。若3次重复均变红,表明该菌株具备产IAA能力[11]。
1.6 内生菌株溶磷能力测定
待无机解磷培养基凝固后,使用打孔器在培养基中间打孔,直径约为0.5 cm,取培养所得内生菌液50μL点入孔中[19],30℃下培养4~7 d后,若菌落周围出现清晰的透明圈,表明该菌株溶磷能力良好[11]。
1.7 大豆内生细菌促萌发效果测定
将菌株在NA培养基中接种后,于恒温摇床(37℃,180 r·min-1)培养24 h,在血球计数板中观察可知菌液含量约为10×107cfu·mL-1,稀释菌液至1倍、2倍、4倍,即调整菌液含量为高(10.0×107cfu·mL-1)、中(5.0×107cfu·mL-1)、低(2.5×107cfu·mL-1)。选择饱满、大小均一的呼交06-698和蒙豆12大豆种子,表面消毒后分别取200 ml高、中、低3种含量的KC-1与MD12-2菌悬液进行浸种处理4 h,使用灭菌NA培养基(0.0 cfu·mL-1)作为对照,每处理20粒种子,设3次重复。将处理后的种子置于垫有滤纸的培养皿中,保持湿润,于恒温培养箱25℃进行培养。每天观察并记录种子发芽情况。3 d后测定发芽势、7 d后测定发芽率,并按以下公式计算内生菌对种子萌发和幼苗的影响[20]。第7天采用3,5-二硝基水杨酸(DNS)法[21]测定大豆种子萌发过程中α-淀粉酶含量。

式中,Gt指在时间t日内发芽数,Dt指相应发芽天数。

1.8 大豆内生细菌的作用效果
在东北农业大学盆栽场内,选用直径30 cm,高40 cm的花盆,每盆装草炭混合营养土3 kg,供试呼交06-698和蒙豆12大豆种子表面消毒后,分别用高(10.0×107cfu·mL-1)、中(5.0×107cfu·mL-1)、低(2.5×107cfu·mL-1)、灭菌NA培养基(0.0 cfu·mL-1)4种处理的菌悬液浸种4 h,将处理后的种子每盆播种3粒,播深3 cm,每处理5次重复。
1.8.1 内生细菌促生长效果测定 在大豆生长苗期、初花期、结荚期,随机选取植株对大豆株高、地上部干重、地下部干重、根瘤鲜重、根瘤干重和根瘤数进行调查。
1.8.2 大豆叶绿素含量和硝酸还原酶活性测定在大豆苗期、初花期、结荚期,各处理随机挑选植株,选取新近完全展开的复叶,参照张宪政等[22]方法测定叶绿素含量和硝酸还原酶活性测定。
1.8.3 大豆根系活力测定 在大豆苗期、初花期、结荚期,每个处理随机选取大豆根系,采用氯化三苯基四氮唑(TTC)法[23]测定大豆根系活力。
1.8.4 大豆根瘤固氮酶活性测定 在大豆苗期、初花期、结荚期,每个处理随机选取大豆根系,参考ZabLotowicz等[24]和Ding等[25]的方法并改进,测定各处理大豆根瘤固氮酶活性。
1.9 数据处理
使用Excel 2013进行原始数据整理,应用DPS 7.05软件分析处理间的差异显著性。
2 结果与分析
2.1 大豆内生细菌的分离与优势菌株筛选
从4个大豆品种中共分离获得8株内生细菌,其中,转基因抗草甘膦大豆呼交06-698中分离获得2株,编号为KC-1、KC-2;蒙豆12中分离获得2株,编号为MD12-1、MD12-2;转基因抗旱大豆T-DREB3-1中分离获得1株,编号为KH-1;东农50中分离获得3株,编号为DN50-1、DN50-2、DN50-3。分离所得内生细菌菌液浸种处理后,与其他处理相比,KC-1与MD12-2菌液处理效果最好,大豆种子发芽势、芽长与株高均显著增加(P<0.05)(表1),选择菌株KC-1与MD12-2进行鉴定及后续效果试验。
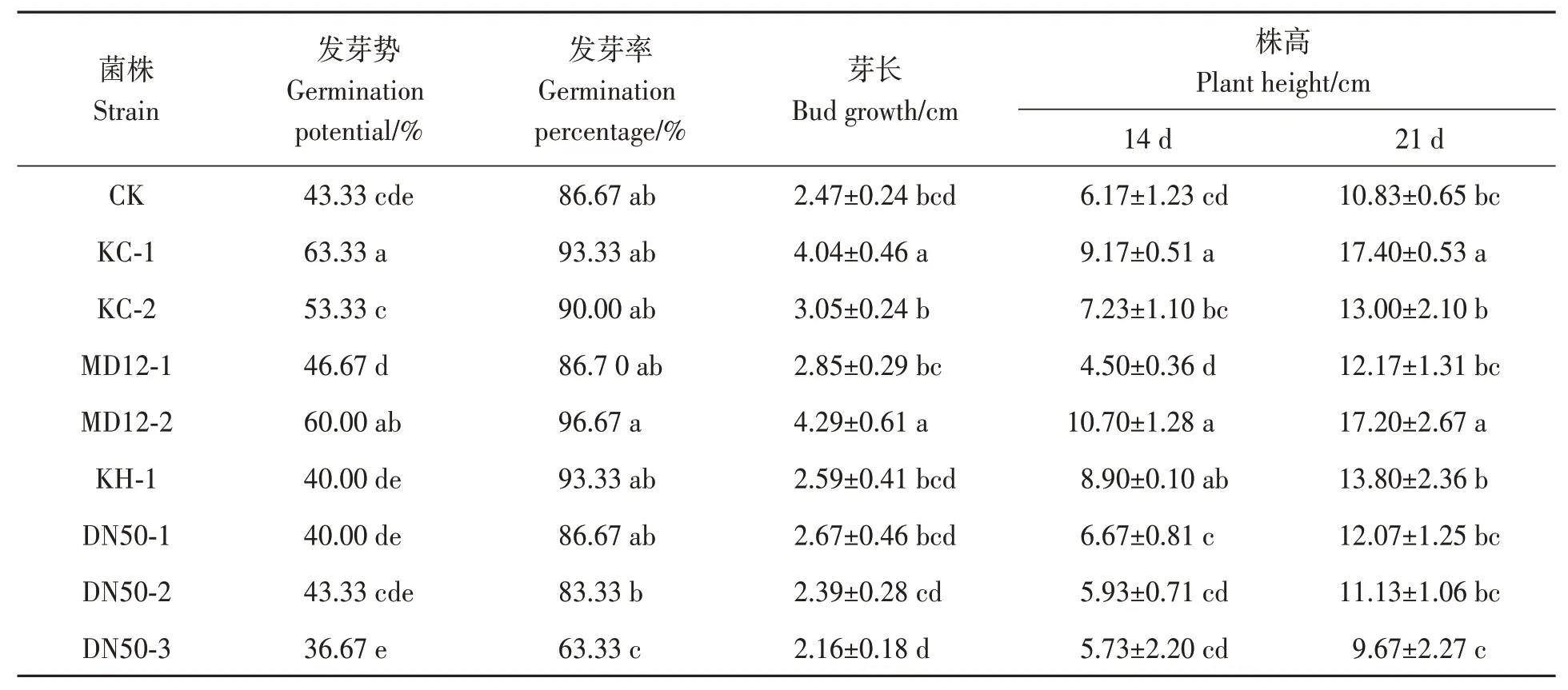
表1 不同内生细菌浸种后大豆萌发性状Table 1 Effect of different endophytic bacterial dips on germination and growth of soybean
2.2 优势内生细菌的16S rRNA分析
对KC-1和MD12-2菌株DNA进行PCR扩增,琼脂糖凝胶电泳检测可见条带清晰明亮,提取的DNA具有较高浓度与纯度,可进行下一步试验。通过16S rRNA序列比对,从结果中选取序列相似度高具有代表性的菌株,使用Neighbor-joining邻接法构建系统发育树(图1、图2)。Blast比对结果显示,KC-1与Brevibacill us laterosporusDSM 25相似性高达100%,MD12-2与Bacillus subti l isstrain soil G2B相似性高达100%,一般情况下,16S rRNA序列之间存在97%以上相似性的原核生物被认为属于同种[26],因此KC-1属于Brevib acil l us laterospor us,MD12-2属于Bacillus s ubtilis。
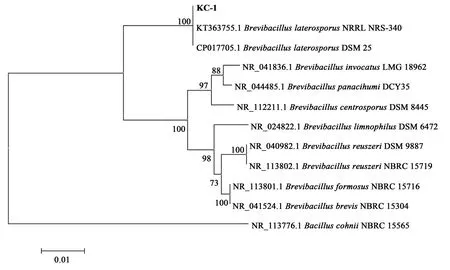
图1 菌株KC-1的16S rRNA系统发育进化树Fig.1 Phylogenetic tree based on 16S rRNA of strain KC-1
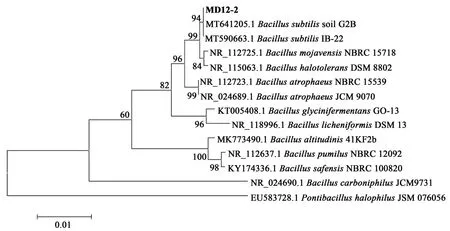
图2 菌株MD12-2的16S rRNA系统发育进化树Fig.2 Phylogenetic tree based on 16S rRNA of strain MD12-2
2.3 菌株产IAA能力
在含色氨酸的培养基中接种菌株KC-1与MD12-2,与比色液混合后,与阴性对照比对,呈现红色,与阴性对照有明显的差异(图3),说明菌株KC-1与MD12-2具有产生IAA的能力[27]。
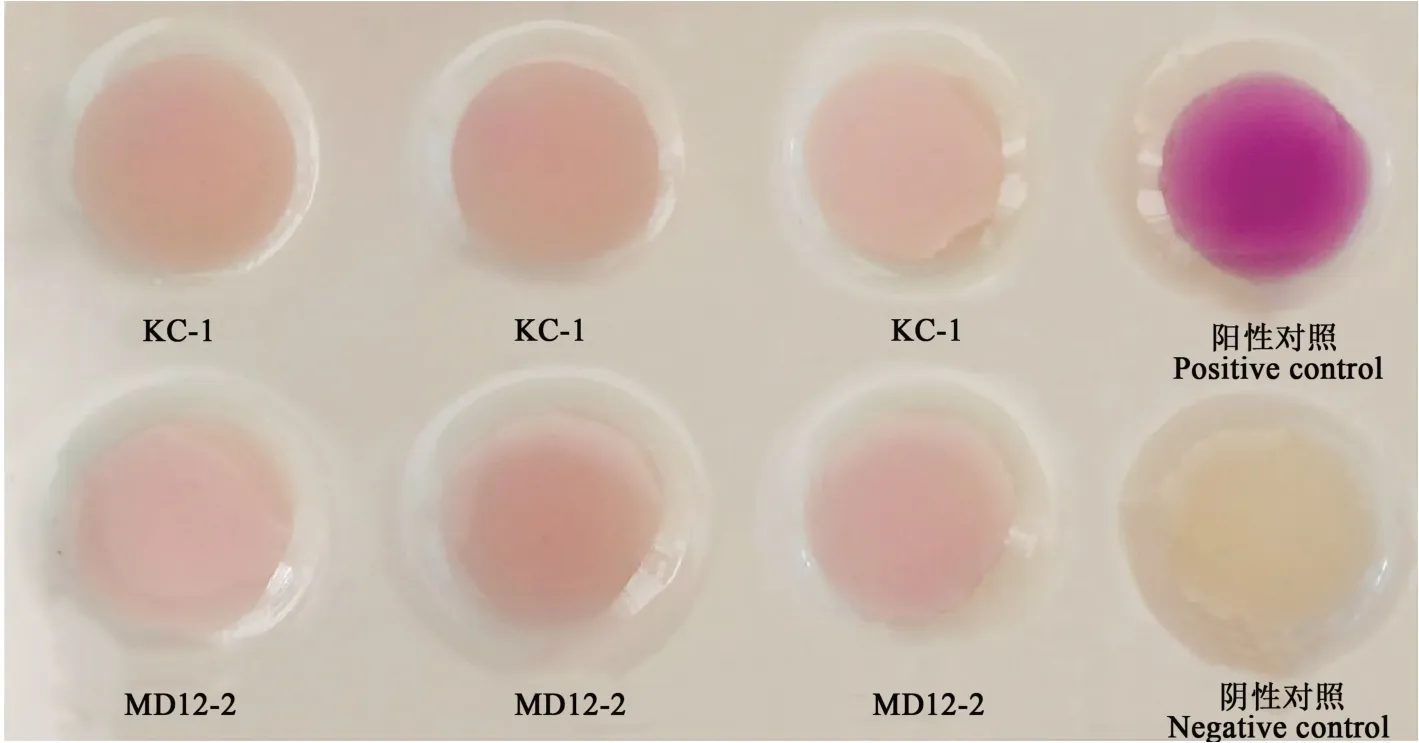
图3 菌株KC-1和MD12-2产IAA的能力Fig.3 IAA secreting ability of strains KC-1 and MD12-2
2.4 菌株溶磷能力
与对照相比,KC-1与MD12-2菌落周围出现明显的透明圈(图4),说明KC-1与MD12-2具有良好的溶磷能力。
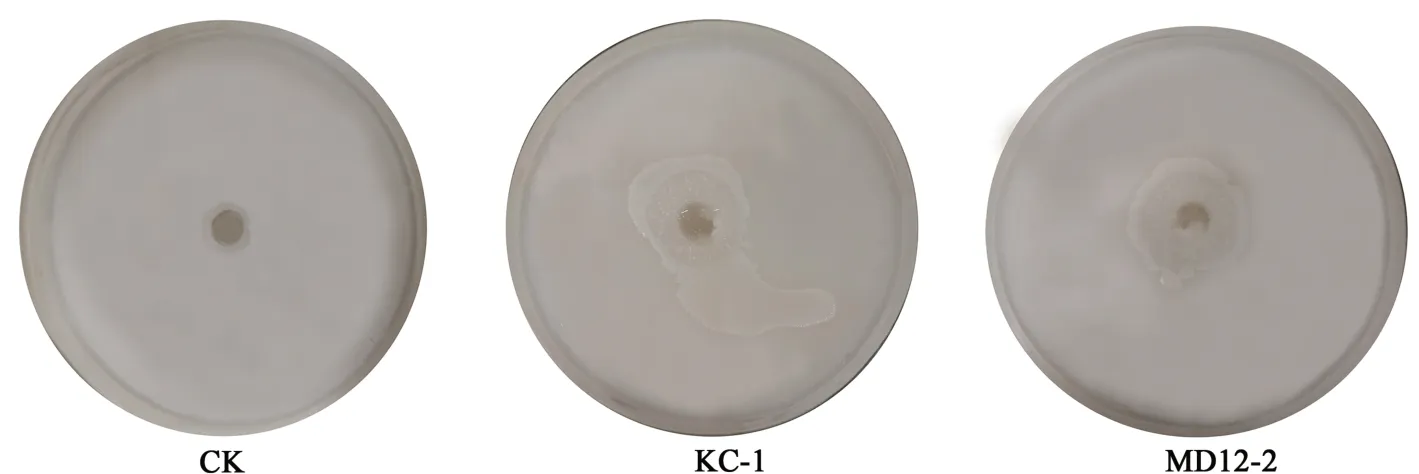
图4 菌株KC-1和MD12-2的溶磷能力Fig.4 Phosphate solubilizing ability of strains KC-1 and MD12-2
2.5 内生细菌对大豆种子萌发特性的影响
在低含量KC-1与MD12-2菌液浸种处理下,大豆种子发芽势较对照显著增加41.68%和38.34%,种子活力分别较对照显著提高45.54%和236.47%,发芽率未见显著变化。各含量菌液浸种处理的种子在萌发过程中α-淀粉酶活性较对照均有显著提高,其中低含量KC-1与MD12-2菌液浸种处理大豆α-淀粉酶活性较对照升高最多,分别增加46.5%和144.9%(表2)。可见,低含量KC-1与MD12-2浸种对种子萌发具有明显的促进作用。
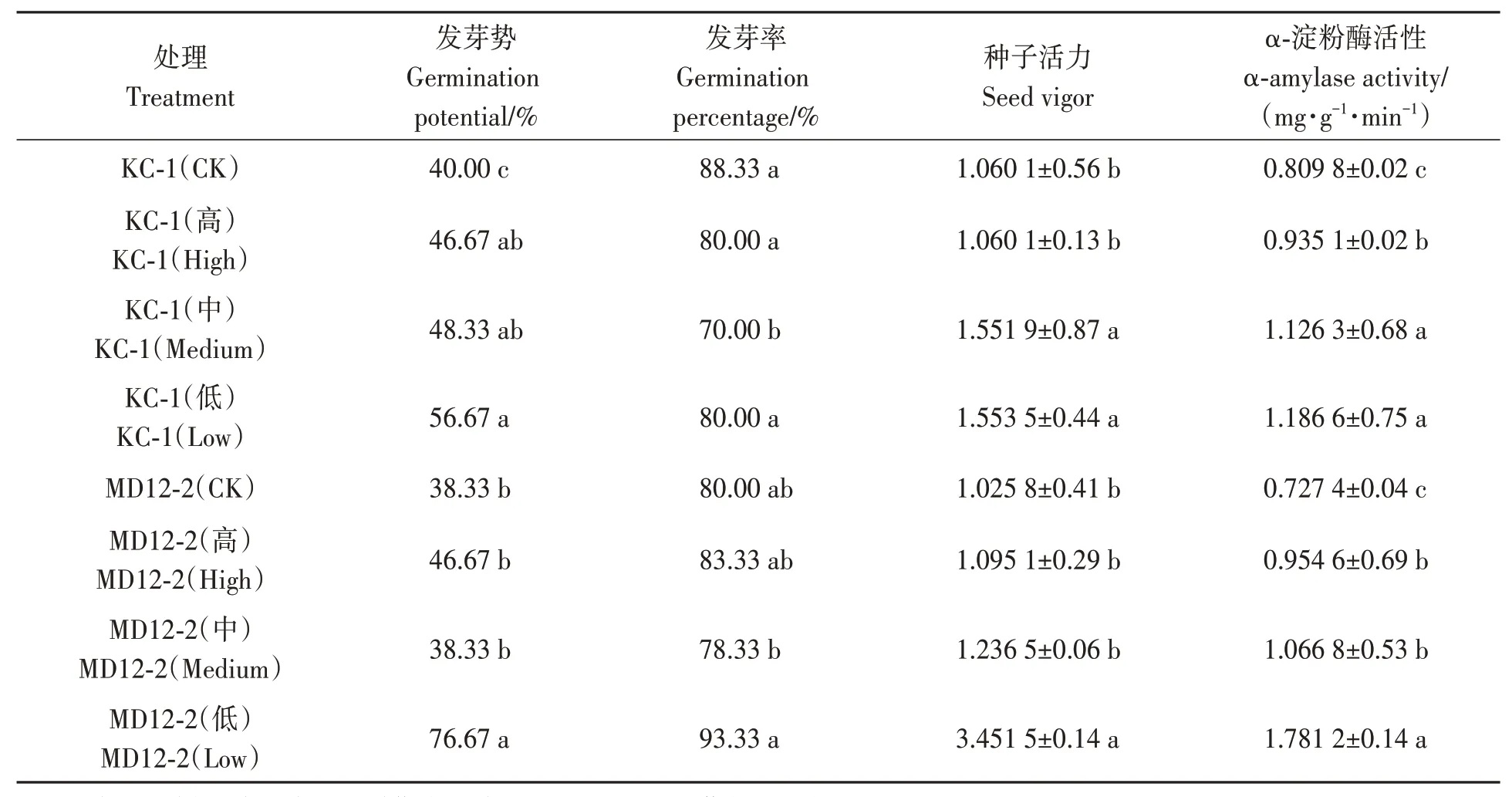
表2 大豆内生细菌的促萌发效果Table 2 Promoting germination of soybean endophytic bacteria
2.6 内生细菌的促生长效应
2.6.1 内生细菌浸种对大豆生长指标的影响MD12-2中含量和高含量浸种处理下,大豆苗期株高较对照分别显著增加27.3%和25.5%;高含量KC-1与MD12-2处理大豆株高在初花期较对照分别显著提高50.2%和28.9%,结荚期较对照分别显著提高25.7%和29.5%。初花期,高含量KC-1与MD12-2处理大豆植株地上部干重较对照分别显著增加24.6%和19.3%。苗期,各含量KC-1浸种处理大豆植株地下部干重均显著增加;结荚期,中含量MD12-2浸种处理大豆植株地下部分干重较对照显著增加26.5%。可见,中、高含量的KC-1和MD12-2浸种对大豆生长的促进效果最好(表3)。
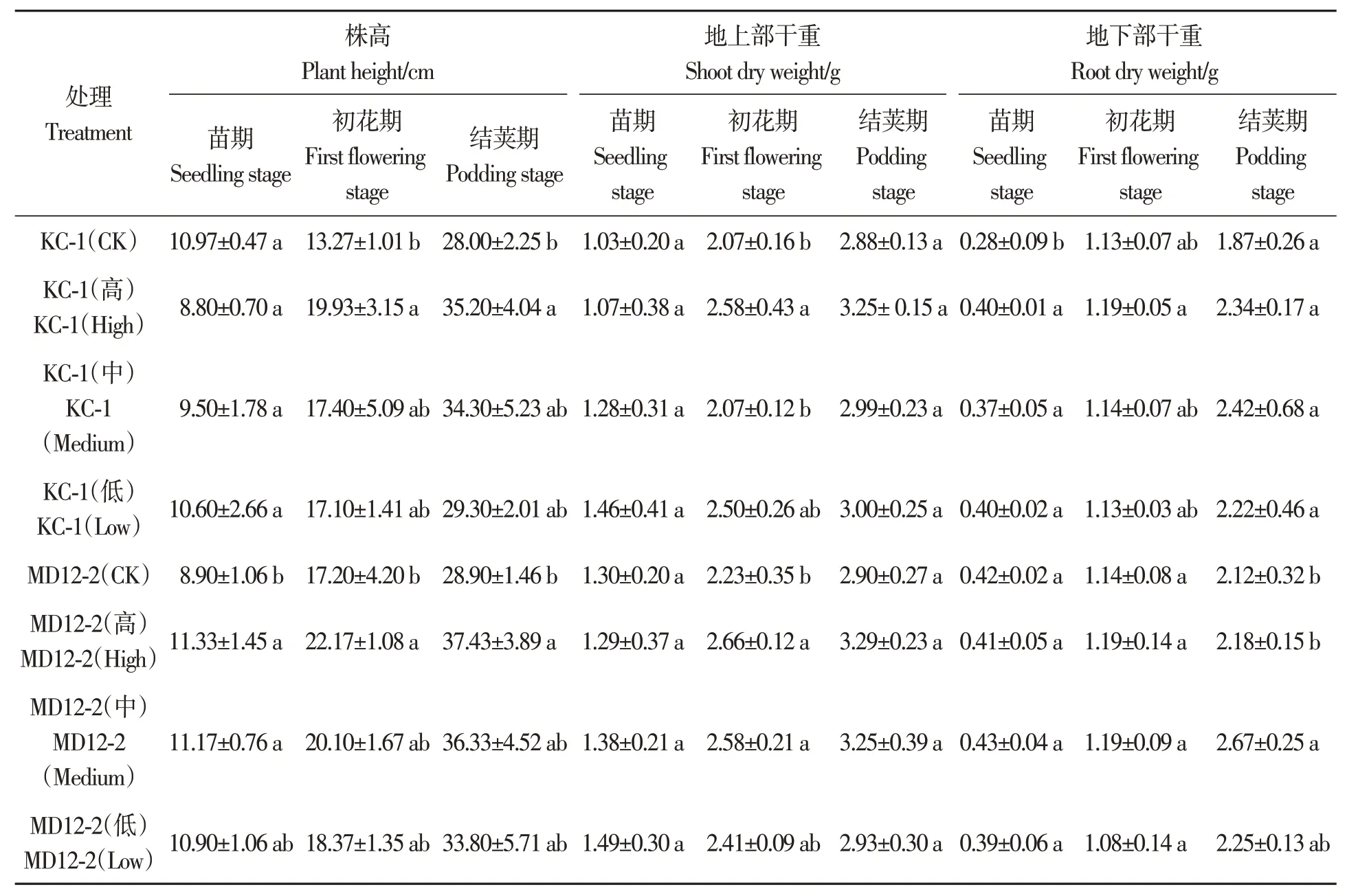
表3 大豆内生细菌的促生长效果Table 3 Promoting function of soybean endophytic bacteria
2.6.2 内生细菌浸种对大豆叶绿素含量的影响 苗期,中、低含量MD12-2浸种处理,大豆叶绿素含量较对照分别显著提高16.9%和13.0%;初花期,中含量MD12-2浸种处理下,大豆叶绿素含量较对照显著提高27.4%;结荚期,各处理间均无明显差异。可见,中、低含量MD12-2在大豆生长苗期和初花期可显著增加叶绿素含量,菌株KC-1对大豆叶绿素含量无明显影响(图5)。
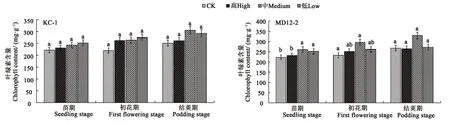
图5 内生细菌对大豆叶绿素含量的影响Fig.5 Effect of endophytic bacteria on chlorophyll content of soybean
2.6.3 内生细菌浸种对大豆硝酸还原酶活性的影响 苗期,高、中含量KC-1与MD12-2浸种处理后,大豆硝酸还原酶活性提升幅度较为明显,较对照分别提高119.5%、94.23%与70.7%、87.54%;初花期,中含量KC-1与MD12-2浸种处理,大豆硝酸还原酶活性较对照分别显著提高109.1%和129.0%;结荚期,中含量KC-1与MD12-2处理下大豆硝酸还原酶活性较对照分别显著提高66.9%与117.5%。可见,苗期时高、中含量KC-1与MD12-2对提高大豆硝酸还原酶活性作用效果最好;初花期与结荚期时,中含量KC-1与MD12-2对提高大豆硝酸还原酶活性作用效果最好(图6)。
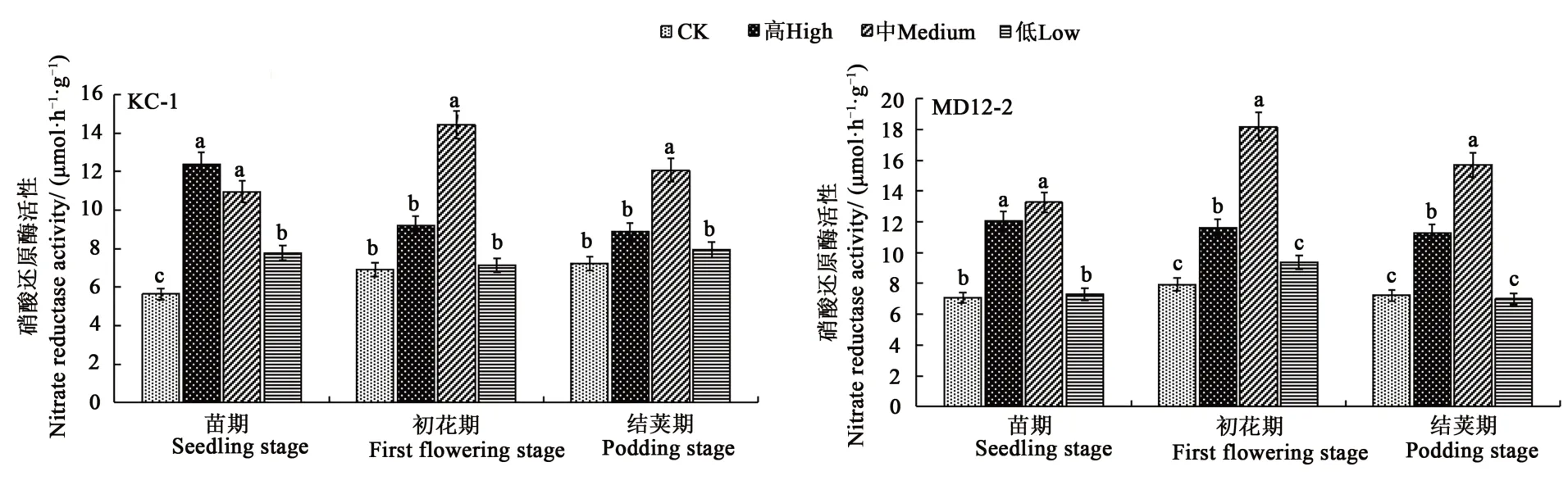
图6 内生细菌对大豆硝酸还原酶的影响Fig.6 Effect of endophytic bacteria on nitrate reductase activity of soybean
2.6.4 内生细菌浸种对大豆根系活力的影响 苗期,高、中、低含量KC-1与高、中含量MD12-2处理的大豆根系活力均有显著提高;其中,中含量KC-1与MD12-2处理的大豆根系活力提高幅度最大,较对照显著提高75.4%和84.0%(P<0.05)。初花期,高、中、低含量KC-1与MD12-2处理的大豆根系活力均有显著提高;其中,中含量KC-1与MD12-2处理的大豆根系活力提高幅度最大,较对照分别显著提高107.2%和195.3%。结荚期,中含量KC-1与高、中、低含量MD12-2处理的大豆植株根系活力均有显著提高;其中,中含量KC-1与MD12-2处理的大豆根系活力提高幅度最大,较对照分别显著提高45.0%与160.1%。可见,中含量KC-1与MD12-2对提高大豆根系活力作用效果最好(图7)。

图7 内生细菌对根系活力的影响Fig.7 Effect of endophytic bacteria on root activity of soybean
2.6.5 内生细菌浸种对大豆根瘤固氮酶活性的影响 苗期,低含量KC-1处理,大豆根瘤固氮酶活性显著增加124.1%(P<0.05);初花期,高含量KC-1与MD12-2处理根瘤固氮酶较对照分别显著提高100.4%和44.6%;结荚期,高含量KC-1处理根瘤固氮酶活性较对照显著提高191.0%(P<0.05)。可见,低含量KC-1在苗期对提高大豆根瘤固氮酶活性作用效果最好;高含量KC-1在初花期与结荚期对提高大豆根瘤固氮酶活性作用效果最好;高含量MD12-2在初花期对提高大豆根瘤固氮酶活性作用效果最好(图8)。
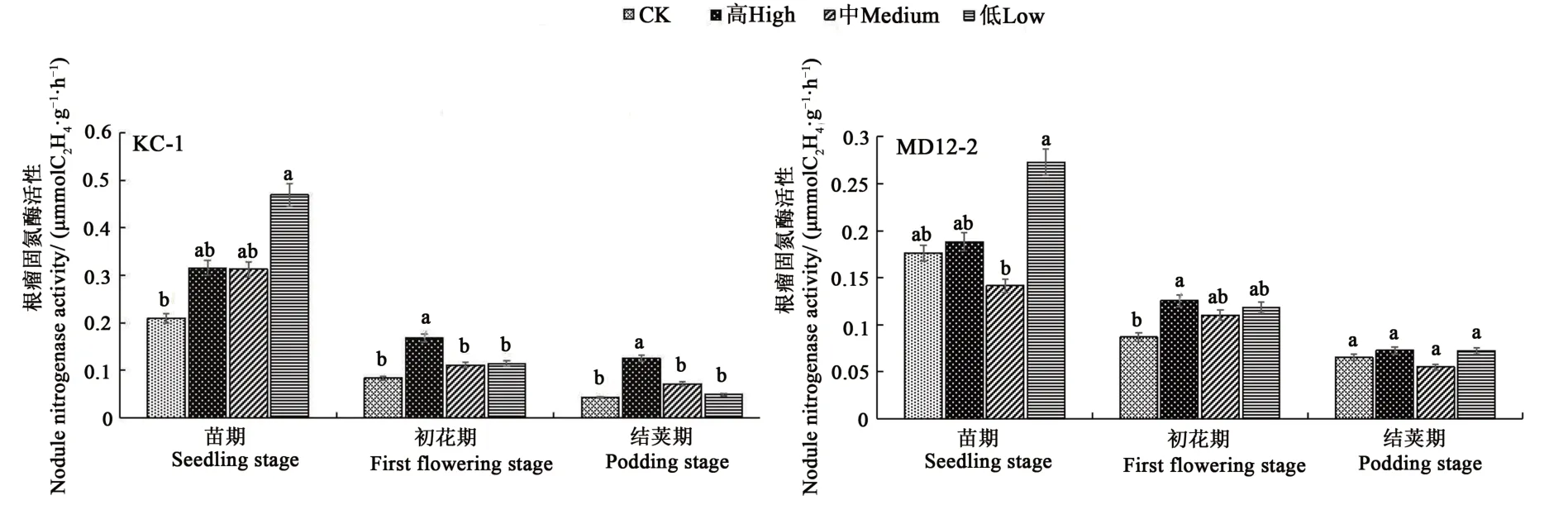
图8 内生细菌对根瘤固氮酶的影响Fig.8 Effect of endophytic bacteria on nitrogenase activity in root nodules
3 讨论
本研究采用种子埋藏的方法使土壤微生物定植于种子内成为内生菌,这与周怡等[28]直接选择大豆种子破碎后进行内生菌分离的方式不同,该方法不仅可以获得大豆种子内源本存在的内生菌,还可获得能侵入并定植于大豆种子内的土壤微生物,更易得到丰富的内生菌株。植物内生菌分离因消毒、分离等方式的不同,所得内生菌数量、种类及准确性也存在区别。对种子表面消毒后采用无菌水清洗,在培养基中培养大豆并在胚根周围获得内生菌,这种方法既可保证获得菌株来自大豆种子内部,又可避免破碎种子后分离内生菌容易在操作过程中污染而造成准确性差的不利影响。
本研究所得2株优势内生细菌KC-1与MD12-2,经16S rRNA鉴定分别为侧孢芽孢杆菌(Brevib aci l lus laterosporus)和 枯 草 芽 孢 杆 菌(Baci l lus s ubtilis),利用菌株发酵液进行浸种处理后发现,种子的发芽势、种子活力和种子萌发时α-淀粉酶活性较对照均有显著提高,说明使用大豆内生细菌浸种处理对大豆种子萌发有良好的促进效果,与张凯晔等[11]田菁种子内生菌SC17浸种处理的研究结果一致。Khan等[29]接种内生菌Peni cilliumminiol ut eumLHL09,使大豆芽伸长、叶面积和叶绿素含量等得到显著提高,本研究中菌株KC-1与MD12-2发酵液浸种处理,可以增强大豆生长过程中硝酸还原酶与根瘤固氮酶活性,提高大豆叶绿素含量,从而保证大豆在生长期间健康的氮循环过程,保证大豆植株中高水平含量的氮,促进大豆的光合作用,大豆的株高、地上部干重和地下部干重显著增加,使大豆获得较高的干物质积累,并提高大豆生育期内根系活力,提高大豆的吸水能力与营养获取能力,为大豆高产奠定了基础。
