马铃薯根际土壤细菌群落结构及其对干旱胁迫的响应
2022-08-22王莉莉殷丛培李峰杨志敏刘芳明林柏松刘晓静刘海军孙靖单东东崔江慧张振清
王莉莉,殷丛培,李峰,杨志敏,刘芳明,林柏松,刘晓静,刘海军,孙靖,单东东,崔江慧,张振清,5*
(1.围场满族蒙古族自治县马铃薯研究所,河北承德 068450;2.河北农业大学农学院,河北保定 071000;3.张家口市农业科学院,河北张家口 075000;4.围场满族蒙古族自治县马铃薯产业服务中心,河北承德 068450;5.河北省马铃薯种薯产业技术研究院,河北承德 068450)
马铃薯(Solanum tuberosumL.)是世界上第一大非谷物作物,也是仅次于水稻(Oryza sativaL.)、小麦(Triticum aestivumL.)和玉米(Zea maysL.)的第四大粮食作物[1]。日常栽培中,马铃薯主要分布于地下30 cm以内耕层,易遭受干旱威胁。因此,干旱是制约马铃薯生产的主要问题之一,研究马铃薯的抗旱响应有助于保障马铃薯产业的健康发展。
植物生长过程中需要应对各种生物和非生物胁迫,而干旱是影响植物地理分布、限制农作物产量和威胁粮食安全的主要环境胁迫因子之一。干旱能够引起植物高渗透胁迫,造成植物体内膨压降低、活性氧的积累和水分流失,破坏膜结构,抑制光合作用,最终导致细胞和植株死亡[2]。植物通过改变细胞或组织的大小和形状、增加水分吸收或减少水分流失、增强细胞渗透能力、改善抗氧化酶活性等提高脱水耐受性,来适应干旱胁迫造成的不良反应[3]。
研究表明,根际微环境与植物抗旱[4]、耐盐[5]、抗病[6]及生长发育[7]关系密切,甚至植物的杂种优势也与根际微生物组的“优势”有关[8]。根际是根系周围土壤中微生物的活跃区域,一般将根表约1 mm土壤视为根际土壤[9],是植物胁迫反应领域的研究热点。植物根系向根际释放各种化学物质和营养物质,从而吸引各种微生物,如细菌、真菌、藻类和原生动物[10-11];根际微生物具有与植物本身不同的代谢能力,包括养分循环和有机质的分解等,在根际微生态系统中发挥重要作用,从而对植物的健康生长产生正向效应,并对植物适应各种环境胁迫具有重要作用[11]。
在植物生长过程中,植物与根际微生物相互作用,以适应其栖息地,这些生存于植物根部周围能分泌植物促生物质、促进植物生长的微生物被称为植物根际促生细菌(plant growth promoting rhizobacteria,PGPR)[12]。研究表明,在干旱胁迫下丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)通过增强抗氧化酶活性来减少氧化胁迫对植物的危害,并提高植物水分利用效率和生物量来增加宿主植物的耐旱性[13]。在干旱条件下,PGPR和AMF的直接相互作用会诱导植物的抗旱性,但在严重或持续干旱胁迫下,这些相互作用有可能被打破[14]。
微生物群落成员通过为植物提供缓冲带、产生各种促进植物生长的激素和提高营养利用率来增强植物的抗逆性[12]。Xu等[4]对干旱胁迫下高粱(Sorghum bicolorL.)根际微生物的研究发现,植物铁转运蛋白的损失会影响微生物群落组成,从而导致放线菌(Actinobacteria)在干旱胁迫下显著富集。添加链霉菌(Streptomyces)会增加植物根系的生物量,但外源施加铁会降低干旱条件下Streptomyces的适应性优势[15]。植物根系通过累积大量的甘油3-磷酸(glycerinum 3-phosphoglycerate,G3P)和应激反应因子哌啶酸(pipecolinicacid)招募土壤微生物,从而使革兰氏阳性菌能够优先定殖,以达到抗旱的目的[16]。
根际微生物群落的结构因植物种类、植物发育阶段、土壤类型和农业管理措施等存在差异。因此,本研究通过分析土壤微生物16S rRNA高通量测序结果,探索种植马铃薯前后根际土壤微生物的变化,及干旱胁迫对马铃薯和马铃薯根际土壤微生物群落结构的影响,为利用根际微生物提高作物对干旱的抵御能力奠定基础。
1 材料与方法
1.1 试验材料、干旱处理及样品采集
选用冀张薯8号(Jizhangshu 8,JZS)和夏波蒂(Shepody,S)2个马铃薯品种为试验材料,由围场满族蒙古族自治县马铃薯研究所提供。试验于2020年5—9月在河北省承德市围场满族蒙古族自治县(41°58′1″N,117°45′69″E)进行。
采用盆栽试验,取田间表层15—40 cm土壤,风干后过60目筛装盆。每个花盆(直径35 cm,高40 cm)装土25 kg,不同品种每个干旱处理种植20盆,马铃薯种植前取未种植马铃薯的土壤样品作为对照土(CK soil),每盆播种微型薯3颗,播深5 cm。当50%植株地上部分开花时进行干旱处理,分别设4种水分处理方式:正常栽培(T0,土壤最大持水量80%~85%)、轻度干旱(T1,土壤最大持水量60%~65%)、中度干旱(T2,土壤最大持水量40%~45%)和重度干旱胁迫(T3,土壤最大持水量20%~25%)。试验采用称重法和TPBAR-SM无线土壤水分传感器(托普云农)对土壤含水量进行监测,每2 d补水1次。
在马铃薯干旱胁迫处理14 d后,取各处理倒4~6叶,进行叶片理化性状的测定。叶片采样完成后,采用抖土法去除根际附着不紧密的土壤,然后用无菌刷收集紧密附着的土样(planted soil),每个处理取20个单株的根际土样混合为1个生物学样本重复,每处理均获取3个生物学重复的根际土壤样品,装入无菌袋,置于液氮罐中带回实验室,保存在-80℃,用于根际土壤细菌16S rRNA基因高通量测序分析。冀张薯8号(Jizhangshu 8,JZS)和夏波蒂(Shepody,S)土壤样品分别用JZS-T0、JZS-T1、JZS-T2、JZS-T3和S-T0、S-T1、S-T2、S-T3表示。
1.2 分析方法
1.2.1 马铃薯叶片理化性状的测定 干旱胁迫14 d后,在样品采集前使用LI-6400便携式光合作用测定系统(LI 6400,Li-Cor,Lincoln,NE,USA)测定各处理植株倒4~6叶的光合参数,每个处理测定3个单株,包括净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,Ci)和蒸腾速率(transpiration rate,Tr);参照高玉坤等[17]方法测定叶片过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活性。
1.2.2 土壤总DNA的提取、PCR扩增及Illumina测序 采用E.Z.N.A.®Soil DNA Kit(Omega Biotek,Norcross,GA,U.S.)试剂盒提取马铃薯根际土壤细菌DNA。纯化后使用NanoDrop 2000紫外可见分光光度计(Thermo Scientific,Wilmington,USA)测定DNA浓度。采用引物338F(5’-ACTCC TACGGGAGGCAGCAG-3’)和806R(5’-GGACTAC HVGGGTWTCTAAT-3’)[18]扩增细菌16S rRNA基因的V3~V4高变区。通过Illumina MiSeq平台(Illumina,San Diego,USA)进行测序。对数据质控后,用UPARSE(version 7.1,http://drive5.com/uparse/)将操作分类单元(operational taxonomic unit,OTU)以97%的相似度聚类。基于UNITE数据库(Release 5.0,https://unite.ut.ee/)对OTUs代表序列进行物种注释。利用QIIME软件计算Alpha多样性指数。利用R语言中PCoA(principal coordinates analysis)分析根际土壤与对照土壤间、不同干旱处理间根际土壤的菌群结构差异。通过选择OTU或某一水平上分类信息对应的序列根据最大似然法(approximatelymaximum-likelihood ML)构建进化树,使用R语言作图绘制进化树;采用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)方法将现有的16S rRNA基因测序数据与COG(clusters of orthologous groups of proteins)数据库进行比对,比较功能基因在生物代谢通路上的丰度差异。
1.3 数据处理
所得数据采用Microsoft Excel 2019和SPSS 22.0进行统计分析。
2 结果与分析
2.1 干旱胁迫对马铃薯叶片光合作用的影响
随着干旱胁迫的加剧,马铃薯叶片Pn、Tr、Gs呈下降趋势;但Ci表现为上升趋势(表1)。对于叶片Pn,T1处理Pn与T0处理差异不显著;但T2处理Pn较T0处理显著降低,JZS和S分别降低20.72%和47.41%。对于叶片Tr,干旱胁迫对马铃薯JZS叶片Tr无显著影响;但对马铃薯S叶片Tr影响显著(表1),T1、T2和T3处理较T0处理分别降低22.23%、43.37%和63.08%。对于叶片Gs,T2和T3处理显著降低了马铃薯叶片Gs,与T0处理相比,JZS和S分别降低38.54%、35.54%和56.62%、65.12%。综上所述,干旱胁迫显著降低了马铃薯叶片的Pn、Tr和Gs,干旱敏感型品种的变化更加显著。
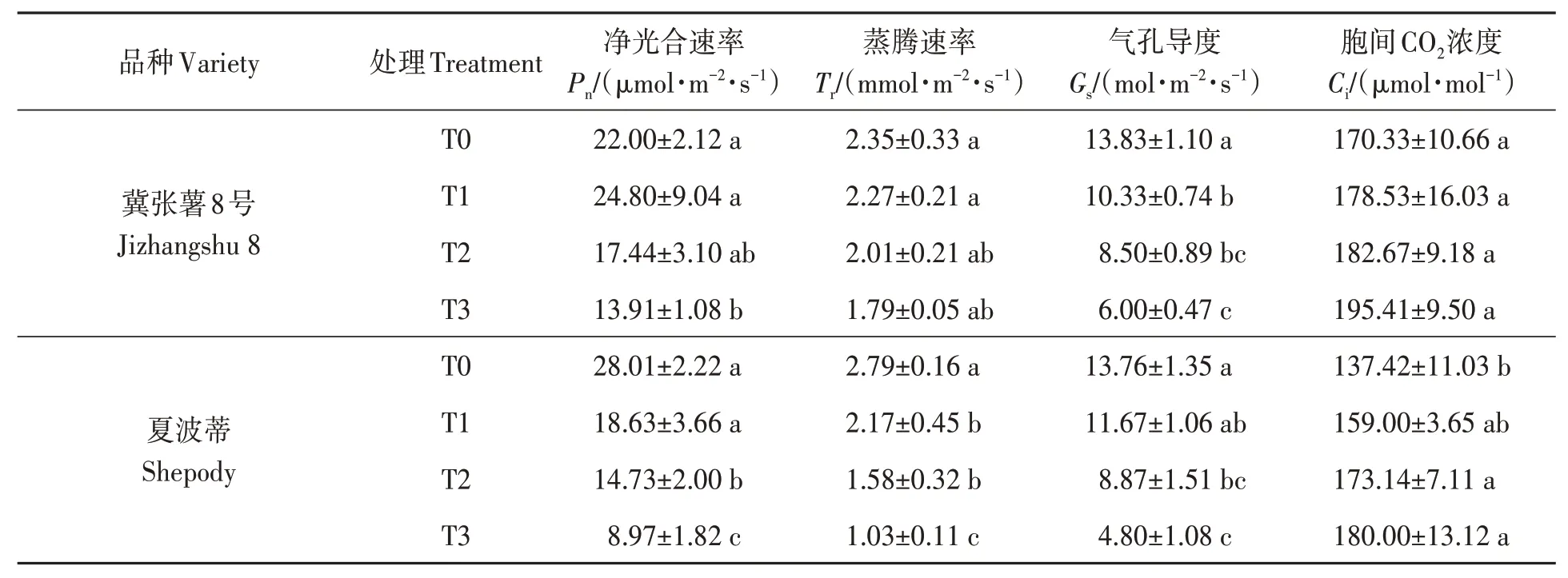
表1 不同处理下马铃薯叶片的光合特性Table 1 Photosynthetic characteristics of potato leaves under different treatments
2.2 干旱胁迫对马铃薯叶片抗氧化酶活性的影响
抗氧化酶活性与植物抗旱能力呈正相关,是评价植物抗旱性的重要标志之一[19-20]。对不同处理马铃薯叶片中SOD、POD和CAT活性进行分析,结果(表2)表明,随着干旱胁迫的加剧,SOD和POD活性逐渐升高,而CAT活性呈先升高后降低趋势。干旱胁迫使2个马铃薯品种叶片SOD活性较对照均有不同程度的升高;T3处理下,JZS和S叶片SOD活性较T0处理分别显著升高103.5%和48.9%。干旱胁迫下,2个品种叶片POD活性变化趋势与SOD变化趋势一致;T3处理下JZS和S叶片POD活性较T0处理显著升高,分别升高64.2%和59.4%。JZS叶片CAT活性随干旱胁迫程度的加剧表现为先升高后降低,T2处理叶片CAT活性较T0处理显著提高48.9%;而S叶片CAT活性随干旱胁迫程度的加剧而降低,其中,T3处理较T0处理显著降低34.2%。在相同处理条件下,JZS叶片CAT活性是S的1.15(T0)、1.41(T1)、1.70(T2)和1.69倍(T3),表明JZS较S抗旱能力更强。
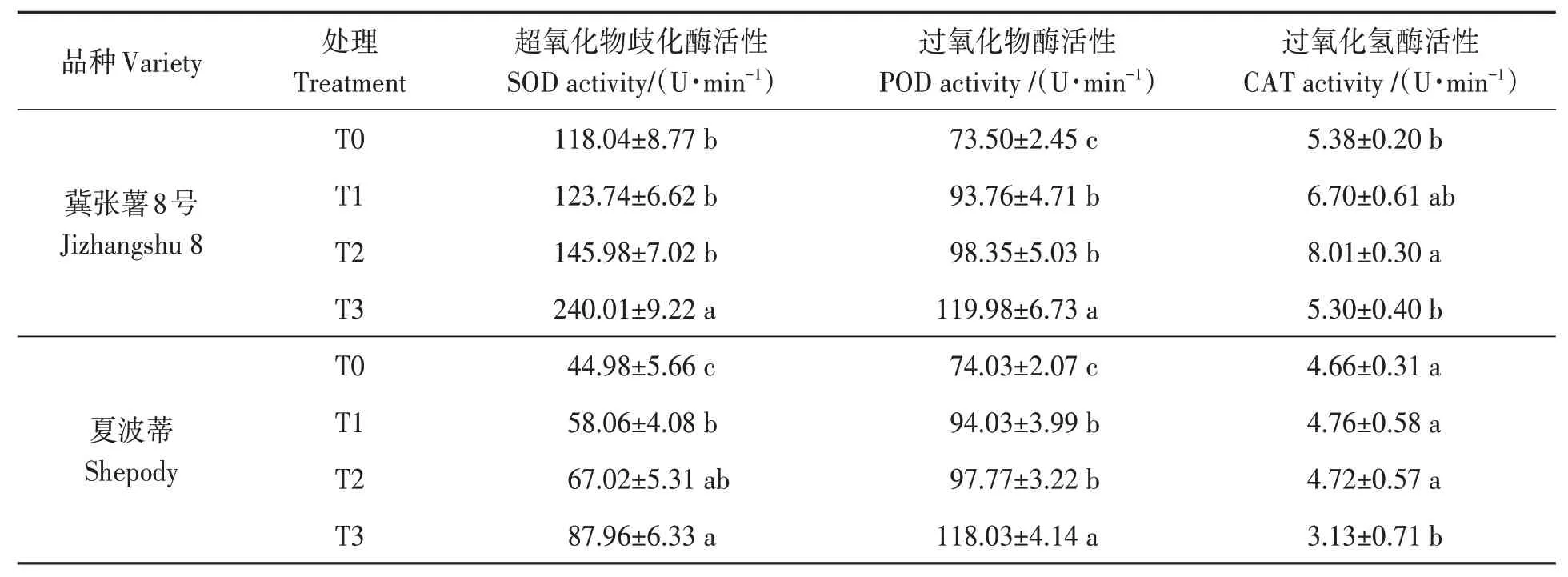
表2 干旱胁迫下马铃薯叶片保护酶的活性Table 2 Enzyme activities of potato leaves under different treatments
2.3 马铃薯根际细菌群落测序数据及Alpha多样性分析
分析供试土壤样品,共获得有效序列1 263 889条,S-T3处理的有效序列数最高,为178 086条;S-T1处理最低,为125 549条;所有处理的序列平均长度为416.60~419.36 bp(表3)。在相似度为97%条件下,共获得6 785个OTUs,归属33个门、94个纲、267个目、462个科、919个属、1 930个种。

表3 不同处理下根际细菌群落的测序质量Table 3 Sequencing quantity of rhizosphere bacteria under different treatments
所有供试样品测序深度指数(coverage)均在96%以上。样品中细菌群落丰度的Sobs、Chao和ACE指 数 分 别 为2 914.33~3 123.00、4 154.81~4 409.18和4 209.69~4 412.31;Shannon和Simpson多样性指数分别为6.45~6.75和0.003~0.010;Shannon和Simpson均匀度指数分别为0.802~0.846和0.036~0.117(表4)。其中,T1处理的Shannon指数最高;T3处理的Simpson指数最高,而T0处理的Simpson指数最低。对于ACE、Chao和Sobs指数,马铃薯S中以T0处理较高;而在JZS中以T3处理较高;但不同处理间差异不显著。综上所述,种植马铃薯和干旱胁迫改变了马铃薯根际微生物群落多样性和均匀度,但对群落丰度指数无显著影响。
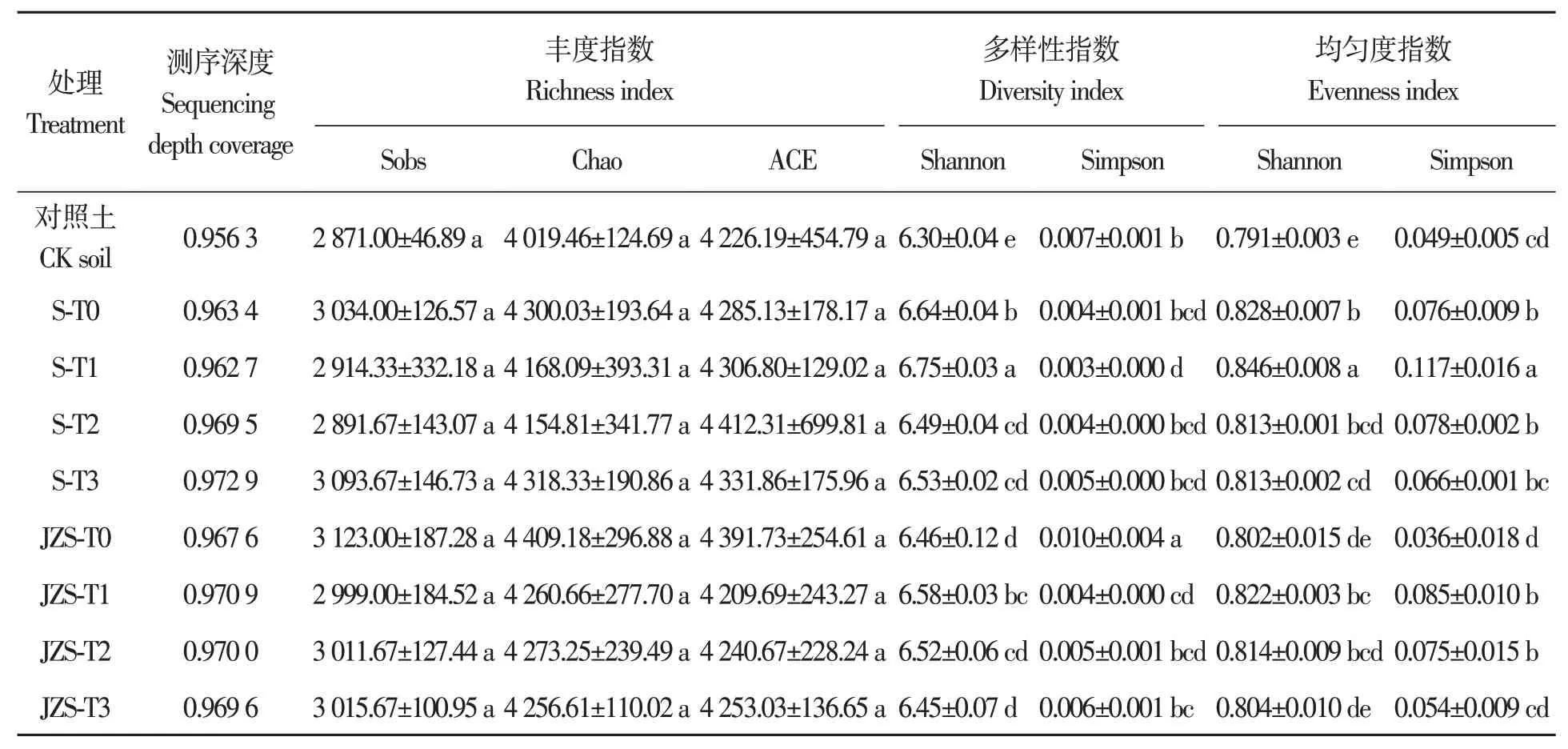
表4 各处理根际土壤样本Alpha多样性指数Table 4 Alpha diversity index of rhizosphere soil samples in each treatment
2.4 样本分组分析
按品种(A)、是否种植马铃薯(B:空白对照土与马铃薯根际土)和干旱胁迫(C)分组,通过相似性分析(analysis of similarities,ANOSIM)检验组间差异是否显著大于组内差异,结果(图1和表5)表明,组间差异均大于组内差异;3种分组方法的组间差异均达到显著水平;其中,不同干旱胁迫程度对样品间差异的解释度最大,种植马铃薯对土壤微生物也有较大影响。
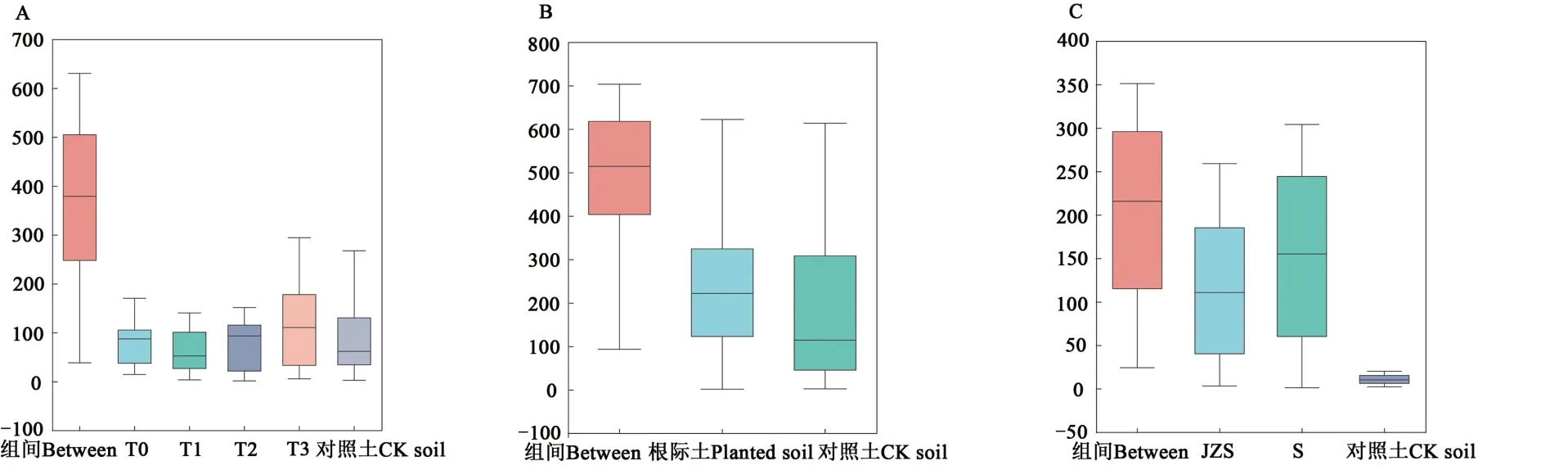
图1 3种分组方式的组内和组间差异ANOSIM分析Fig.1 ANOSIM analysis of differences between groups and groups in 3 grouping methods
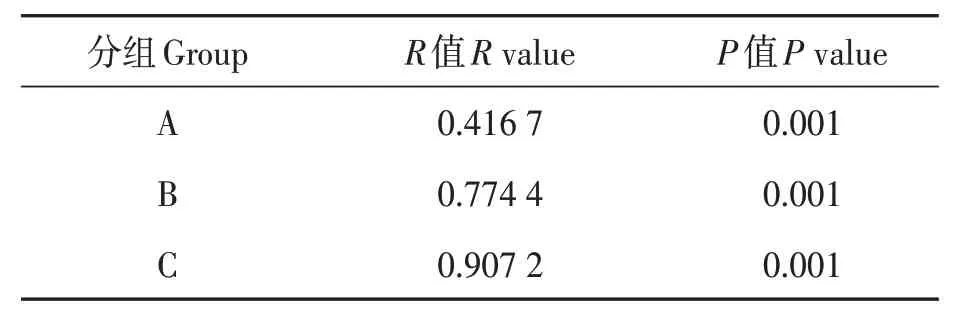
表5 相似性分析Table 5 Analysis of similarties
2.5 种植马铃薯对土壤细菌群落影响
将对照土和根际土测序结果进行比较,结果(图2)表明,根际土中共鉴定出6 815个OTUs,归属于33个门,919个属;对照土中共鉴定出5 254个OTUs,归属于31个门791个属。两者共有OTUs为4 784个,对照土和根际土特有OTUs分别为470和2 031个(图2A),说明种植马铃薯后土壤细菌群落发生了显著变化。
在门水平上,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes,)和芽单胞菌门(Gemmatimonadetes)在根际土和对照土中的相对丰度均较高,相对丰度之和均达91.73%,为优势菌门(图2B)。进一步对相对丰度排名前15的菌门在根际土和对照土中的相对丰度进行比较,结果(图2C)表明,根际土中放线菌门、髌骨细菌(Patescibacteria)、疣微菌门(Verrucomicrobia)和蓝藻细菌门(Cyanobacteria)的相对丰度较对照土分别显著提高26.45%、76.99%、54.32%和48.32%;而酸杆菌门(Acidobacteria)、绿弯菌门、拟杆菌门、芽单胞菌门、棒状杆菌门(Rokubacteria)、装甲菌门(Armatimonadetes)和肠杆菌门(Entotheonellaeota)的相对丰度较对照土分别显著降低35.24%、17.67%、11.87%、26.59%、24.32%、30.00%和41.38%。
通过基于细菌多样性Bray-Curtis距离的PCoA分析,可研究不同样本之间群落组成的相似性或差异性。图2D中两样本点越接近,表明两样本的物种组成越相似。根际土和对照土细菌形成了2个截然不同的集群,PC1(13.04%)与PC2(38.28%)的累计贡献量达51.32%,说明其能够表征微生物群落组成的特征,种植马铃薯显著改变了土壤的细菌群落结构。
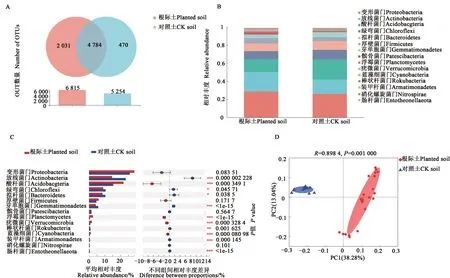
图2 种植马铃薯后土壤细菌多样性Fig.2 Effects of planted potato on bacterial diversity
2.6 干旱胁迫对马铃薯根际细菌群落组成的影响
维恩图(图3A)分析显示,各处理根际土壤微生物样品共有OTUs为1 691个,在S-T0和JZS-T0样品中分别有261和240个OTUs;而干旱处理后各样品的OTU数量明显下降,表明干旱胁迫对根际土壤细菌群落结构影响显著。
分析马铃薯根际土壤样品细菌群落结构发现,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、髌骨细菌门(Patescibacteria)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)的相对丰度较高,相对丰度之和为97.08%(图3B)。干旱处理提高了马铃薯根际土壤中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和芽单胞菌门(Gemmatimonadetes)的相对丰度,其中,变形菌门(Proteobacteria)的相对丰度随干旱胁迫程度的加剧逐渐增加,拟杆菌门(Bacteroidetes)在JZS-T2处理和S-T3处理中分别较其T0处理增加85.53%和83.99%;而干旱处理降低了酸杆菌门(Acidobacteria)的相对丰度,其余菌门在不同品种间表现趋势不同。
在属分类水平上,nor ank_c_Sub group_6、芽孢杆菌属(Bacillus)、节杆菌属(Arthrobacter)、RB41、
norank_f_Gemmatimonadaceae、nor ank_f_JG30-KFCM45、假单胞菌属(Pseudomonas)、鞘脂单胞菌属(Sphingomonas)、类诺卡氏属(Nocardioides)、链霉菌属(Streptomyces)的相对丰度较高,为优势菌属,相对丰度之和为31.04%(图3C)。节杆菌菌属(Arthrobacter)的相对丰度随干旱胁迫程度的加剧逐渐降低。假单胞菌属(Ps eudomonas)的相对丰度在干旱胁迫后显著增加,在JZS-T3和S-T3中分别提高1 833.33%和5 800.00%。干旱胁迫使JZST3中芽孢杆菌属(Bacillus)的相对丰度较T0显著增加109.13%。

图3 干旱胁迫下马铃薯根际细菌群落结构Fig.3 Bacterial community abundance in potato rhizosphere under drought stress
对不同门、属在各处理的相对丰度(Top10)进行差异显著性分析,结果(图4A和4B)表明,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、髌骨菌门(Patescibacteria)、疣微菌门(Verrucomicrobia)浮霉菌门(Planctomycetes)和节杆菌属(Arthrob act er)、nor ank_f_JG30-K F-C M45、假单胞菌属(Pseudomonas)、类诺卡氏属(Nocar di oides)、链霉菌属(S t rept omyces)在不同处理间呈显著或极显著差异。PCoA分析(图4C)显示,PC1(39.39%)与PC2(25.66%)的累计贡献量达到65.05%,说明其能够表征微生物群落组成的特征,其中,T0和T1处理根际细菌的群落结构相似性较高,T2和T3处理根际细菌的群落结构相似性较高。

图4 不同干旱胁迫下马铃薯根际菌群组间差异Fig.4 Difference and distribution of rhizosphere soils under drought stress
2.7 干旱胁迫对马铃薯根际土壤的系统发生进化分析及功能预测
将相对丰度排名前20的属所对应的OTUs数据进行多序列比对,通过最大似然法设置Bootstrap值为1 000次重复构建系统发生进化树,结果(图5A)表明,相对丰度排名前20的属均属于 变 形 菌 门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)。
利用PICRUSt对16S rRNA进行高通量测序分析,结果(图5B)表明,与代谢功能和基本生命活动相关的功能基因在干旱处理中均有所富集,表明干旱处理下微生物的代谢和生命活动可能更加活跃。在COG注释的功能分类有24个,除未知功能外,氨基酸转运和代谢类最多,其次为一般代谢、能量产生与转化、转录、细胞壁和细胞膜生物合成、信号转导、碳水化合物转录与运输、无机离子的转运和代谢等;RNA加工和修饰、染色质结构与动力学、细胞骨架和细胞外结构类较少。
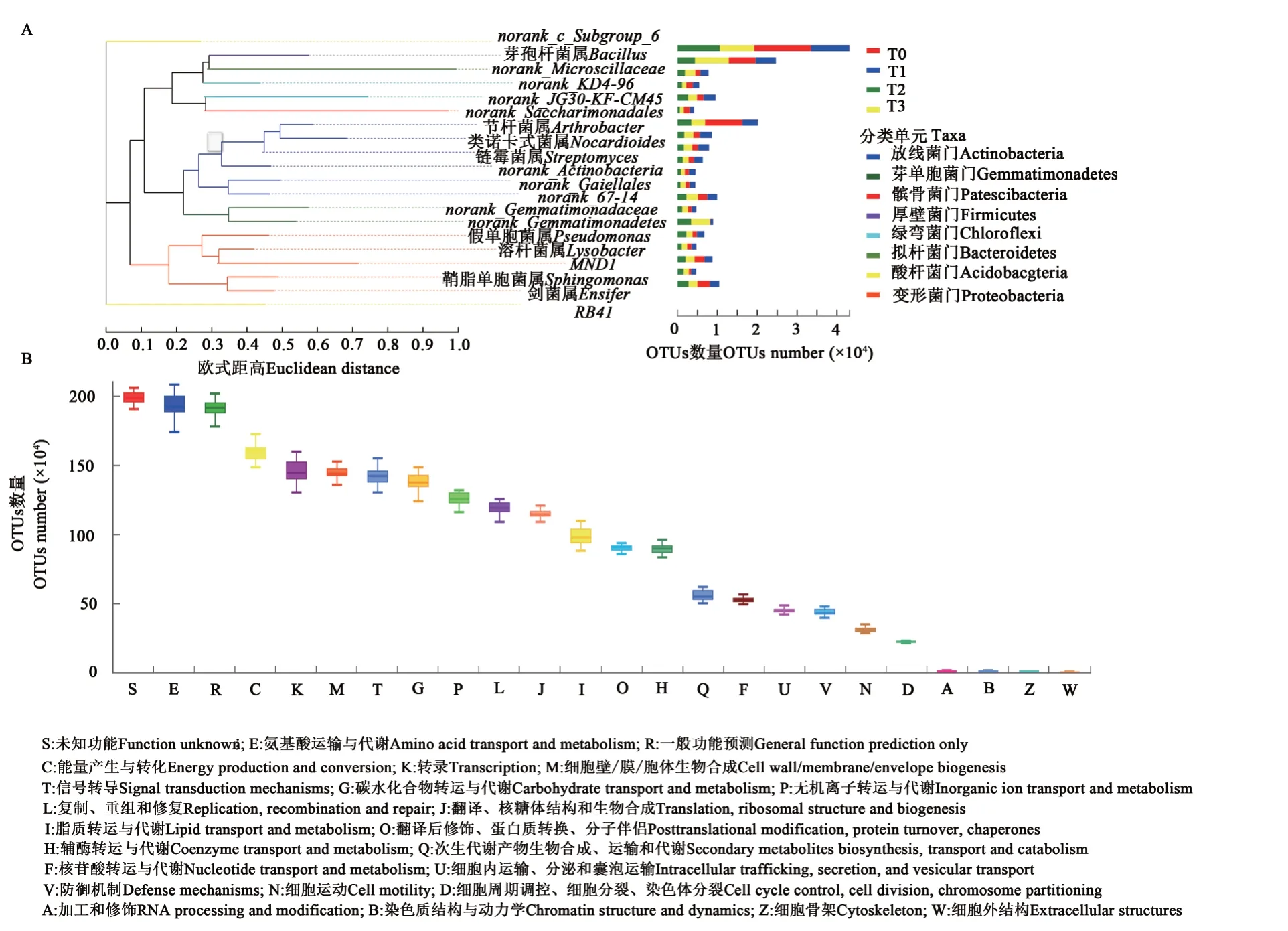
图5 根际微生物的系统发生树及功能预测Fig.5 Taxonomic analysis through phylogenetic tree and microbial functional features
3 讨论
干旱导致作物光合速率降低,而提高叶片净光合速率是干旱胁迫下保证作物产量的重要途径。本文研究了不同耐旱型马铃薯品种在干旱胁迫下的光合响应模式,结果表明,干旱胁迫使马铃薯叶片Pn、Tr和Gs均有不同程度的降低,但Ci有所升高,与前人在马铃薯[20]和番茄[21](Lyco per sicon esculentum)中的研究结果一致,表明干旱胁迫抑制了马铃薯叶片的光合能力,特别是重度干旱胁迫下,叶肉细胞CO2同化酶活力下降等非气孔限制性因素是马铃薯光合下降的主要原因。作物在遭受干旱胁迫时,抗氧化酶系统被诱导,以保护细胞膜免遭氧化损伤,本研究发现,干旱胁迫下马铃薯叶片的SOD、POD活性明显上升,而CAT活性则呈现先上升后下降的趋势,与前人研究结果一致[22]。干旱胁迫下,SOD活性的变化可作为衡量马铃薯抗旱能力的指标之一,SOD活性的增加使体内产生的超氧自由基加速分解,以缓解膜脂过氧化程度[16,20];本研究还发现,冀张薯8号(JZS)的SOD活性的变幅大于夏波蒂,与抗艳红等[19]研究结果存在差异,有待进一步研究。综上所述,干旱胁迫降低了马铃薯叶片的光合能力,使抗氧化酶活性增加,且不同干旱胁迫程度下,其响应也存在一定差异。
不同基因型的马铃薯间根际微生物群落差异较大[23]。本研究通过16S rRNA高通量测序研究了正常条件下和干旱胁迫下马铃薯根际微生物群落的多样性和结构变化,结果表明,种植马铃薯后土壤中细菌群落中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)的相对丰度较高,为优势菌门,与前人研究结果一致[23-24]。大麦(Hordeum vulgareL.)根际微生物中酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为优势菌门[25];花生(Arachis hypogaeaL.)根际微生物中以放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和蓝藻菌门(Cyanobacteria)为主要优势菌门[26];拟南芥(Arab i d opsis thalianaL.)根际微生物中以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)和芽单胞菌门(Gemmatimonadetes)为优势菌门[27]。不同作物根际微生物中优势菌门存在差异,可能与不同作物根系分泌物的不同有关。在本研究中,种植马铃薯后根际土壤中芽单胞菌门(Gemmatimonadetes)的相对丰度较种植前有所降低,在高粱(Sorgh um b icolorL.)种植前后的根际土壤中也发现了类似的现象[28]。
胁迫环境下,根际微生物群落的变化可能对植物的生长和健康产生重要影响。通过16S rRNA高通量测序发现,干旱胁迫使马铃薯根际微生物群落结构发生改变,且一些特定微生物种类得到富集,如变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)和假单胞菌属(Pseudomonas)的相对丰度显著升高。研究发现,芽单胞菌门(Gemmatimonadetes)作为好氧/厌氧嗜热菌,在干旱条件下生长良好[29];单胞菌属(Pseudomonas)为革兰氏阳性菌,对干旱具有较强的抗性,能够在干旱条件下生长良好。
对菌群代谢功能预测表明,多与氨基酸运输代谢相关,其次是能量产生与转化、细胞壁和细胞膜生物合成、信号转导、碳水化合物转录与运输、无机离子的转运和代谢及脂质运输和代谢。脂质是微生物膜的重要组成部分,在环境胁迫响应和生存中发挥着重要作用。在干旱胁迫下,脂质运输和代谢微生物的富集有利于增强植物的抗旱性[30]。放线菌门(Actinobacteria)的主要功能是吸收营养物质及作为70%抗生素的来源[31],其菌丝体抗干燥能力强,研究表明根际微生物组对干旱的响应中涉及铁代谢,但外源添加铁又会破坏干旱引起的放线菌门富集[15]。本研究表明,轻度干旱下Actinobacteria得以富集;中度和重度干旱胁迫则降低了其相对丰度,说明适宜的干旱可以使土壤中的放线菌门富集。厚壁菌门(Firmicutes)能够抗脱水,对干旱和极端环境的适应能力极强[32]。本研究发现,重度干旱下厚壁菌门的相对丰度较高。不同的优势微生物群落可能代表了植物在相应干旱条件下所需的微生物类型,此外,一些基本的生物过程,如与细胞壁和细胞膜生物合成、信号转导、RNA加工与修饰、染色质结构与动力学、细胞骨架和胞外结构相关的类群在干旱处理的土壤微生物群中也有所富集。因此,可以通过研究不同干旱处理下优势微生物的种类,开发微生物接种剂,提高植物的抗旱能力。作为植物生长促进菌,这些细菌可以促进植物的生长,提高植物抗旱性[33-34]。干旱处理后,马铃薯根际土壤微生物群落具有较高的信号转导机制和防御机制,对胁迫和有毒化合物具有较高的耐受性[35]。推测这些功能可能在一定程度上影响马铃薯的生长和抗旱能力。在根际土壤中,根系分泌物在介导植物与微生物的相互作用中起重要作用[36],为阐明植物-土壤-微生物互作关系,应对根系分泌物进行深入研究,为通过调控根际土壤微生物环境来提高植物抗旱性提供可能。
