泰山白首乌根际土壤真菌多样性分析
2022-08-22李洁林莹徐美玉王飞徐凌川
李洁,林莹,徐美玉,王飞,徐凌川*
(1.山东中医药大学药学院,济南 250355;2.山东御华景宸生态农业发展有限公司,山东临沂 273418)
泰山白首乌(Cynanchum bun geiDecne)属于双子叶龙胆目萝藦科植物[1],是中国特有物种,因其善于增补人体精血、增强免疫力、延缓衰老,素有“白人参”的美称。泰山白首乌居泰山四大名药之首,为山东道地药材[2],以块根入药,味苦、甘涩,具有补肾益肝、乌须黑发、养血益精、润肠通便等功效[3],富含苯乙酮类、C21甾体皂苷类、萜类和生物碱类等有效成分[4]。该药材的有效成分和药理作用[5]成为国内外学者的研究热点之一。随着其滋补、强身等临床疗效的不断体现,白首乌药材的市场也在不断扩大。白首乌为多年生植物,生长周期长,野生品种的开花率和结果率均较低,而人工种植白首乌较困难[6],因此,越来越多的伪品植物被用来充当正品白首乌使用。为解决这一问题,白首乌的仿野生种植逐渐兴起[7]。
植物的生长与土壤环境的理化因素密切相关[8],且受土壤微生物菌落的影响,尤其是根际土壤微生物,对植物的生长发育起重要作用。根际是指受植物根系影响、离根轴表面数毫米的微区域[9],也是植物、土壤和环境条件相互作用形成的特定的微生态系统。根际微生物存在于根际土壤内,是根际土壤的重要组成部分。微生物群落的多样性对植物生长有重要作用[10],而植物生长过程中产生的分泌物也会影响微生物的种类、数量和结构,二者间存在协同互助作用[11]。研究发现,大部分根际微生物能提高土壤再利用率,促进植物生长发育,且对植物病虫害有很好的防治效果[12],增强植物对生物胁迫和非生物胁迫的抗性。任春光等[13]对猕猴桃根际微生物多样性研究发现,微生物菌落的种类和数量对不同生长发育时期的幼苗影响不同,不同的菌种对土壤理化性质的影响也各不相同。付丽娜等[14]对三七植物根际微生物研究发现,不同连作年限的三七土壤根际微生物的多样性和均匀度存在一定差异,且三七根腐病的发生率与菌落丰富度密切相关。张艳琪等[15]从泰山白首乌的根际土壤中培养出7株具有抗菌活性的菌株,为研究和开发新型抗菌药物提供了原材料和理论指导。因此,探究根际微生物群落的多样性[16],对泰山白首乌的人工栽培以及仿野生种植具有重要的理论指导意义,然而,关于泰山白首乌根际土壤微生物多样性的研究尚未有报道。
近年来,随着分子生物技术的发展[17],高通量测序技术具有准确率高、耗时短、价格低等优势[18],被越来越多地应用于微生物多样性分析。因此,本研究通过Illumina MiSeq高通量测序技术,以不同产地泰山白首乌的根际土壤为研究对象,对根际微生物的群落组成和分布规律进行分析比较,探讨泰山白首乌的生长与微生物菌群结构间的相互联系,为更好地创造仿野生种植、培育品质优良的泰山白首乌提供科学的理论指导。
1 材料与方法
1.1 土壤样地条件
试验设置3个样地。1号样地:位于山东省莱芜市莲花山(LW),海拔999 m,年平均气温13.0℃,年降水量1 289 mm。2号样地:位于山东省济南市历下区大坝头(LX),海拔285 m,年平均气温13.8℃,年降水量685 mm。3号样地:位于山东省济南市长清区五峰山(CQ),海拔395 m,年平均气温14.7℃,年降水量671 mm。
1.2 土壤样品采集
采集地的泰山白首乌均为野生种,且由山东中医药大学徐凌川教授鉴定为正品原植物。于2021年8月11—13日,选取生长旺盛的植株,用铁铲挖至植株根部,用灭菌的刷子和不锈钢勺收集附着于根系0~4 mm范围内的土样,每个样地分别采集地下10和20 cm深度的根际土样,分别编号为LW10、LW20、LX10、LX20、CQ10和CQ20,去除大块颗粒和杂质后密封于无菌袋中,冰袋保存带回实验室,-20℃冰箱保存,用于后续实验。
1.3 实验方法
1.3.1 土壤DNA提取 提取DNA前,对样品进行预处理。称取300 mg混匀后的土壤样品,放入灭菌的2 mL离心管中,加入1×PBS溶液,震荡混匀,室温、10 000 r·min-1离心3 min,弃上层液体。将样品管放入55℃金属浴10 min,使残留液体完全挥发,保证后续实验操作。使用OMEGA试剂盒(E.Z.N.A™Mag-Bind Soil DNA Kit)提取根际土壤微生物的总DNA,用1%琼脂糖凝胶电泳检测,并用紫外分光光度计测定其含量和纯度,合格的DNA置于-20℃冰箱保存,备用。
1.3.2 PCR扩增及高通量测序 以提取的总DNA为模板,对基因组ITS1-ITS2区域进行扩增。采用真菌ITS区的特异性引物(I TS 1 F:5’-CTTGGTCAT TTAGAGGAAGTAA-3’;I T S 2:5’-GCTGCGTTCTT CATCGATGC-3’)进行PCR,反应程序为:94℃3 min;94℃30 s,45℃20 s,65℃30 s,5个循环;94℃20 s,55℃20 s,72℃30 s,20个循环;72℃5 min;10℃保存。PCR扩增产物经1%的琼脂糖凝胶电泳检测,合格产物用天根胶回收试剂盒进行回收纯化后送上海生工生物股份有限公司进行Illumina Mi Seq高通量测序。
1.3.3 生物信息学统计分析 将高通量测序得到的序列进行拼接,区分样本后对序列质量进行质控和过滤,然后进行操作分类单元数(operational taxonomic unit,OTU)聚类分析和物种分类学分析。基于97%相似水平下的OTU聚类和分类学信息,对OTU进行多样性指数分析,并对群落的结构和组成及Alpha多样性[19-23]。
2 结果与分析
2.1 泰山白首乌根际土壤真菌数据分析
对泰山白首乌根际土壤6个样品的真菌微生物进行测序,结果(表1)表明,样品LW10、LW20、LX10、LX20、CQ10和CQ20的有效序列数分别为68 579、68 939、58 106、64 833、49 236和68 679。基于97%相似水平进行OTUs聚类分析,共得到1 589个OTUs。Veen图(图1)表明,6个样品共有的OTUs为12个,其中,样品LW10、LX10和CQ10共有的OTUs为22个;样品LW20、LX20和CQ20共有的OTUs为18个;每个样品存在不同数量的特有OTUs,其中,样品CQ20特有的OTUs数量最多,为358个;样品LW20特有的OTUs数量最少,为175个。

表1 泰山白首乌根际土壤检测序列结果Table 1 Sequence results of rhizosphere soil of Cynanch um bun gei Decne

图1 泰山白首乌根际土壤样品间Veen图Fig.1 Veen diagram of rhizosphere soil samples of Cynanch um bungei Decne
2.2 泰山白首乌根际土壤真菌丰富度和指数多样性
测序数据的稀释曲线(图2)表明,随着样品测序数量的增多,Alpha多样性指数值变化越来越缓慢,当达到足够的数量之后,曲线逐渐趋于平缓,因此,测序深度能够覆盖样品根际土壤中的全部真菌微生物。

图2 泰山白首乌根际土壤样品的稀释曲线Fig.2 Dilution curve of rhizosphere soil sample of C ynanchum b unge i Decne
Alpha多样性分析结果(表2)表明,样品CQ20的Chao指数和Ace指数最高,说明该样品中根际土壤微生物丰富度较高。样品LX20的Shannon指数最大,且Simpson指数最小,说明该样品中根际土壤微生物多样性较高。样品LX20的Shannon均匀度指数最大,说明该样品中微生物在群落分布的均匀度较高。6个样品的覆盖度均为1.0,进一步说明测序结果能够代表泰山白首乌根际土壤微生物的真实情况。Rankabundance曲线能够解释样品多样性的丰富度和均匀度,曲线越宽物种组成越丰富,曲线越平坦物种组成越均匀,对不同样品进行比较,结果(图3)表明,样品LX20的丰富度和均匀度明显高于其他样品。

表2 泰山白首乌根际土壤真菌多样性指数统计表Table 2 Statistical table of rhizosphere soil fungal diversity index of Cynanc hum bun gei Decne

图3 泰山白首乌根际土壤样品的Rank-abundance曲线Fig.3 Rank abundance curve of rhizosphere soil samples of C ynanch um bungei Decne
2.3 泰山白首乌根际土壤真菌聚类分析和主成分分析
样本的相关性热图(图4)表明,同一地点不同深度的样品间相似性较高,而不同地点样品间差异较大;样品LW与LX间的相似性较高,而样品CQ与LW和LX间的相似性较低。基于Bray-Curtis距离分析样本间的遗传距离,结果(图5)表明,同一地点不同深度间遗传距离较小,而不同地点间遗传距离较大。主成分分析(principal component analysis,PCA)结果(图6)表明,不同深度对根际土壤真菌微生物的组成及多样性影响较小,而不同产地间根际土壤真菌群落的组成存在显著差异。
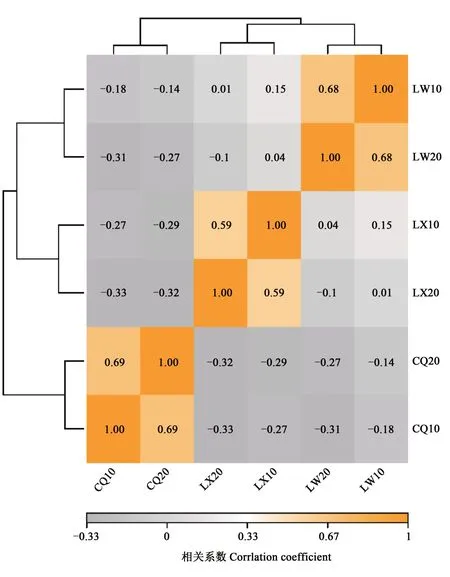
图4 不同根际土壤样品间的关系Fig.4 Relationship of different rhizosphere soil samples

图5 泰山白首乌根际土壤样品距离热图Fig.5 Distance heat map of rhizosphere soil sample of Cynanc hum bun gei Decne

图6 不同根际土壤样品间的主成分分析Fig.6 PCA of different rhizosphere soil samples
2.4 泰山白首乌根际土壤真菌的群落组成
6个样品的微生物的组成和结构存在较大差异(表3)。其中,样品LW10的OTUs归属于9门、18纲、44目、73科、104属、167种;样品LX10的OTUs归属于8门、21纲、53目、85科、114属、171种;样品CQ10的OTUs归属于8门、23纲、49目、86科、130属、196种;说明不同产地间根际微生物群落的结构组成存在一定差异。与样品LX10相比,样品LX20的OTUs归属于10门、29纲、60目、106科、142属、229种,表明不同深度间根际微生物的结构组成及多样性也存在一定差异。

表3 泰山白首乌样品在不同分类水平上的数目Table 3 Number of C ynanch um b ungei Decne samples at different classification levels
2.4.1 门水平 子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、类原生动物门(Rozellomycota)、梳霉门(Kickxellomycota)为6份样本的共同优势菌门(图7)。其中,被孢霉门在样品LW10和LX10的相对丰度较高,分别为58.68%和45.59%;子囊菌门在样品LW20、LX20、CQ10和CQ20的相对丰度较高,分别为86.84%、53.52%、67.04%和65.80%。另外,各样品中均包含一定比例的未知菌门。

图7 不同际土壤样品真菌在门水平的相对丰度Fig.7 Relative abundance of fungi in different rhizosphere soil samples at phylum level
2.4.2 纲水平 伞菌纲(Agaricomycetes)、古根菌纲(Archaeorhizomycetes)、被孢霉纲(Mortierellomycetes)、粪壳菌纲(Sordariomycetes)、盘菌纲(Pezizomycetes)、球囊菌纲(Glomeromycetes)为泰山白首乌根际土壤微生物的优势菌纲(图8),但在不同土壤样品中的相对丰度存在较大差异。其中,被孢霉纲在样品LW10和LX10的相对丰度较高,为58.68%和45.58%;古根菌纲在样品LW20的相对丰度较高,为81.96%;伞菌纲在样品LX20的相对丰度较高,为30.05%;粪壳菌纲在样品CQ10和CQ20的相对丰度较高,分别为52.83%和29.71%。

图8 不同根际土壤样品真菌在纲水平的相对丰度Fig.8 Relative abundance of fungi in different rhizosphere soil samples at class level
2.4.3 目水平 在目水平上(图9),伞菌目(Agaricales)、古根菌目(Archaeorhizomycetales)、球囊霉目(Glomerales)、肉座霉目(Hypocreales)、被孢霉目(Mortierellales)、盘菌目(Pezizales)、粪壳菌目(Sordariales)为优势菌目。其中,被孢霉目在样品LW10和LX20的相对丰度较高,分别为38.67%和25.85%;古根菌目在样品LW20的相对丰度较高,为77.29%;伞菌目在样品LX20的相对丰度较高,为24.94%;粪壳菌目在样品CQ10的相对丰度较高,为36.70%;盘菌目在样品CQ20的相对丰度较高,为24.10%。

图9 不同根际土壤样品真菌在目水平的相对丰度Fig.9 Relative abundance of fungi in different rhizosphere soil samples at order level
2.4.4 科水平 在科水平上(图10),古根菌科(Archaeorhizomycetaceae)、中国毛壳菌科(Chaetomiaceae)、内杯菌科(Sarcoscyphaceae)、被孢霉科(Mortierellaceae)、赤壳科(Nectriaceae)、核盘菌科(Pezizaceae)和火丝菌科(Pyronemataceae)为优势菌科。其中,被孢霉科样品LW10和LX10的相对丰度较高,分别为36.67%和32.28%;古根菌科在样品LW20的相对丰度较高,为75.96%;赤壳科在样品LX20的相对丰度较高,为24.14%;中国毛壳菌科在样品CQ10的相对丰度较高,为33.40%;盘菌核科在样品CQ20的相对丰度较高,为21.75%。

图10 不同根际土壤样品真菌在科水平的相对丰度Fig.10 Relative abundance of fungi in different rhizosphere soil samples at family level
2.4.5 属水平 在属水平上(图11),古根菌属(Archaeorhizomyces)、尾柄孢壳属((Cercophora)、赤霉菌属(Gibberella)、Zopfiella、珠头霉属(Oedocephalum)、小被孢霉属(Mortierella)、冠孢革菌属(Lindtneria)为优势菌属。其中,小被孢霉属在样品LW10和LX10的相对丰度较高,分别为32.73%和27.93%;古根菌属在样品LW20的相对丰度较高,为77.85%;冠孢革菌属在样品LX20的相对丰度较高,为23.51%;Zopfiella在样品CQ10的相对丰度较高,为29.42%;珠头霉属在样品CQ20的相对丰度较高,为21.75%。

图11 不同根际土壤样品真菌在属水平的相对丰度Fig.11 Relative abundance of fungi in different rhizosphere soil samples at genus level
3 讨论
高通量技术能够准确、系统、全面地研究土壤微生物群落信息[20-24]。土壤微生物多样性、丰富度和均匀度等能够影响土壤质量和植物生长。研究表明,土壤根际微生物群落的组成和分布在一定程度上与植物种类、生长年限、海拔高度、土层深度和产地等因素有关[21]。陈冉等[24]研究发现,根际微生物群落多样性与产地因素关系密切,主要受生态区的气候和地理位置影响。官鑫等[25]研究报道,土层深度与土壤微生物群落结构多样性密切相关。本研究对不同来源、不同根茎深度的泰山白首乌根际土壤微生物进行高通量测序分析,结果表明,不同来源的泰山白首乌根际土壤微生物的群落结构和多样性存在显著差异性,共有的OTUs仅40个,群落丰富度和多样性总体趋势表现为CQ>LX>LW;在群落组成上,LW和LX泰山白首乌根际土壤微生物的优势菌门为被孢霉门(Mortierellomycota),而CQ的优势菌门为子囊菌门(Ascomycota),LW和LX的土壤真菌群落较为接近,表明不同来源泰山白首乌根际土壤的真菌群落多样性存在较大差异。不同地域的真菌优势群落存在差异,可能与植株的原产生境有关[26]。土壤理化性质的改变和生态因子的变化会导致部分微生物的生长繁殖受到限制,影响群落的丰富度、多样性和均匀度;同时,微生物菌种适应环境变化的能力强弱也会影响群落多样性[27]。
泰山白首乌在生长过程中,地下根茎会有两部分横向生长成膨大的团块状,该部分是最有药用价值的组织部位,深度大约为地下10和20 cm左右。测序结果表明,不同根茎深度的泰山白首乌根际土壤微生物的群落组成和多样性存在一定差异,但其优势菌群上差异较小,20 cm土层深度的群落丰富度和多样性总体表现为20 cm大于10 cm。样品CQ10和CQ20的优势门、纲均为子囊菌门(Ascomycota)和粪壳菌纲(Sordariomycetes),即不同地下深度的土壤微生物优势菌群具有一定的相似性,这可能与植株在生长过程中与微生物协同互助有关[28],且这类真菌微生物具有分布广泛、环境适应性强等特点[29],直接或间接地影响药用植物的生长发育和品质形成。不同土层深度土壤的碳源和有机质含量等理化性状存在一定差异,微生物对不同碳源的利用能力也存在差异,因此,不同深度土壤的微生物群落多样性存在差异[30]。
植物与根际微生物间存在复杂的相互作用[31]。根际微生物具有丰富的多样性,能够影响植物的光合、呼吸等生理过程,进而影响植物的生长发育及根系功能等[32]。通过改变药用植物根系分泌物的组成,可有效改善土壤理化性质,甚至缓解药用植物连作障碍[33]。因此,研究不同因素下根际微生物与植物的互作关系、充分利用微生物的促生机制提高植物的产量和品质具有重要意义[34],为更好地创造仿野生种植条件、培育品质优良的泰山白首乌提供科学且有效的理论指导。
