过表达棉花葡萄糖醛酸激酶基因Gb GlcA K促进拟南芥细胞伸长
2022-08-22吴楠杨君张艳孙正文张冬梅李丽花吴金华马峙英王省芬
吴楠,杨君,张艳,孙正文,张冬梅,李丽花,吴金华,马峙英,王省芬
(河北农业大学农学院,华北作物改良与调控国家重点实验室,华北作物种质资源研究与利用教育部重点实验室,河北保定 071001)
纤维品质改良是当前棉花育种迫切需要解决的问题[1]。海岛棉纤维品质优良,表现为纤维长、强度大、细度高[2]。因此,海岛棉纤维发育相关基因尤其是与陆地棉纤维差异表达基因的筛选和功能研究对解析纤维细胞分化发育的分子机理、改良纤维品质具有重要意义。
棉纤维品质主要包括长度、强度、细度等,是由棉纤维(分化突起的棉花胚珠外表皮细胞)的发育所决定的。棉纤维发育是一个有序的过程,主要经历纤维原始细胞的分化突起(-2~5 DPA,days post anthesis,开花后天数)、纤维细胞伸长(初生壁合成,0~25 DPA)、次生壁合成(16~45 DPA)、脱水成熟(40~50 DPA)4个独特又互有重叠的阶段[3-4]。纤维长度主要由纤维细胞伸长期决定,这一时期细胞的主要活动是非纤维素多糖如果胶多糖和木葡聚糖、结构蛋白以及少量纤维素等物质的合成并组装形成初生细胞壁;纤维强度主要在次生壁合成期被决定,该时期细胞的主要活动是纤维素(95%)和少量非纤维素多糖的合成及装配形成次生细胞壁[5-6]。
UDP-D-GlcA是植物细胞壁非纤维素多糖的重要前体分子,大约50%的细胞壁物质来源于前体UDP-D-GlcA[7]。植物中合成UDP-D-GlcA的途径有两条[8]:一条是尿苷二磷酸葡萄糖脱氢酶(UDP-glucose dehydrogenase,UGD)途径;另一条是由Loewus等[9]于1962年发现的肌醇加氧酶(myo-inositol oxygenase,MIOX)途径,在此途径中,由D-葡萄糖-6-磷酸(D-glucose-6-phosphate,D-Glc-6-P)经3步转变而来的D-葡萄糖醛酸(D-glucuronicacid,D-GlcA)在葡萄糖醛酸激酶(glucuronokinase,GlcAK)的作用下磷酸化为D-葡萄糖醛酸-1-磷酸(D-GlcA-1-P),之后进一步转变为UDP-D-GlcA。1959年,在绿豆幼苗的可溶性组分中首次发现了GlcAK活性[10];1977年,Leibowitz等[11]报道百合(Lilium longiflorum)花粉GlcAK在MIOX途径中可能具有调控作用;Pieslinger等[12-13]从百合花粉中提纯了GlcAK,并从拟南芥中克隆出了GlcAK基因,其为GHMP(galactokinase,homoserine kinase,mevalonate kinase,phosphomevalonate kinase)[14]超家族成员,在各组织中均能表达,但有花粉偏好性,暗示该基因很可能和细胞壁合成相关;拟南芥GlcAK能够调控GlcA的合成并影响糖代谢,其突变体仅积累了GlcA,输入到细胞壁聚合物中的代谢物减少[15-16]。
本课题组前期利用RNA-seq技术构建了4个海陆栽培棉花品种(系)纤维发育的表达谱[17],发现GlcA K的表达高峰在纤维伸长期,可能参与纤维细胞伸长,且该基因在海岛棉中的表达水平高于陆地棉,作为细胞壁前体UDP-GlcA合成途径中的重要酶,其参与细胞壁发育调控的研究在棉花中尚未见报道。棉花遗传转化周期长,而拟南芥表皮毛发育与棉纤维发育具有相似的分子调控机制[18],利用模式植物拟南芥可以快速有效地初步鉴定纤维伸长发育相关基因的功能。为此,本研究克隆了海岛棉GlcAK基因,通过生物信息学分析、亚细胞定位以及过表达拟南芥表皮毛长度、UDP-GlcA代谢通路相关基因表达和果胶含量分析,初步揭示GbGlcAK调控细胞伸长的机制,为进一步研究其在棉纤维发育中的功能奠定基础。
1 材料与方法
1.1 供试材料和试剂
Columbia生态型拟南芥、海岛棉Pima90-53、陆地棉中棉所8号(CCRI8)、植物表达载体pCamE和pCam::GFP[19]、农杆菌GV3101均由河北农业大学棉花遗传育种研究室提供。
植物总RNA提取试剂盒、普通质粒小提试剂盒(离心柱型)、pGEM-T克隆载体、大肠杆菌Top10感受态细胞均购自天根生化科技(北京)有限公司;UNIQ-10柱式DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司;EASYspin植物RNA快速提取试剂盒购自重庆波尔生物科技有限公司;THUNDERBIRD SYBR®qPCR Mix购自东洋纺(上海)生物科技有限公司;TaqDNA聚合酶、T4 DNA连接酶、限制性内切酶、DNA Marker、PrimerScriptTM单链反转录试剂盒以及其他PCR所用试剂购自宝生物工程(大连)有限公司。
引物(表1)由生工生物工程(上海)股份有限公司合成。测序由北京六合华大基因科技有限公司和生工生物工程(上海)股份有限公司完成。
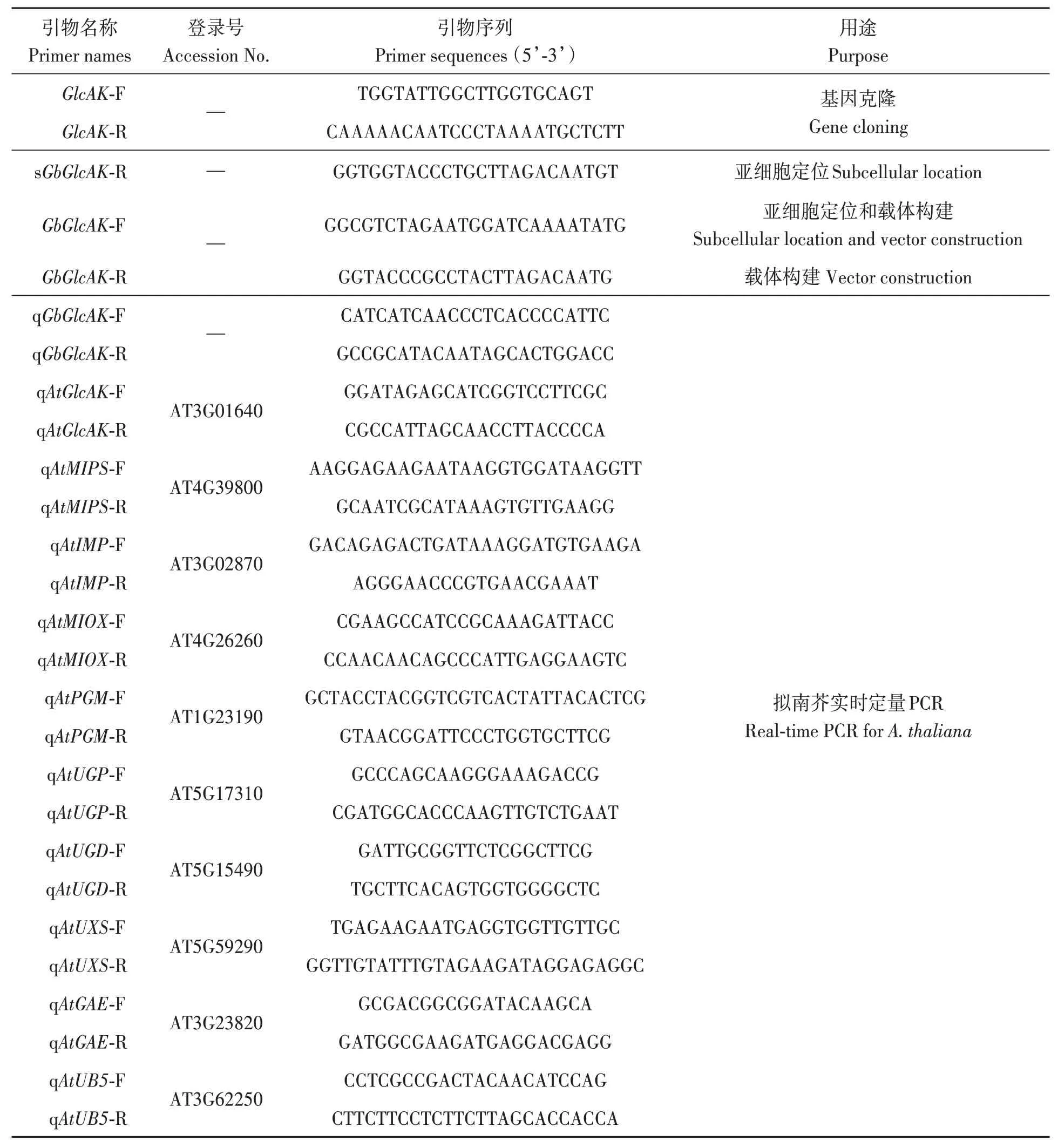
表1 试验中用到的PCR和qPCR引物Table 1 PCR and qPCR primers used in this study
1.2 GbGlcAK的克隆和生物信息学分析
将Pima90-53和CCRI8种植于河北农业大学教学试验中心。收集15 DPA纤维,使用植物总RNA提取试剂盒提取总RNA,参照PrimerScriptTM单链反转录试剂盒说明书合成cDNA。分别以Pima90-53和CCRI8的15 DPA纤维cDNA为模板进行高保真PCR扩增,电泳并回收扩增产物,利用T4 DNA连接酶将回收片段连接至pGEM-T载体,热激转化大肠杆菌感受态细胞Top10,挑取蓝白斑筛选、菌液PCR呈阳性的克隆送测序,测序结果正确的即为携带有海岛棉GlcAK(GbGlcAK)/陆地棉GlcAK(GhGlcAK)ORF序列的载体。引物设计参考Pima90-53和TM-1测序基因组所注释的GlcAK[2,20]。
本文提出的ICSA-ECOC编码方法将最优编码矩阵的构造问题转化为基于免疫克隆选择算法的搜索问题,基于样本知识的亲合度函数和变异交叉操作可加速算法收敛,快速搜索数据感知的紧凑型编码.实验结果说明ICSA-ECOC方法能提高分类精度,并在保证纠错能力的同时最大限度减小编码长度.
通过Pfam网站(http://pfam.xfam.org)[21]分析GbGlcAK蛋白的结构域。利用ExPASy ProtScale在线工具(https://web.expasy.org/protscale)[22]绘制蛋白质肽链亲/疏水性分布曲线。利用TOPpred2(http://sbcb.bioch.ox.ac.uk/TM_noj/TM_noj.html)[23]和TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0)[24-25]预测蛋白跨膜区。利用SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP)[26]预测并分析蛋白信号肽。通过Psort(http://psort1.hgc.jp/form.html)在线预测蛋白亚细胞定位。使用BlastP(v 2.11.0)比对GbGlcAK、GhGlcAK及其他植物GlcAK的氨基酸序列,使用MEGA7.0[27]构建GlcAK的系统进化树。
1.3 GbGlcAK蛋白的亚细胞定位分析
设计引物GbGlcAK-F和sGbGlcAK-R(表1),将GbGlcAKORF序列(去除终止密码子)与pCam::GFP载体连接,构建GbGlcAK的GFP融合表达载体pCam::GbGlcAK-GFP。洋葱上表皮细胞的制备、基因枪转化和荧光观察等操作参照Yang等[28]方法进行。质壁分离试验使用质量浓度为0.3 g·mL-1的蔗糖溶液。
1.4 超表达GbGlcAK拟南芥的获得
将拟南芥种植于装满蛭石的六棱钵中,在温度22~23℃、相对湿度60%~70%、光照周期16 h(光照)/8 h(黑暗)的植物生长室中培养,约每5 d浇1次Hogland营养液。
利用引物GbGlcAK-F/R(表1)将GbGlcAKORF序列连接于表达载体pCamE的多克隆位点Xb aⅠ和KpnⅠ之间。通过冻融法将构建好的载体转入农杆菌GV3101[29]。采用农杆菌介导的蘸花法转化拟南芥[30],经潮霉素筛选(50μg·mL-1,MS培养基)和PCR检测获得超表达GbGlcAK的拟南芥T4代纯合株系用于后续试验。
1.5 拟南芥表皮毛、下胚轴和根的长度测定
取生长4周的拟南芥第6片真叶,在无水乙醇中脱色2 h后,用95%乙醇继续脱至无色,置于Leica DM2500显微镜下观察并采集图像。野生型和每个转基因株系各取8片叶,在250×显微镜下观察叶片中心区域表皮毛,应用ImageJ软件对4个视野中60根表皮毛的最长分支进行长度测量。
用NaClO对拟南芥种子进行消毒后,每3 mm点种1粒种子至1/2 MS固体培养基,22℃持续暗培养5 d,利用Epson V800扫描仪采集图像,应用ImageJ软件测定野生型和转基因株系的下胚轴长度,各取15株。随机选取野生型和转基因植株碘化丙啶染色后利用Olympus FV10i激光扫描显微镜观察下胚轴细胞并拍照;22℃、16 h(光照)/8 h(黑暗)培养6 d,选取正常生长的单株(约30株)测量根长。
1.6 拟南芥UDP-D-GlcA代谢通路相关基因表达分析
使用EASYspin植物RNA快速提取试剂盒提取6周龄拟南芥总RNA,利用PrimerScriptTM单链反转录试剂盒合成cDNA。根据GbGlcAK和AtGl c A K(AT3G01640)的ORF分别设计引物qGbGlcAK-F/R、qAtGlcAK-F/R,以AtUbi quitin5(AT3G62250)为内参[31](表1),利用Bio-Rad CFX96荧光定量PCR仪进行Real-time PCR。反应体系:THUNDERBIRD SYBR®qPCR Mix 10μL,上、下游引物(10μmol·L-1)各1.0μL,cDNA模板1.0μL,ddH2O 7.0μL。反应程序:95℃3 min;95℃10 s,60℃10 s,72℃15 s,40个循环。采用2-ΔΔCT法[32]对基因相对表达量进行分析。
1.7 拟南芥果胶含量测定
称取约2.00 g的6周龄拟南芥,加入5 mL碱性苏打液(2%Na2CO3和0.16%NaOH)研磨,转移至离心管中,沸水浴处理20 min,8 000 r·min-1离心3 min;取上清加入1 mL冰醋酸搅拌混匀,再加入2 mL 25%CaCl2溶液搅拌并沸水浴约10 min以排出CO2,然后8 000 r·min-1离心2 min,弃上清;用0.1%醋酸沉淀4次,每次10 mL;加入10 mL 1%Na2CO3溶液涡旋混匀,沸水浴5 min并不时搅拌,然后8 000 r·min-1离心2 min,弃上清,沉淀用5 mL热蒸馏水冲洗1次;加入10 mL 1%醋酸溶液涡旋混匀,沸水浴5 min并不时搅拌,8 000 r·min-1离心2 min,上清转入锥形瓶中,用10 mL蒸馏水冲洗沉淀,上清并入锥形瓶中的上清;加入5 mL 0.1 mol·L-1特里龙B溶液、5 mL铵缓冲液、50 mg铬黑T,用0.02 mol·L-1MgSO4溶液滴定至指示剂颜色转为酒红色,同样条件下滴定5 mL 0.1 mol·L-1特里龙B溶液作为对照,计算果胶酸含量。

式中,K为硫酸镁溶液的滴定度;a为滴定5 mL 0.1 mol·L-1特里龙B溶液所用的0.02 mol·L-1MgSO4体积(mL);X为分析材料中果胶酸含量(质量分数,%);b为滴定钙(拟南芥样品溶液)时所用去的0.02 mol·L-1MgSO4体积(mL);n为分析材料的质量(g)。
1.8 数据分析
2 结果与分析
2.1 GbGlcAK的克隆和生物信息学分析
以Pima90-53基因组为模板,扩增得到大小约为1 100 bp的基因片段,测序结果与参考基因组序列(GbM_A09 G0397.1)一致,命名为GbGlcAK。以CCRI8基因组为模板扩增,得到与参考基因组序列(GhM_A09G0407.1)一致的基因片段,命名为GhGlcAK。扩增结果结合参考基因组注释表明,在棉花基因组中GlcAK只拥有1个基因座。生物信息学分析显示,GbGlcAKORF长度为1 101 bp,编码366个氨基酸,具有GHMP激酶N(PF00288)和C(PF08544)结构域,属于GHMP超家族成员。肽链的亲/疏水性分布曲线(图1A)显示,GbGlcAK存在较大范围的亲水区,有一定的亲水性,属于可溶性蛋白。GbGlcAK不存在跨膜区(图1B和C),不具有信号肽结构(图1D),表明GbGlcAK是一种非分泌蛋白。
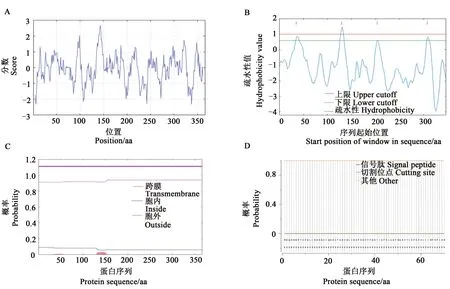
图1 GbGlcAK蛋白特征Fig.1 Characterization of GbGlcAK protein
将GbGlcAK和GhGlcAK以及其他物种的同源基因的蛋白序列进行对比,结果(图2)表明,GbGlcAK与GhGlcAK氨基酸序列相似度为99.2%,在保守区有3个氨基酸的差异,与拟南芥GlcAK氨基酸序列相似度为88.3%,而与蓖麻(Ricinus communis)、葡萄(Vitis vinifera)、毛果杨(Populus trichocarpa)、大豆(Glycine max)、高粱(Sorghum bicolor)、玉米(Zea mays)和水稻(Oryza sativa)GlcAK氨基酸序列相似度分别为90.0%、89.2%、88.7%、86.7%、86.1%、85.3%和84.1%。由系统进化分析可以看出,GlcAK在不同植物间相对保守,与拟南芥GlcAK的亲缘关系最近,并与葡萄、蓖麻和毛果杨GlcAK有较近的亲缘关系。

图2 GbGlcAK系统进化分析Fig.2 Evolutionary analysis of GbGlcAK
2.2 GbGlcAK定位在细胞质
生物信息学预测GbGlcAK可能位于细胞质。为进一步确认,构建了GbGlcAK的GFP融合表达载体,采用基因枪轰击法转化洋葱内表皮细胞,分析GbGlcAK的亚细胞定位。从图3可以看出,不含外源基因的空载体对照pCam::GF P在整个洋葱细胞均能看到绿色荧光,为组成型表达,而融合表达载体pCam::GbGlcAK-GFP的绿色荧光只出现在细胞质中,表明其发挥功能的场所为细胞质,与预测结果一致。

图3 GbGlcAK的亚细胞定位Fig.3 Subcellular localization of GbGlcAK
2.3 超表达GbGlcAK增加了拟南芥表皮毛、下胚轴和根的长度
构建了pCamE-GbGlcAK双元表达载体,利用蘸花法将重组质粒转化野生型拟南芥,随后收获种子(T1)种植于含潮霉素的MS筛选培养基上。10 d后,将正常生根的绿色幼苗移栽到蛭石中继续培养,提取叶片基因组DNA,经PCR检测,获得超表达GbGlcAK的T1阳性植株。继续通过抗性筛选及PCR鉴定获得T4代纯合转基因株系。
取4周龄野生型(WT)和转基因(OE1和OE2)拟南芥第6片莲座叶观察并测量其表皮毛长度,与野生型相比,转基因拟南芥表皮毛长度极显著变长,较野生型分别增加了59.2和62.5μm(图4)。
暗培养5 d的OE1和OE2株系植株下胚轴平均长度分别为15.6和15.5 mm,比野生型(12.3 mm)分别增加了3.3和3.2 mm(图5A和B)。显微观察显示,转基因植株下胚轴细胞比野生型更长(图5C)。
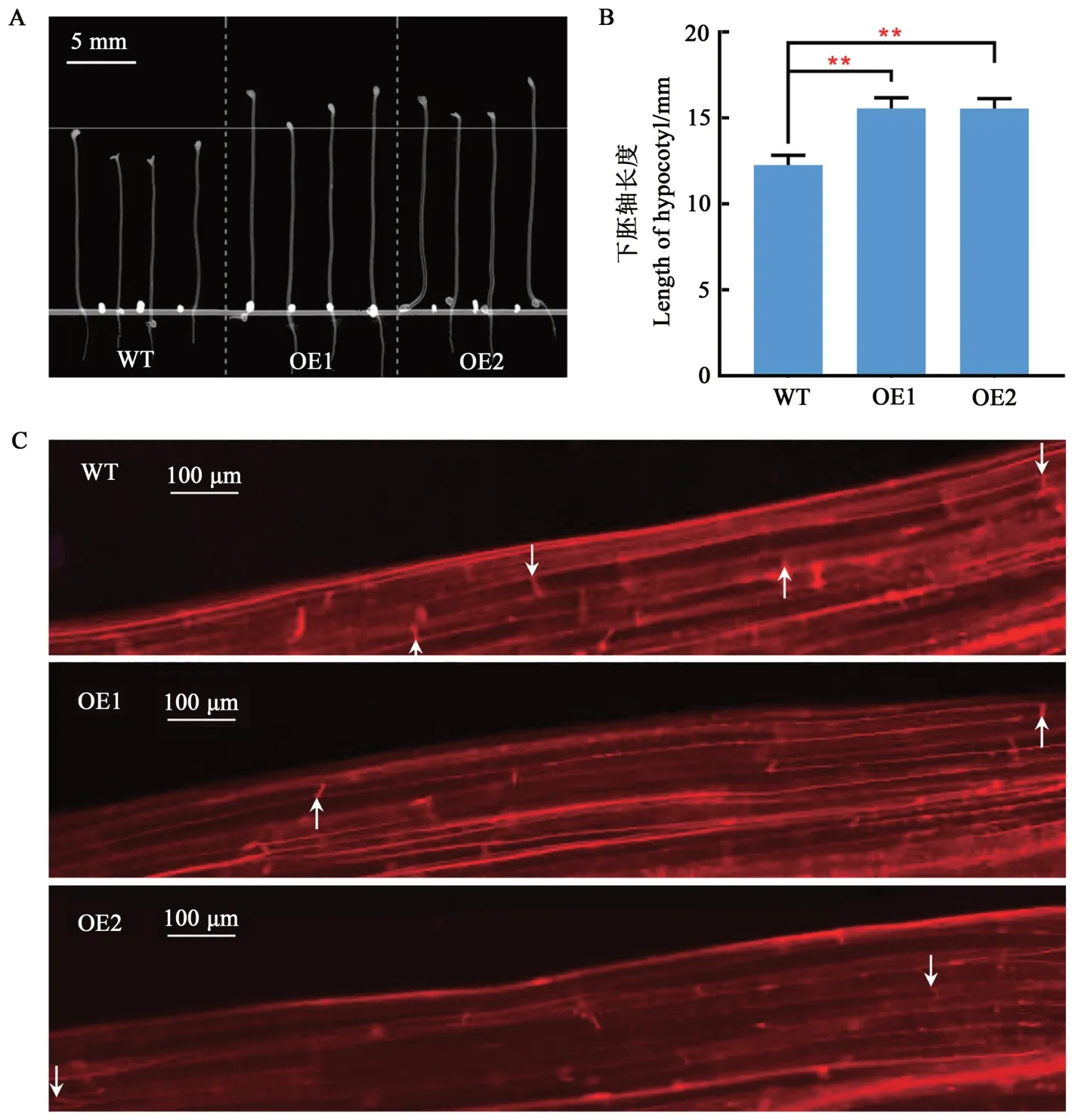
图5 转基因拟南芥下胚轴长度分析Fig.5 Analysis of hypocotyl length in transgenic A.th aliana
生长6 d的OE1和OE2株系植株根平均长度分别为29.8和28.9 mm,均比野生型(26.7 mm)增加,差异达极显著水平(图6)。
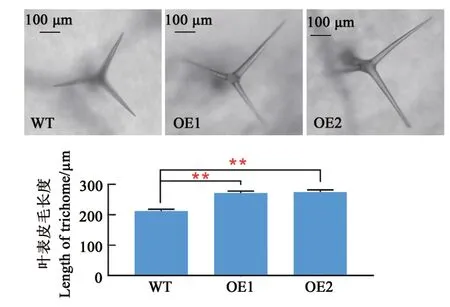
图4转基因拟南芥叶表皮毛长度分析Fig.4 Analysis of leaf trichome length in transgenic A.th aliana
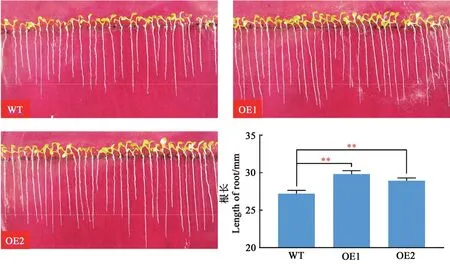
图6 转基因拟南芥根长分析Fig.6 Analysis of root length in transgenic A.thali ana
综合表皮毛、下胚轴和根的研究结果,说明该基因具有促使细胞伸长的作用。
2.4 超表达GbGlcAK上调了UDP-D-GlcA代谢通路相关基因的表达
为明确超表达GbGlcAK拟南芥表皮毛、下胚轴及根长度增加的分子机制,测定了UDP-D-GlcA代谢通路中基因表达水平,结果如图7所示,首先,外源GbGlcAK在转基因株系中均高效转录,转基因拟南芥内源GlcAK比野生型表现出更高的表达水平(分别为19.1和8.4倍);其次,与野生型相比,转基因拟南芥MIOX途径中的磷酸肌醇合酶基因MIPS、肌醇磷酸酶基因IMP以及肌醇加氧酶基因MIO X表达水平上调(1.2~7.5倍);再次,UGD途径中的磷酸葡萄糖变位酶基因P GM、尿苷二磷酸-葡萄糖焦磷酸化酶基因UG P以及尿苷二磷酸-葡萄糖脱氢酶基因UGD在转基因拟南芥中的表达水平极显著高于野生型(10.6~19.7倍);最后,UDP-D-GlcA的下游代谢相关基因尿苷二磷酸-木糖合成酶基因UX S和尿苷二磷酸-葡萄糖醛酸异构酶基因GA E在转基因拟南芥中的表达水平也有所增加(1.6~7.2倍)。上述结果说明,超表达GbGlcAK促进了UDP-D-GlcA合成和转变代谢通路中相关基因的表达。
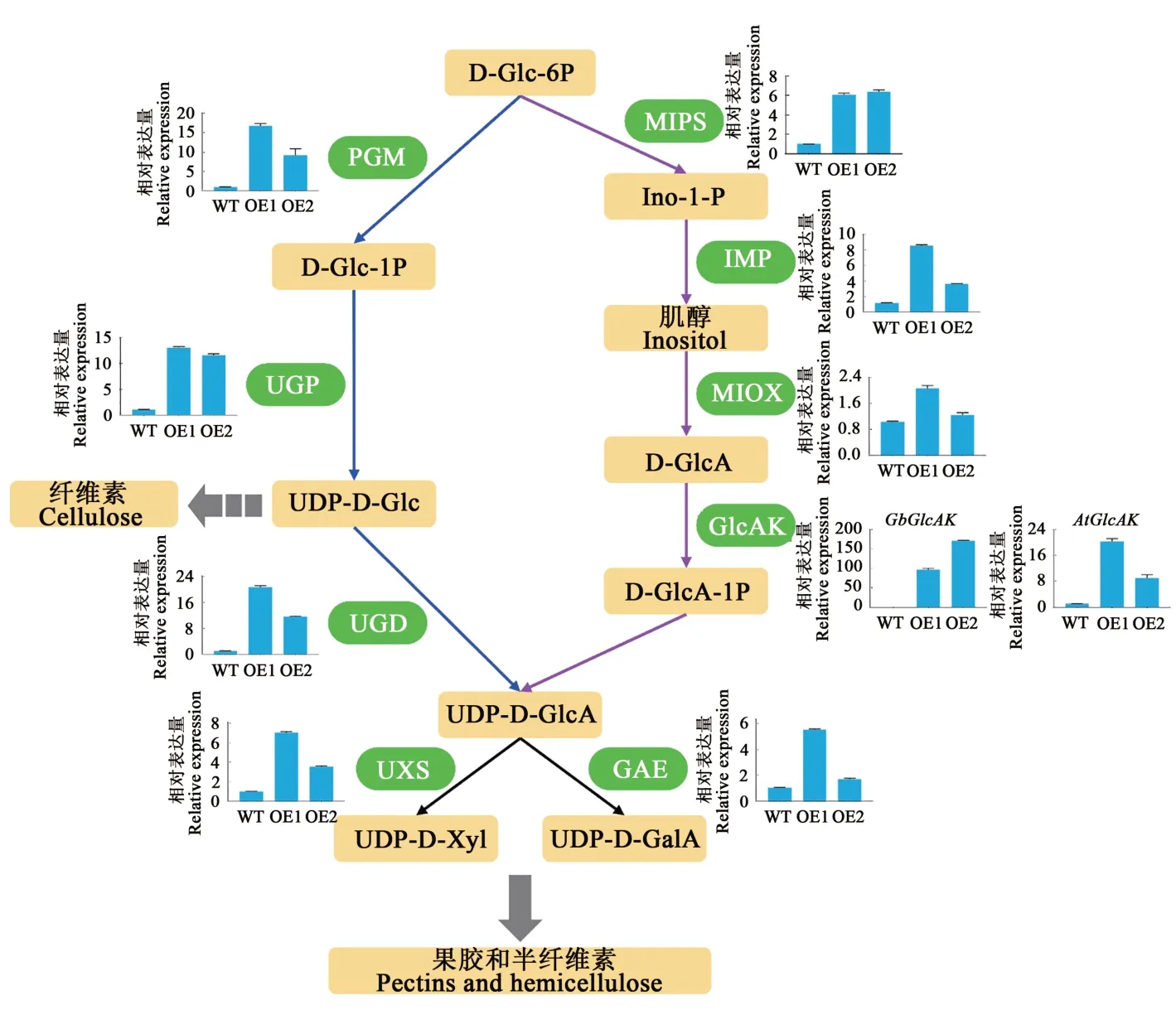
图7 转基因拟南芥中UDP-D-GlcA代谢相关基因的表达分析Fig.7 Expression analyses of UDP-D-GlcA metabolism related genes in transgenic A rabidopsis
2.5 超表达GbGlcAK使细胞果胶含量增加
为明确超表达GbGlcAK拟南芥表皮毛、下胚轴及根长度增加的生理生化机制,比较了转基因拟南芥和野生型的果胶含量差异(图8),发现两个转基因拟南芥株系的果胶含量均显著提高,其中,OE1果胶含量为23.13%,OE2株系果胶含量为23.40%,分别比野生型WT(19.15%)增加了21%和22%。该结果明确说明超表达GbGlcAK提高了细胞果胶含量。
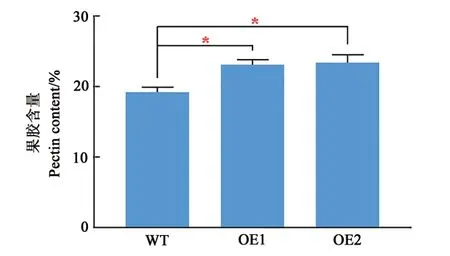
图8 转基因拟南芥果胶含量Fig.8 Pectin content in transgenic A rabid opsi s
3 讨论
陆地棉在全世界棉花的种植面积大于90%,但其纤维长度、强度、细度等不及海岛棉。研究海岛棉中纤维发育相关基因,能够为陆地棉纤维品质改良提供理论参考[33]。同为特化的表皮细胞,拟南芥叶表皮毛发育和棉纤维发育的调节机制部分相同[34-37],此外,拟南芥下胚轴的生长是由于细胞伸长而不是分裂[38-39],因此可以利用拟南芥来高效初步解析棉纤维发育相关基因的功能,从而为棉纤维品质改良尤其是长度的改良提供理论参考。基于课题组前期转录组测序数据,发现1个编码葡萄糖醛酸激酶的基因GlcAK,其在除起始期之外的其他纤维发育时期高表达,特别是其在海岛棉中的表达高于陆地棉,表明该基因与纤维品质的形成密切相关。本研究中,超表达GbGlc AK的拟南芥的叶表皮毛长度增加、下胚轴和下胚轴细胞长度变长、根长变长,表明GbGlcAK确实具有促进细胞伸长的功能。
UDP-D-GlcA作为细胞壁非纤维素多糖的重要前体,其合成和转变代谢通路MIOX途径、UGD途径及下游途径中相关基因的表达和细胞壁非纤维素多糖的沉积密切相关[40],直接影响植物细胞壁的形态建成,影响棉纤维的品质。本研究在拟南芥中过表达GbGlcAK后,拟南芥内源GlcAK表达水平极显著上调,可能是由于外源GbGlcAK的高表达引起了上游MIOX基因表达量的增加,从而使得内源GlcAK随之高表达。UGD途径中相关基因的表达水平也大幅上调,可能是因为GlcAK的高表达诱使两途径共同上游基因转录水平提高。MIOX和UGD途径基因表达量的共同上调使得其下游GAE和U XS表达量亦显著增加。综上,GbGlcAK通过上调UDP-D-GlcA合成和转变代谢通路中基因的表达来促进细胞伸长。
快速伸长的纤维细胞壁含有较多的果胶成分,向组织培养液中加入果胶前体核苷糖,如醛酸糖UDP-GlcA、UGP-GalA或中性糖UGP-Rha,能显著促进纤维的伸长,说明果胶合成在纤维伸长即初生壁形成过程中具有重要作用[41]。研究表明,肌醇能被拟南芥幼苗摄入并通过MIOX途径生成UDP-GlcA,从而为细胞壁建成主要是果胶多糖的合成提供足够的必要前体,萌发中的百合花粉将雌蕊分泌物中的肌醇大部分整合进新生花粉管细胞壁的果胶聚合物中[42],GlcAK参与细胞壁主要物质—果胶的合成[43]。本研究中,超表达GbGlcAK拟南芥植株果胶含量比野生型显著提高。结合表型结果和基因表达分析结果可知,GbGlcAK的过量表达使UDP-GlcA代谢通路中基因表达水平上升,进而增加细胞壁果胶含量,最终促进了细胞伸长。
本研究对GlcAK表达模式进行了分析,挖掘了GbGlcAK促进细胞伸长的分子和生理生化机制,证明GbGlcAK能够影响植物细胞壁构成,其是否能够切实促进棉纤维细胞伸长尚需更多证据,又是否在棉纤维细胞壁强度的增加中发挥重要作用也值得深入研究。对该基因功能的进一步解析,将丰富对GbGlcAK调控棉纤维发育、细胞壁发育以及棉花纤维品质形成的认识。
