免疫抑制治疗患者罹患皮肤非结核分枝杆菌感染二例
2022-08-20周顺婷窦舒慧蔡艳霞谢锦莹黄闽嘉
周顺婷 吴 玮 窦舒慧 蔡艳霞 李 定 谢锦莹 祝 玉 祝 瑶 黄闽嘉
广东医科大学附属医院皮肤科,广东湛江,524000
临床资料患者1,女,28岁。因“皮肤多处结节、溃疡伴发热1个月余”于2018年10月就诊。患者1个月余前无明显诱因面部、四肢、手足部相继出现红色结节,伴疼痛,部分结节化脓破溃,伴双手掌指关节肿胀、疼痛,伴间断性发热,最高体温38℃。无畏寒,无咳嗽、咳痰、咯血,无面部红斑和下肢水肿。拟诊狼疮性肾炎在我院肾内科住院治疗。既往史:2016年诊断为系统性红斑狼疮、Ⅵ型狼疮性肾炎,予腹膜透析、糖皮质激素及免疫抑制剂长期治疗,本次就诊时服用吗替麦考酚酯1.0 g/d,羟氯喹400 mg/d,泼尼松15 mg/d治疗,病情稳定。否认肝炎、结核等传染病史,否认外伤史和动物接触史。
体格检查:一般情况可,全身未触及浅表淋巴结肿大。皮肤科检查:左上肢、左足底可见多个绿豆至硬币大结节,大部分表面破溃,覆少量脓性分泌物(图1a、1b);右手拇指见一绿豆大溃疡(图1c);面部、左踝部、右大腿内侧见多个黄豆至蚕豆大结节,表面无破溃,压痛明显(图1d、1e)。双手掌指关节红肿,有压痛,表面皮温不高(图1f)。辅助检查:血常规:RBC 2.75×1012/L[正常值(4.0~5.5)×1012/L],HGB 80.8 g/L(110~150 g/L);血沉:76 mm/h(0~37 mm/h),C反应蛋白:23.10 mg/L(0.00~8.00 mg/L);肾功能:肌酐 615.0 μmol/L(110~150 μmol/L),尿素 11.28 mmol/L(2.76~8.07 mmol/L);补体C3 0.77 g/L(0.79~1.52 g/L)。补体C4、抗核抗体系列、抗链球菌溶血素O、类风湿因子、HIV抗体、梅毒二项(RPR、TPPA)、乙肝丙肝抗原抗体、血细菌培养、肝功能均正常。胸部CT平扫:1.双肺上叶及下叶背段多发小结节;2.双侧少量胸腔积液。
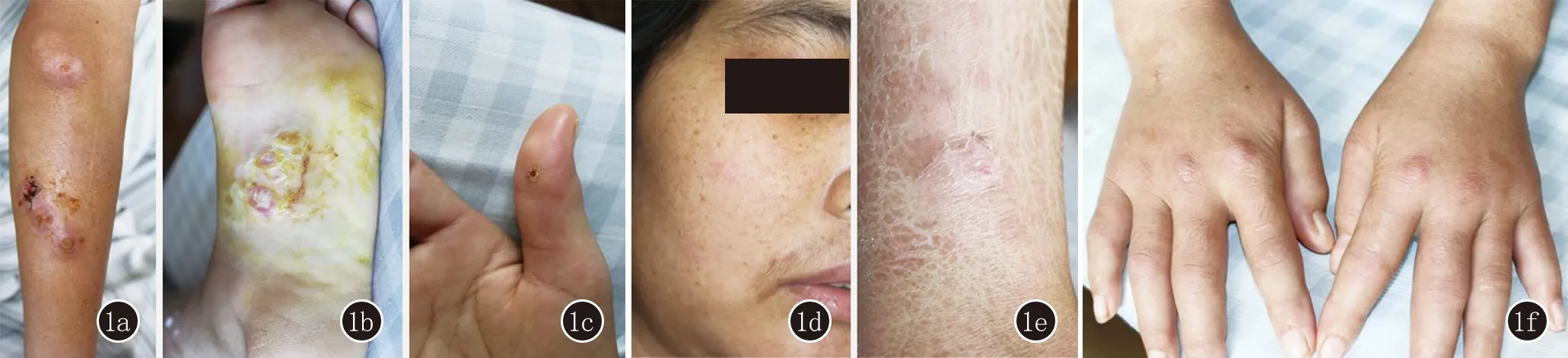
图1 1a,1b:左上肢、左足底可见多个绿豆至硬币大结节,大部分表面破溃,覆少量脓性分泌物;1c:右手拇指见一绿豆大溃疡;1d,1e:面部、左踝部见多个黄豆至蚕豆大结节,压痛明显;1f:双手掌指关节红肿,有压痛
初步诊断:1.狼疮性肾炎(活动期);2.狼疮性脂膜炎?予泼尼松加量至30 mg/d,余药物剂量不变。治疗1个月后病情未见明显好转。遂请皮肤科会诊,行皮肤病理活检。皮损组织病理示:真皮及皮下组织内以中性粒细胞为主的浸润,形成中性粒细胞微脓肿,周围见多量组织细胞和散在淋巴细胞浸润,呈感染性肉芽肿改变(图2a、2b)。抗酸染色:真皮浅中层见大量呈球状及束状分布的紫红色短粗弯曲杆菌(图2c)。PAS染色阴性。提取皮损组织DNA行PCR扩增hsp65基因和16S rRNA基因后测序,结果与GenBank中的序列比对符合嗜血分枝杆菌。皮损组织行病原高通量基因检测:嗜血分枝杆菌(序列数:26051)。最终诊断:1.皮肤嗜血分枝杆菌感染;2.系统性红斑狼疮,狼疮性肾炎。治疗:予减量糖皮质激素及免疫抑制剂,环丙沙星500 mg 日1次、克拉霉素500 mg 日2次、异烟肼300 mg 日1次抗感染。治疗1个月后无发热,皮肤溃疡明显好转。继续服药1年后停药,皮损消失遗留瘢痕(图3)。

图2 2a、2b:真皮及皮下组织内以中性粒细胞为主的浸润(红色箭头),见中性粒细胞微脓肿,周围见多量组织细胞(白色箭头)和散在淋巴细胞浸润(HE,2a:×100;2b:×200);2c:真皮浅中层见大量呈球状、束状及散在的紫红色弯曲短棒杆菌(抗酸染色,×1000)
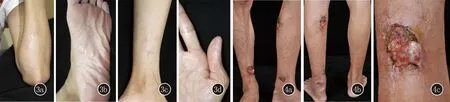
图3 治疗1年后随访,原有皮损处瘢痕愈合 图4 4a、4b:左小腿屈侧、双侧踝部见4处溃疡,直径约3~5 cm不等;4c:溃疡表面见肉芽增生和脓血样分泌物,上覆厚痂
患者2,男,27岁。因“双下肢溃疡伴疼痛3个月余”于2021年6月就诊。患者3个月余前无明显诱因左小腿出现一处糜烂、渗液,伴瘙痒,缓慢发展至双侧踝部,出现4处糜烂和溃疡,并出现肉芽增生和结痂,伴脓血样分泌物,疼痛明显。无畏寒、发热,无咳嗽、咳痰,无腹痛、腹泻,无体重减轻。拟诊皮肤感染收入我科。既往史:7年前因“慢性肾衰竭”于外院行同种异体肾移植术,术后规律服用他克莫司胶囊3.5 mg/d、吗替麦考酚酯片1.5 g/d、美卓乐8 mg/d抗排斥治疗至今。否认肝炎、结核等传染病史,否认外伤史,否认土壤及家禽接触史。
查体:一般情况可,全身未触及浅表淋巴结肿大。皮肤科检查:左小腿屈侧、双侧踝部见4处溃疡,直径约3~5 cm不等,表面见肉芽增生、脓血样分泌物,部分上覆厚痂,触之易出血,压痛明显(图4)。实验室检查:血常规:WBC 3.25×109/L[(4.0~10.0)×109/L],RBC 2.5×1012/L[(4.0~5.5)×1012/L],HGB 68 g/L(110~150 g/L);C反应蛋白:12.60 mg/L(0.00~8.00 mg/L);肾功能:肌酐246.0 μmol/L(42.0~97.0 μmol/L),尿素 13.71 mmol/L(2.76~8.07 mmol/L)。肝功能、抗链球菌溶血素O、类风湿因子、HIV抗体、梅毒二项、乙肝丙肝抗原抗体均正常。胸部CT平扫:1.左肺下叶背段磨玻璃结节,考虑偏良性结节可能性大;2.右肺中叶少许炎症、纤维灶,伴邻近局部胸膜粘连;右肺上叶尖段及前段少许纤维化灶、增殖灶。皮损组织病理示:见一溃疡,表面脓痂,真皮弥漫水肿,血管增生。真皮浅中层大量中性粒细胞及散在嗜酸粒细胞、浆细胞和淋巴组织细胞浸润,可见多核巨细胞。真皮深层见胶原纤维增生(图5)。抗酸染色阴性。PAS染色阴性。
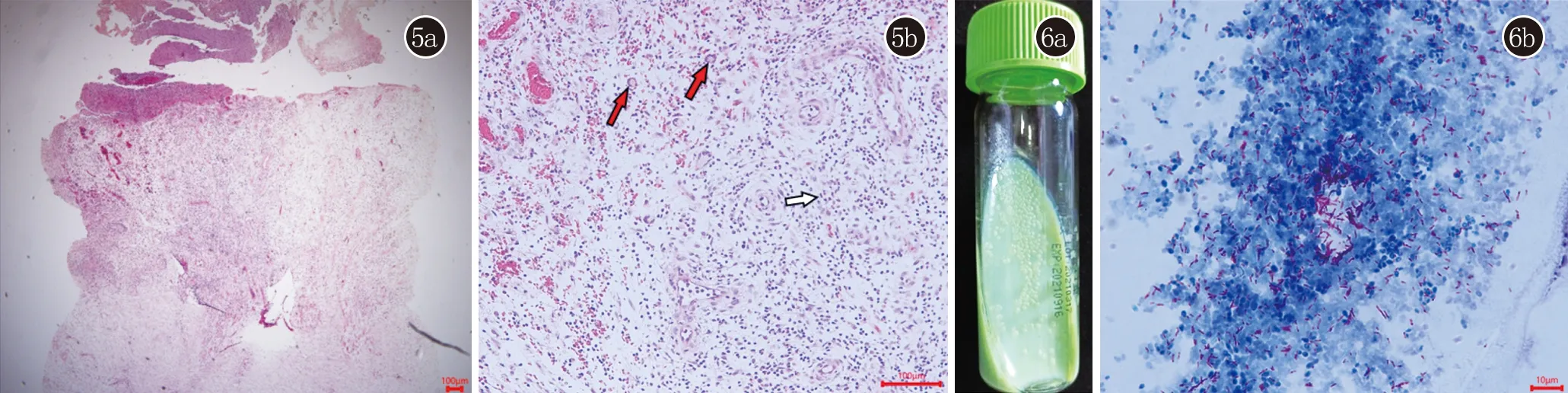
图5 5a:真皮弥漫水肿,真皮深层见胶原纤维增生(HE,×40);5b:真皮内见血管增生,大量中性粒细胞(白色箭头)及散在嗜酸粒细胞、浆细胞和淋巴组织细胞浸润,见多核巨细胞(红色箭头)(HE,×200) 图6 6a:皮损组织酸性培养基32℃培养4周见光滑、黄白色菌落;6b:菌落涂片见大量紫红色短棒状杆菌(抗酸染色,×1000)
皮肤组织DNA微阵列芯片(晶芯,产品批号:20210201)行分枝杆菌菌种鉴定:鸟分枝杆菌。皮损组织培养4周后见光滑、黄白色菌落(图6a)。菌落抗酸染色涂片见大量紫红色短棒状杆菌(图6b)。菌落16S rDNA全序列测序结果符合鸟分枝杆菌。
最终诊断:1.皮肤鸟分枝杆菌感染;2.同种异体肾移植术后。患者拒绝治疗要求出院,自行换药处理溃疡。3个月后患者复诊,溃疡数量增多,聚集在双小腿下1/3处,大部分形成脓肿,自行破溃形成深在溃疡,部分表面见少量黄白色脓性分泌物(图7)。予乙胺丁醇750 mg日1次、克拉霉素250 mg日2次、利福平450 mg日1次抗感染治疗,目前正在随访中。
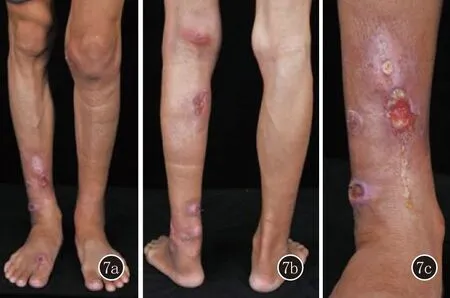
图7 腘窝、小腿和踝部见约10余处脓肿、溃疡,部分表面见少量黄白色脓性分泌物
讨论非结核分枝杆菌(nontuberculous mycobacteria, NTM)是指除结核杆菌复合群和麻风杆菌以外的所有分枝杆菌,约150余种,广泛存在于水、土壤、家禽、鱼类等中,是人类的机会致病菌[1]。非结核分枝杆菌的易感人群包括获得性免疫缺陷病(HIV感染者)、器官或骨髓移植受者、恶性肿瘤及自身免疫性疾病患者、长期使用生物制剂者,以及少部分免疫功能正常的儿童和老年患者[2,3]。第五次全国结核流行病学调查结果显示NTM在分枝杆菌分离株中占22.9%,较之前明显升高。中国医学科学院皮肤病研究所2008-2017年皮肤感染分枝杆菌共203例患者,其中114例为非结核分枝杆菌感染[4]。梅奥诊所回顾2000-2015年经培养确诊的10例嗜血分枝杆菌感染患者,均为皮肤及软组织感染,其中9例在感染前长期使用免疫抑制剂、糖皮质激素或生物制剂[5]。本文2例患者一例为狼疮性肾炎患者,另一例为同种异体肾移植患者,二者均长期服用吗替麦考酚酯(MMF)等免疫抑制剂治疗,符合 NTM易感人群。
免疫功能低下的成年人感染嗜血分枝杆菌最常见的是皮肤症状,表现为无痛性丘疹、结节,逐渐演变为疼痛性溃疡、脓肿,可表现为淋巴管型孢子丝菌病样分布;部分患者可发生关节疼痛和肿胀。嗜血分枝杆菌需要低温生长,皮损常分布于四肢、关节等部位[6]。本文患者1就诊时四肢远端、面部和手足部出现结节和溃疡,与陈浩等[7]报道的2例长期服用免疫抑制剂患者皮肤感染嗜血分枝杆菌的临床表现类似。本例患者就诊时伴随低热和双手掌指关节肿痛,起初误诊为狼疮活动。明确NTM感染后,积极抗感染治疗和减量糖皮质激素,发热及掌指关节肿痛消退,考虑为嗜血分枝杆菌感染所致的关节炎。因此对于长期服用免疫抑制剂的SLE患者出现发热、皮疹和关节痛,需要鉴别是狼疮活动还是皮肤感染。患者皮肤出现结节、溃疡,还应注意与狼疮性脂膜炎鉴别,后者常发生于狼疮活动期,好发于面颊部、臀部等脂肪丰富部位,表现为红斑基础上的皮下结节、溃疡,病理表现为小叶性或间隔性脂膜炎等。而本例患者皮损多见于四肢末端,病理表现为感染性肉芽肿,故可相鉴别。
鸟分枝杆菌感染常累及肺部及消化道,表现为畏寒、发热、盗汗、腹泻、淋巴结肿大等。单纯皮肤损害少见,皮疹包括多发溃疡、结节、脓肿、脂膜炎等。本文2例鸟分枝杆菌感染患者无内脏损害,仅出现双下肢多发的疼痛性脓肿和溃疡,皮损组织病理表现为大量中性粒细胞浸润,需与坏疽性脓皮病相鉴别,后者病理上无多核巨细胞及组织细胞浸润等感染性肉芽肿改变,故可排除。国内文献报道了3例皮肤鸟分枝杆菌感染的患者,1例为肺部首发,随后播散至皮肤感染[8];另2例仅有皮肤表现,其中1例有外伤史,考虑外伤后鸟分枝杆菌的机会性感染[9],1例胸部CT示肺部渗出灶及纵隔淋巴结肿大,猜测为隐匿肺部感染播散至皮肤所致感染[10]。而本例患者无系统受累症状,胸部CT未见渗出,仅双小腿皮肤的损害,考虑为原发于皮肤的鸟分枝杆菌感染。Falkinham等曾报道在患者家庭水源和淋浴头中分离出定植的鸟分枝杆菌,与其感染的鸟分枝杆菌同源。本例患者否认外伤史及土壤、动物接触史,因此推测水源接触所致感染的可能性大。
文献报道[3]免疫抑制宿主皮肤和软组织感染中最常见的慢生长分枝杆菌为鸟分枝杆菌、嗜血分枝杆菌和海分枝杆菌,因此对于免疫抑制的患者怀疑皮肤NTM感染时,应首先考虑到这3种分枝杆菌。嗜血分枝杆菌需要低温及补充血或铁的培养基中才能生长,因此皮损组织培养时需要准备两种培养基:普通分枝杆菌培养基和含铁的分枝杆菌培养基,同时取皮损组织培养行分子生物技术鉴定NTM菌种,避免漏诊。
不同种类NTM的药物敏感性有一定差异,因此鉴定出NTM菌种后需要根据其药敏结果或抗菌谱进行治疗,通常需2~3种抗菌药物联合应用。对于长期免疫抑制治疗的患者应尽量减少免疫抑制剂用量,改善患者免疫功能。嗜血分枝杆菌感染常用的抗感染药物为克拉霉素、环丙沙星、利福平,疗程一般持续12~24个月[11]。本文患者1三联抗感染治疗1年后皮损愈合。文献推荐鸟分枝杆菌感染的治疗药物为克拉霉素、乙胺丁醇、利福霉素联合用药,推荐疗程为6~12个月[11]。而本例鸟分枝杆菌感染患者明确诊断后未行有效抗感染治疗,仅自行换药治疗,3个月时间脓肿和溃疡数量明显增多和聚集分布,因此对免疫抑制状态的患者皮肤NTM感染后必须积极治疗。
总之,临床工作中遇到处于免疫抑制状态的患者出现皮肤结节、脓肿和溃疡时,应考虑到皮肤NTM感染。尽早完善病理活检、皮损组织培养和相关分子生物学鉴定明确诊断,确诊后早期、足量、联合、足疗程抗感染治疗,并根据基础病情况减量后停用免疫抑制剂[3,12]。
