依巴斯汀通过抑制AKT/mTOR通路诱导人黑素瘤细胞自噬
2022-08-20王颖超李明明党宁宁
张 平 王 静 王颖超 倪 莉 李明明 党宁宁
1山东大学齐鲁医学院,济南,250012;2山东大学附属济南市中心医院,济南,250013;3滨州医学院附属医院皮肤科,滨州,256600;4山东第一医科大学附属省立医院,济南,250021
黑素瘤源于黑素细胞的恶性转化,是成人中第五种最常见的癌症,也是恶性程度最高的皮肤癌[1]。黑素瘤的发病率具有明显的种族差异性,发病率在浅肤色人群中最高,黄种人和黑种人中较低[2]。但统计数据显示,近年来黑素瘤的发病率一直以6%~7%的年增长率持续上升[3],引起大家的广泛关注。目前对于发现的早期黑素瘤可以通过手术切除,但晚期的通常无法治愈[4]。对于Ⅲ期和Ⅳ期的黑素瘤患者通常采取手术切除、放化疗和免疫治疗等联合治疗的方式,但最终的治疗效果并不理想,预后差。因此,寻找新的治疗药物是临床医生迫切需要解决的问题。依巴斯汀(Ebastine)是使用最广泛的第二代组胺H1受体拮抗剂,对组胺及其他类型炎症介质的释放有一定的抑制作用,主要用于治疗变应性疾病,包括支气管痉挛,过敏性鼻炎和皮肤瘙痒症等[5-7],特别是与中草药联合后对慢性荨麻疹进行治疗,获得满意的效果[8]。有研究表明,依巴斯汀还可以有效抑制多种癌细胞的增殖、迁移等生物学行为,显著降低死亡率,有效逆转乳腺癌、非小细胞肺癌等多种肿瘤的多重耐药[9,10],但在黑素瘤中的作用尚未见相关报道。自噬是一种高度保守的溶酶体降解途径,在自噬相关基因的调控下降解自身物质和受损细胞器,实现胞内物质的自我更新和再利用。目前研究发现,自噬与肿瘤的发生发展有着密切的关系[11]。自噬在黑素瘤的发生中起着双重作用,在黑素瘤发生的早期,自噬通过诱导细胞衰老而抑制肿瘤的发生;在黑素瘤晚期阶段,自噬活性增强为肿瘤的生长提供营养物质和有利的生存环境[12]。本研究旨在通过观察依巴斯汀对人黑素瘤细胞A375和M14自噬的诱导作用以及对于AKT/mTOR信号通路的影响,为以后探索依巴斯汀的抗癌作用提供更多的证据。
1 材料与方法
1.1 实验材料 A375细胞和M14细胞(中国医学科学院肿瘤细胞库);依巴斯汀(Ebastine)、3-MA(纯度>99%,Selleck公司);DMEM培养基,PBS,青链霉素混合液,胰蛋白酶-EDTA消化酶(凯基生物);转染试剂Lipo2000、细胞计数板(赛默飞Invitrogen);mCherrry-EGFP-LC3B双荧光质粒(淼灵质粒平台);胎牛血清(Gibco); RIPA裂解液(SparkJade);CCK-8试剂、GAPDH、P62、Beclin1、AKT、mTOR抗体(PTG公司);LC3B、p-AKT、p-mTOR抗体(CST公司)。
1.2 实验方法
1.2.1 药物配制 依巴斯汀用无水乙醇溶解成10 mM母液-80℃储存,用DMEM培养液(不含血清和抗生素)配制成所需浓度,50℃水浴锅中溶解。
1.2.2 细胞培养 将人恶性黑素瘤细胞A375和M14接种于完全DMEM培养基中(10%胎牛血清,100 U/L青霉素和100 μg/mL链霉素),在37℃,5% CO2恒温培养箱中培养,选择对数生长期的细胞进行实验。
1.2.3 细胞增殖实验 选取对数生长期的细胞进行处理,PBS清洗两遍,用含EDTA的0.25%的胰蛋白酶处理,待细胞消化充分,镜下观察,细胞形态变圆后弃掉胰酶,用2 mL培养液进行重悬,利用细胞计数仪计数,取5×104/mL细胞接种于96孔板。培养箱中培养过夜后,弃掉原培养基,对照组加入完全DMEM培养基,实验组分别加入含0.78、1.56、3.12、6.25、12.5、25、50 μmol/L依巴斯汀的培养基,每个浓度设置3个复孔,置于培养箱中培养24 h, 每孔加入10 μL CCK-8溶液。培养箱中继续培养2 h,用酶标仪测定450 nm处的光密度(OD),根据公式细胞活力(%)=(实验组OD-调零组OD)/(对照组OD-调零组OD)×100%,计算依巴斯汀对黑素瘤细胞A375和M14的半数抑制浓度IC50。同上方法铺好96孔板后,对照组加入完全DEME培养基,实验组加入合适浓度的依巴斯汀,分别在0、24、48、72 h测定450 nm处吸光值,绘制生长曲线,观察依巴斯汀对细胞活力的影响。
1.2.4 mCherry-EGFP-LC3B双荧光质粒检测人黑素瘤细胞自噬流 在6孔板中先铺好玻片,将细胞以培养过夜后密度达到60%的标准接种于6孔板,培养箱中培养过夜,用Lipo2000转染mCherry-EGFP-LC3B双荧光质粒(质粒∶脂质体=1∶2)。转染24 h后,进行加药处理,设置对照组:依巴斯汀(0 μmol/L);依巴斯汀组:4 μmol/L;3-MA组:(5 mmol/L)3-MA;依巴斯汀+3-MA组:依巴斯汀(4 μmol/L)+3-MA(5 mmol/L),培养箱培养24 h。PBS清洗3遍后,甲醛固定液固定20 min,再次PBS清洗3次, 5 min/次,用镊子取出玻片后反扣在滴加了防淬灭剂的载玻片上,封片,使用激光共聚焦显微镜观察荧光斑点数量。
1.2.5 Western blot检测自噬相关及AKT/mTOR通路相关蛋白 选取对数生长期细胞接种于6孔板中,培养过夜。按照1.2.4分为对照组/依巴斯汀组/3-MA组/依巴斯汀+3-MA组进行加药,处理24 h后提取蛋白。另外,设置0、2、4 μmol/L的依巴斯汀对黑素瘤细胞进行处理24 h后收取蛋白,用于验证通路蛋白的表达。PBS清洗3次后,每孔加入300 μL RIPA裂解液(+蛋白酶抑制剂),冰上裂解5 min,混匀仪20 min,4℃离心机12000 r/min,10 min后吸取上清液,与Loading buffer(4×)按比例混合,100℃变性后通过SDS-PAGE电泳分离。将分离的蛋白质在110 V,90 min的转膜条件下转移至PVDF膜上,5%脱脂牛奶封闭1 h,TBST洗膜后在相应一抗孵育液中4℃过夜,次日拿出复温1 h,TBST清洗3次后,以1∶4000的比例孵育相应的二抗,室温1 h,再次用TBST清洗3次,5 min/次。洗膜后使用化学发光液进行显影,利用 Image J软件分析各条带的灰度值,计算目的蛋白与内参蛋白的灰度比值。
1.2.6 统计学方法 所有实验数据均是重复3次后统计所得,Western blot采用Image J扫描灰度并统计所得,以(x±s)表示,采用SPSS 19.0统计软件处理数据,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 依巴斯汀在人黑素瘤细胞A375和M14中IC50的测定 CCK-8细胞增殖实验结果显示:依巴斯汀对黑素瘤细胞A375和M14的抑制呈剂量依赖性。随着依巴斯汀药物浓度的增加,与对照组相比较,黑素瘤细胞活力明显降低。在A375和M14细胞中依巴斯汀的IC50根据公式计算可得分别是3.353 μmol/L和3.785 μmol/L(图1)。本研究选取2.0 μmol/L和4.0 μmol/L依巴斯汀开展后续实验。
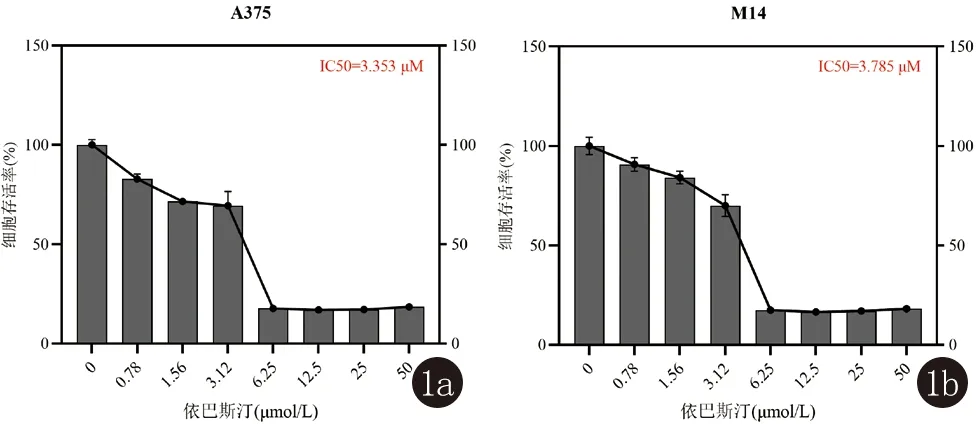
图1 CCK-8法测定依巴斯汀在人黑素瘤细胞中的半数抑制浓度IC50
2.2 依巴斯汀对人黑素瘤细胞A375和M14活力的影响 CCK-8实验结果显示:与对照组相比,当人黑素瘤细胞经过2 μM依巴斯汀处理后,其OD值明显降低,提示依巴斯汀可以显著降低人黑素瘤细胞的活力(图2)。
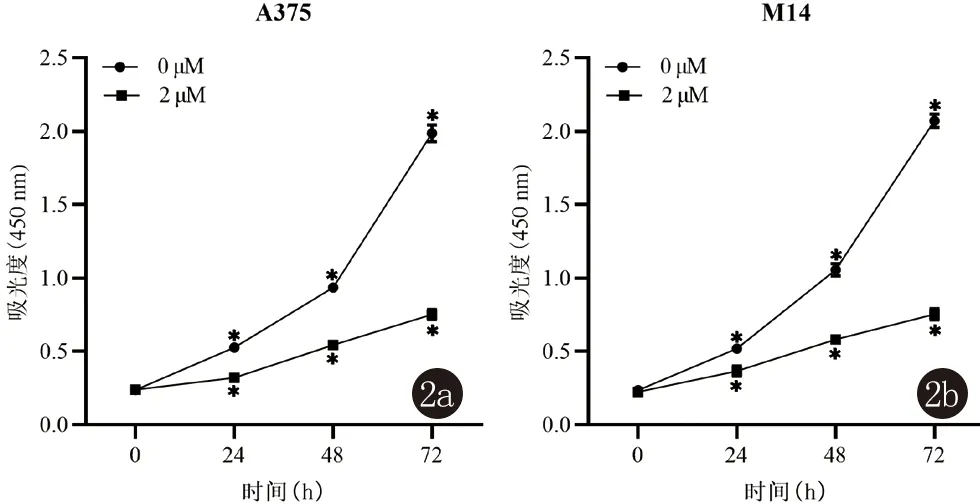
图2 CCK-8法测定依巴斯汀对人黑素瘤细胞活力的影响(与对照组比较:* P<0.05)
2.3 依巴斯汀对人黑素瘤细胞自噬流的影响 在自噬早期,mCherry-EGFP-LC3B融合蛋白从胞质聚集至自噬小体的膜结构上,呈现明亮的黄色斑点,一个黄色斑点代表一个自噬小体;然后,自噬小体和溶酶体发生融合,PH值降低,绿色荧光蛋白在低PH环境下发生淬灭,而红色的荧光蛋白则可以耐受酸性环境,不会发生降解,此时的红色斑点即可代表自噬溶酶体的数量。3-MA(3-甲基腺嘌呤)是一种选择性PI3K抑制剂,作用于Vps34和PI3Kγ,阻断自噬小体与溶酶体的结合,抑制自噬溶酶体的形成[13]。mCherry-EGFP-LC3B荧光结果显示:与对照组相比,依巴斯汀组黄色荧光斑点和红色荧光斑点均明显增多即自噬小体和自噬溶酶体的数量均显著增加(P<0.05),3-MA组和依巴斯汀+3-MA组变化不明显;与依巴斯汀组相比,3-MA组和依巴斯汀+3-MA组自噬小体和自噬溶酶体数量明显减少(P<0.05)(图3)。
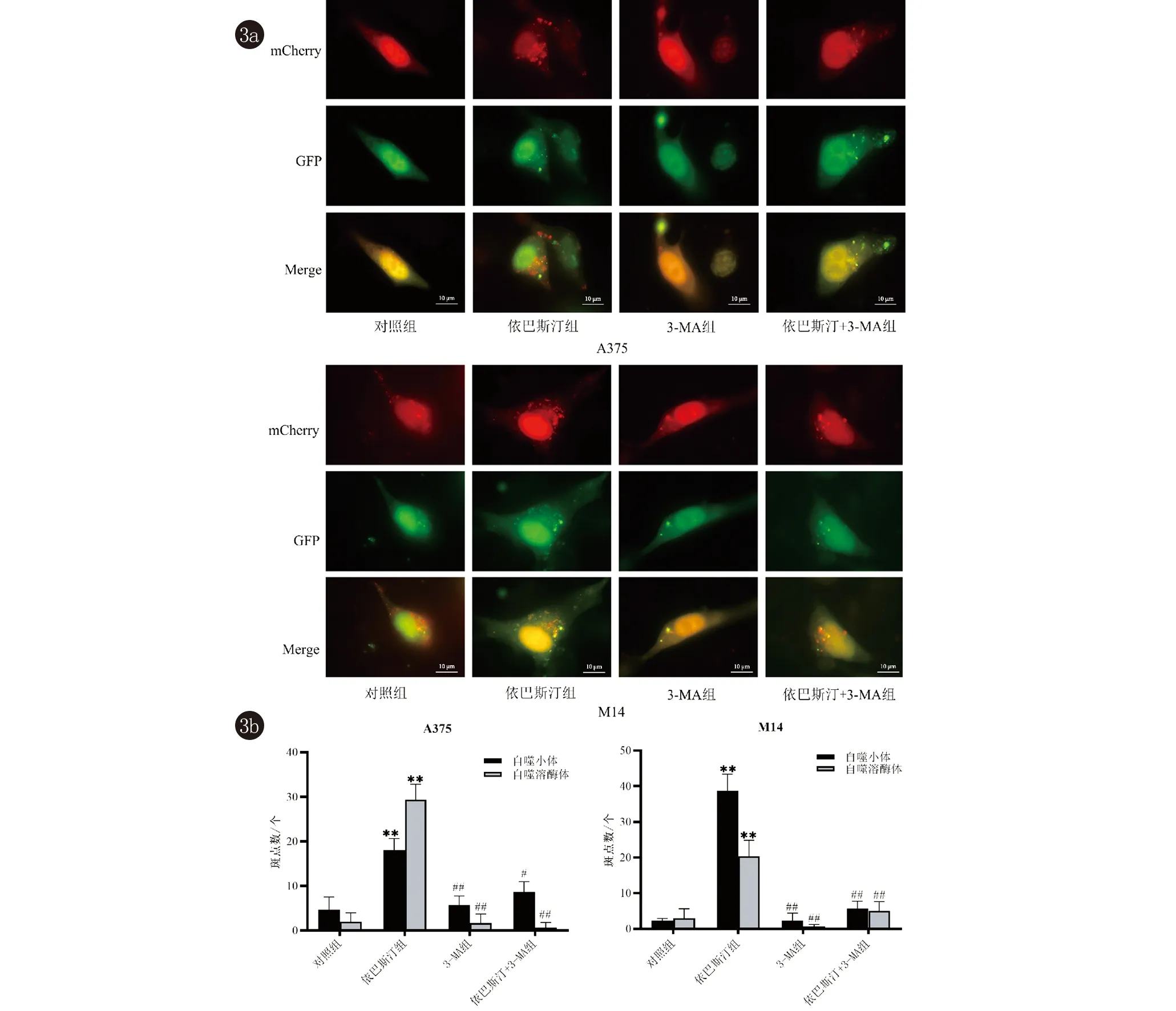
图3 mCherry-EGFP-LC3B检测依巴斯汀对人黑素瘤细胞自噬流的影响(与对照组比较:**P<0.01;与依巴斯汀组比较:# P<0.05; ## P<0.01)
2.4 依巴斯汀对人黑素瘤细胞自噬相关蛋白的影响 相比于对照组,依巴斯汀组LC3-Ⅱ/Ⅰ比值增加(P<0.05),表示LC3-Ⅰ向LC3-Ⅱ转化增多,Beclin1表达也相应升高(P<0.05),提示细胞的自噬现象增强。与依巴斯汀组相比,在自噬抑制剂3-MA的作用下,黑素瘤细胞自噬溶酶体的融合阶段受到阻滞,3-MA组和依巴斯汀+3-MA组LC3-Ⅱ/Ⅰ比值降低(P<0.05),同时Beclin1的表达也相应减少(P<0.05)(图4)。
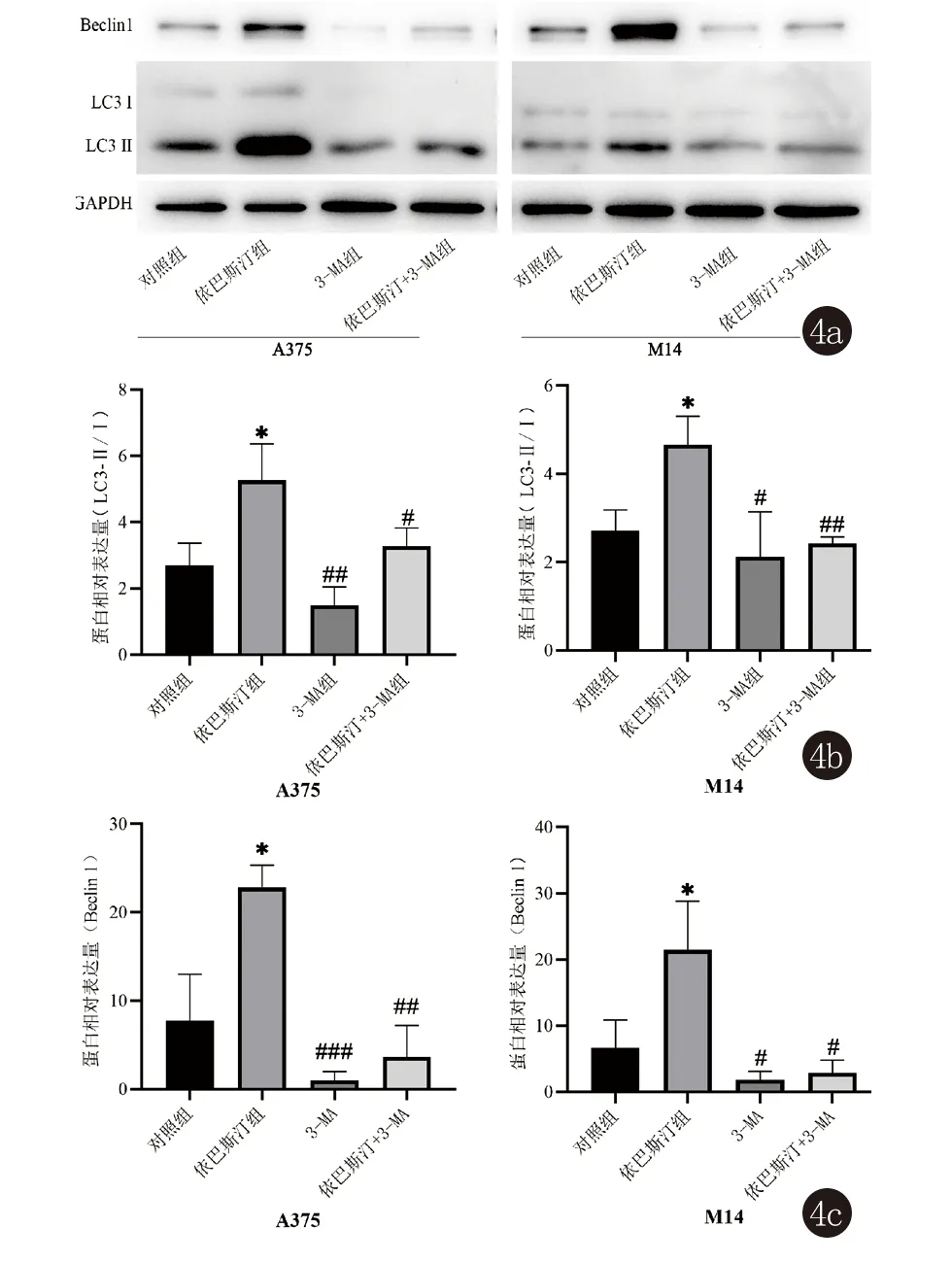
图4 Western blot检测依巴斯汀对人黑素瘤细胞自噬相关蛋白的影响(与对照组比较:* P<0.05;与依巴斯汀组比较:# P<0.05; ## P<0.01; ### P<0.001)
2.5 依巴斯汀对AKT/mTOR通路蛋白的影响 在不同浓度依巴斯汀的处理下,随着药物浓度的升高,与对照组相比,2.0、4.0 μmol/L的依巴斯汀p-AKT/AKT和p-mTOR/mTOR显著降低(P<0.05)(图5)。
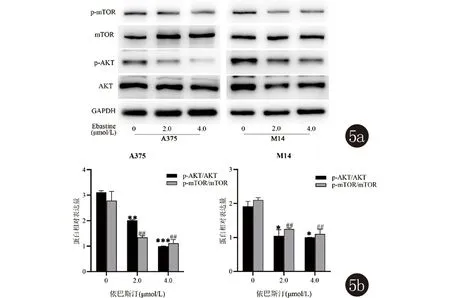
图5 Western blot检测依巴斯汀对人黑素瘤细胞AKT/mTOR信号通路蛋白的影响(与0 μmol/L比较,p-AKT/AKT:* P<0.05; **P<0.01; ***P<0.001; p-mTOR/mTOR:# P<0.05; ## P<0.01; ### P<0.001)
3 讨论
临床上,早期黑素瘤尚可通过手术切除获得较好的治疗效果,但晚期黑素瘤患者即使通过放化疗等手段也难以获得理想的治疗效果。有研究表明,依巴斯汀可以通过靶向EZH2的启动子抑制其表达,在体内和体外有效抑制肿瘤的生长和发展[14],依巴斯汀还可以通过破坏溶酶体膜的稳定性从而诱导肺癌细胞的死亡[10]。
自噬是真核生物中一种高度保守的自我降解的过程,是程序性死亡的一种方式。通过捕获、降解和回收溶酶体中的细胞内蛋白和细胞器,在维持细胞内环境稳态中发挥了重要作用[15,16]。已有大量研究证明,自噬在肿瘤的发生发展过程中有着十分重要的作用[16,17]。常用的研究自噬的方法包括透射电镜法、荧光质粒示踪法、组织蛋白酶Cathepsin活力检测等[18]。本研究采用mCherry-EGFP-LC3B双荧光质粒检测黑素瘤的自噬流水平,激光共聚焦显微镜结果显示:依巴斯汀显著增加了自噬小体和自噬溶酶体的累积,使用自噬抑制剂3-MA后,自噬小体和自噬溶酶体的数量均明显减少,提示依巴斯汀诱导人黑素瘤细胞A375和M14发生自噬。LC3B是目前公认的自噬特异性标志物,LC3-I是一种在正常生理条件下表达的可溶性细胞质蛋白,当细胞启动自噬时,LC3-I通过泛素样修饰过程与磷脂酰乙醇胺PE相互作用,转化为LC3-II膜蛋白。目前多用LC3-II/I比值的大小评估发生自噬的程度[19]。Beclin1是自噬发生过程中的重要分子,有文献报道,在黑素瘤细胞自噬过程中,Beclin1在促进自噬小体的形成中起着重要作用[20]。本研究通过Western blot结果分析可得,依巴斯汀诱导LC3-I向LC3-II转化增多,同时上调Beclin1的表达;加入自噬抑制剂3-MA后,自噬过程受阻,LC3-II/I比值降低,表明依巴斯汀诱导黑素瘤细胞自噬的发生。
关于自噬信号转导相关通路研究较多的是AKT/mTOR[21,22]、P53和ROS[23]等信号通路,有大量资料显示,AKT/mTOR通路在多种肿瘤的自噬过程中起着关键的作用,在黑素瘤中也有相关报道[24]。Western blot结果表明,依巴斯汀使p-AKT/AKT和p-mTOR/mTOR显著降低,提示依巴斯汀显著抑制AKT/mTOR信号通路的激活。
已有大量研究表明,依巴斯汀可以通过不同的作用方式对肿瘤细胞产生抑制作用,但在黑素瘤中是否有效尚未见相关报道。本研究使用不同浓度的依巴斯汀对人黑素瘤细胞进行处理,实验结果提示,依巴斯汀可以通过抑制AKT/mTOR通路的活化而诱导人黑素瘤细胞自噬的发生,降低细胞活力,进而发挥抑癌的作用。但依巴斯汀如何通过调控黑素瘤细胞发生自噬而抑制肿瘤的发生还有待更进一步的研究。
