甲状腺乳头状癌合并桥本甲状腺炎临床病理特征及颈部淋巴结转移影响因素分析
2022-08-17邱丽浈邱友燕陈晓珠刘钰君吴共发
邱丽浈,邱友燕,陈晓珠,刘钰君,吴共发
(1.广州医科大学附属第四医院健康管理中心,广东 广州 511300;2.广州医科大学附属第四医院内分泌科,广东广州 511300;3.广州医科大学附属第四医院病理科,广东广州 511300)
甲状腺癌(thyroid carcinoma,TC)是临床常见头颈部恶性肿瘤,其中甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占TC的60%~70%[1]。PTC在较早可出现颈部淋巴结转移,疾病发展至后期可出现远处转移,因此临床中早期诊断治疗PTC可改善患者预后。桥本甲状腺炎(hashimoto thyroiditis,HT)也可称为慢性淋巴细胞性甲状腺炎,此类患者可出现甲状腺滤泡上皮细胞嗜酸性、弥漫性淋巴细胞浸润变[2]。1955年Dailey等[3]首次提出PTC由HT发展演变而来,这类共存的疾病类型受到越来越多的重视。多数学者认为HT与PTC之间存在着密切的关系,HT合并PTC也受到临床高度关注,且近年来发现其发病率正逐年升高,因此,关于HT合并PTC的相关临床特征和发病机制等已成为热点研究项目[4]。有研究表明,PTC合并HT的恶性程度与未合并HT相比可增加2.96倍,并且可出现大量中央区淋巴结转移[5]。也有研究表明,PTC伴发HT对患者预后无显著影响,但PTC合并HT患者TSH水平明显升高,表明HT可能是PTC发病的危险因素;中央区淋巴结转移数目与中央区淋巴结总数相关,推测PTC淋巴结转移可能与淋巴结炎症反应相关[6]。为了解PTC合并HT临床病理特征,本次研究观察分析PTC合并HT临床病理特征及颈部淋巴结转移相关影响因素,具体如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月~2020年12月于本院诊治疑似PTC合并HT患者119例,超声诊断标准[7]为:病灶体积较大,病灶内及周围存在点状血流,内部回声紊乱,边界模糊,存在微小钙化、肿瘤纵横比>1等。纳入标准:①均符合临床PTC和HT相关诊断标准,且经术后病理学检查证实;②均首次接受手术等相关治疗;③均无合并心脑血管、肝、肾等重要脏器组织疾病;④均自愿参加本次研究且签署知情同意书。排除标准:①合并原发性甲状功能亢进、促甲状激素受体抗体阳性或甲状腺弥漫性肿大等其他甲状腺性疾病;②既往曾接受甲状腺手术或合并甲状腺亢进患者;③合并滤泡状癌或髓样癌等其他类型甲状腺癌;④合并免疫、血液系统疾病或其他恶性肿瘤者;⑤临床资料不完整者或配合度较差患者。术后经病理确诊PTC合并HT患者47例,为研究组;PTC未合并HT患者72例,为对照组;同期纳入50 例单纯HT患者作为HT组。
1.2 方法
1.2.1超声检查 超声检查前进行望诊和触诊[8],观察甲状腺肿大的程度和性质,是结节性还是弥漫性,质地软硬度,对称性及表面光滑情况,单发还是多发结节,与周围组织有无粘连,有无压痛,压迫气管与否。甲状腺肿块肿大程度标准:肉眼观察不到但可以摸到为1度肿大;肿大可以看到和摸到,但不超过胸锁乳突肌后缘为2度肿大;肿大可以看到和摸到,且超出胸锁乳突肌后缘为3度肿大。患者入院后采用彩色多普勒超声诊断仪,探头频率为7.5MHz,预设甲状腺检查条件,患者平卧,下颌稍上抬,充分暴露颈部。采用二维超声观察甲状腺及病灶超声图像,观察肿块大小、形态和实质回声。由2位经验丰富的超声医师对上述所有患者进行超声检查并记录超声图像特征:结构包括实性、囊实性;内部回声包括高或等回声、低回声、极低回声;形态包括水平位和垂直位;边缘有规则或不规则、清晰或不清晰;微钙化为1 mm及以下的细点状强回声灶,伴或不伴声影;粗大钙化为1 mm以上的点状强回声;晕圈;有无结节内部血流。彩色多普勒观察病变部位血流情况,血流的分级:病灶内未见血流信号判定为0级;病灶内有少量血流信号,或血流信号呈1~2个点状、短棒状的判定为Ⅰ级;病灶内有中等量血流信号,一个断面上1~2条血管,其长度小于病灶的半径判定为Ⅱ级;病灶内血流信号丰富,3条以上血管或弥漫性网状血流判定为Ⅲ级。
1.2.2病理指标检测 即用快捷型免疫组织化学MaxVisionTM HRP(Mouse/Rabbit)检测试剂盒(产品编号KIT-5002)、Survivin(产品编号RAB-0536)和Ki-67(产品编号KIT-0005)单克隆抗体、柠檬酸盐抗原修复液、抗体稀释液、PBS缓冲液和DAB显色剂等免疫组织化学试剂均购自福州迈新公司。染色按照试剂盒说明书进行, survivin阳性表达于细胞质或细胞核,Ki-67阳性表达于细胞核,阳性表达显色为细胞中的相应部位出现棕黄至棕褐色颗粒着色。染色结果判定参照文献[9]。由高年资病理医师在显微镜下随机选取5个不同高倍视野,每个视野计数100个阳性细胞,计算阳性率。
1.2.3自身抗体水平检测 血清TgAb和TPOAb的相对含量回顾性收集医院检验系统的检测结果, 检验仪器为罗氏电化学发光全自动免疫分析系统(型号Cobas E601),术前空腹采集3~5 mL静脉血,置于非抗凝试管中,室温静置 30 min,以 2 500 r/min离心 10 min,收集血清, 采用电化学发光法检测血清TgAb和TPOAb水平,试剂盒购自武汉明德生物有限公司,TgAb参考值为<115 IU/mL,TPOAg的参考值为<34 IU/mL。
1.2.4预后观察 对上述研究组和对照组所有患者进行术后随访,时间为6~12个月。
1.3 观察指标
①比较研究组和对照组患者的性别、平均年龄、肿瘤纵横比、多发肿瘤病灶、双侧癌变、颈部淋巴结转移、肿瘤外侵、声音嘶哑、吞咽困难、颈部疼痛等临床病理特征;②比较3组患者的边界、形态、内部回声、钙化、血流信号等超声特征;③比较研究组和对照组患者的survivin、Ki-67阳性表达率及血清TgAb、TPOAb水平;④多因素logistic回归分析影响PTC合并HT患者出现中央区淋巴结转移的危险因素。
1.4 统计学方法
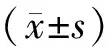
2 结 果
2.1 两组患者临床特征的比较
研究组患者女性比例、肿瘤纵横比、颈部中央区淋巴结转移比例及肿瘤外侵比例均明显高于对照组(P<0.05),而两组患者在年龄、多发肿瘤病灶、双侧癌变、颈侧区淋巴结转移率、声音嘶哑、吞咽困难及颈部疼痛等比较,差异均无统计学意义(P>0.05)。见表1。
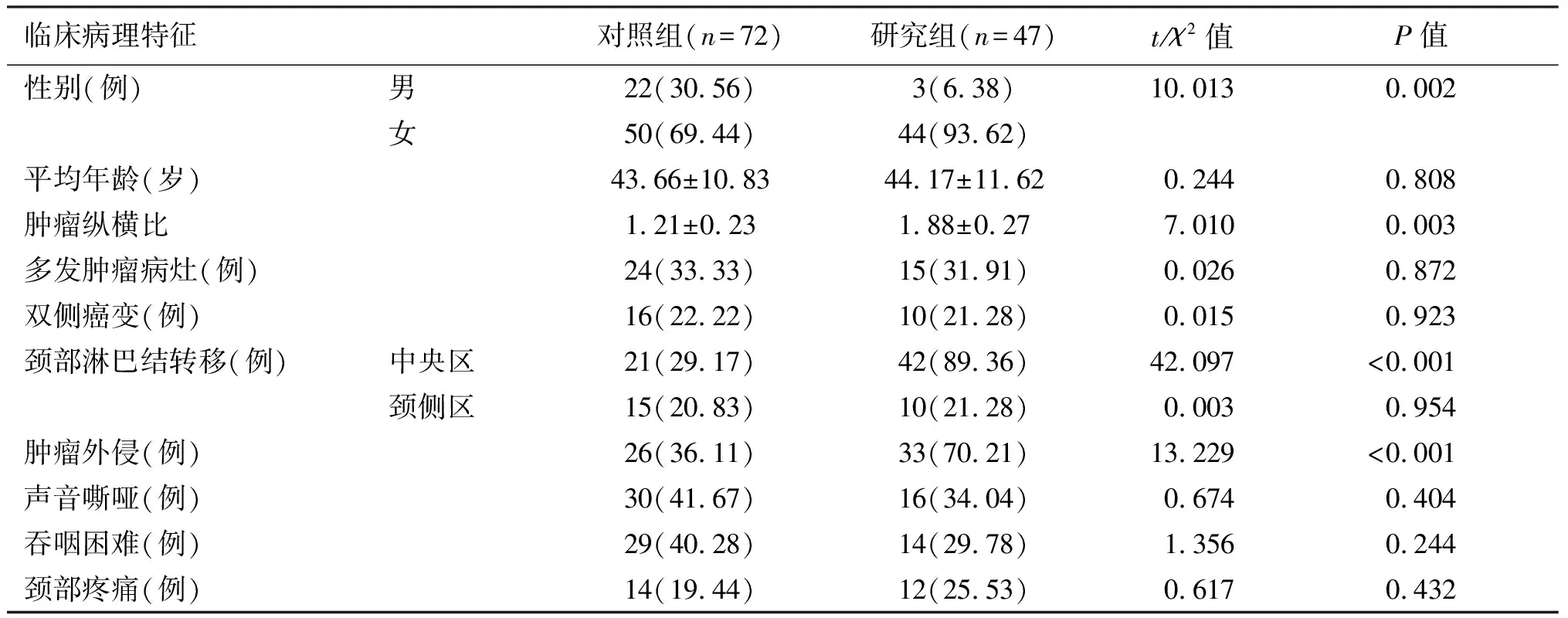
表1 两组患者临床病理特征比较
2.2 各组患者的超声检查特征比较
3组患者在超声检查的癌结节边界、形态、内部回声、钙化情况和血流信号等比较具有明显差异(P<0.05)。见表2。
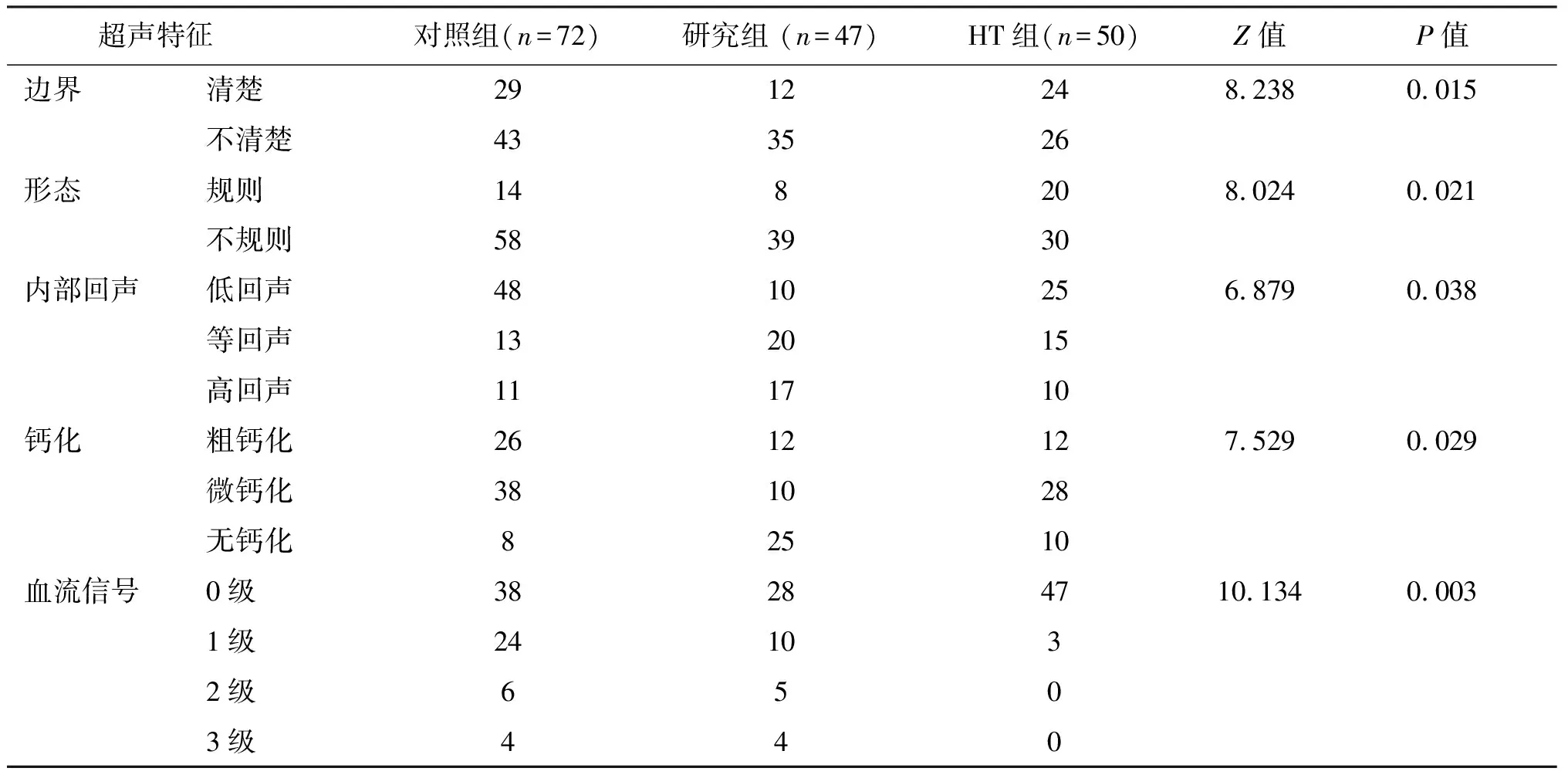
表2 两组患者的超声检查特征比较(n)
2.3 两组患者survivin、Ki-67阳性表达率及TgAb、TPOAb含量比较
两组患者survivin及Ki-67阳性表达率比较,差异不具有统计学意义(P>0.05)。研究组患者血清TgAb及TPOAb平均含量(583.26±243.17)IU/mL和(341.52±31.92)IU/mL,均高于对照组(P<0.05)。见表3。
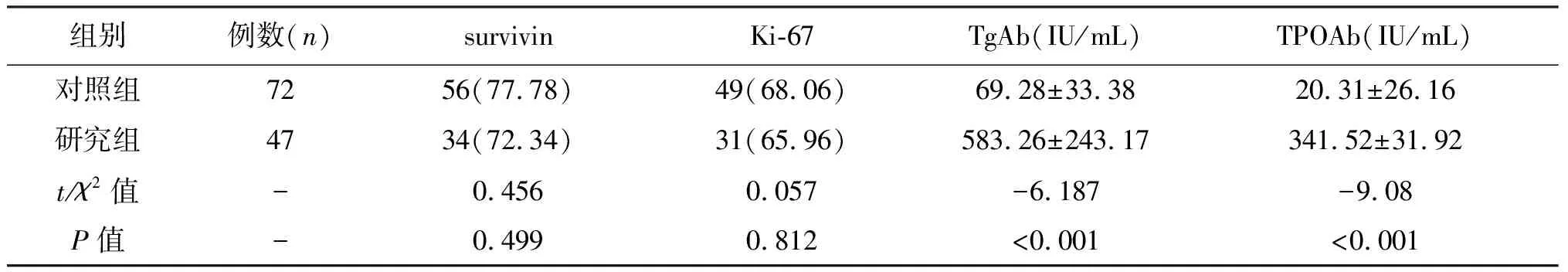
表3 两组患者survivin、Ki-67阳性表达率及TgAb、TPOAb含量比较
2.4 影响PTC合并HT患者中央区淋巴结转移的Logistic回归分析
多因素logistic回归分析结果显示,肿瘤纵横比、性别、肿瘤外侵、TgAb和TPOAb是PTC合并HT患者发生中央区淋巴结转移的独立危险因素(P<0.05),见表4。
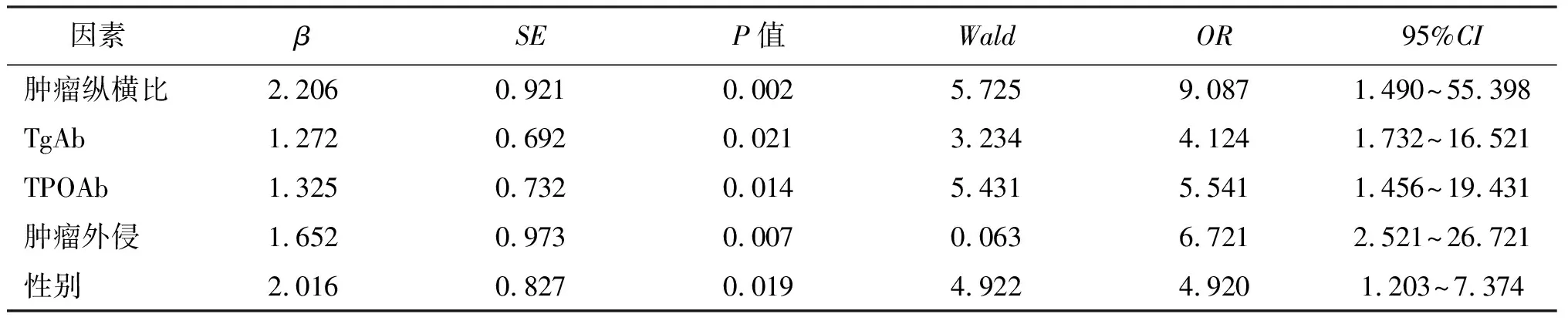
表4 影响PTC合并HT患者中央区淋巴结转移的logistic回归分析
2.5 预后
经过6~12个月的随访,研究组1例患者出现术后复发,复发率为2.13%,对照组3例出现术后复发,复发率为4.17%。两组在本研究的随访观察中,预后差异无统计学意义(P>0.05)。
3 讨 论
HT是一种常见甲状腺自身免疫性疾病,PTC是TC中常见的亚型。近年来,HT合并PTC的发病率逐步上升,严重影响到人们的生命安全。目前PTC合并HT的发病机制尚未完全清楚。有研究在HT患者中发现了癌基因RET/PTC的表达,HT相关炎症能够促进RET/PTC基因重排,导致增加PTC的发病风险,HT可能与PTC发生发展有关[10]。目前对PTC是否是由HT癌变所致的研究也逐步走向基因水平。在临床病理特征上,对于单纯PTC和PTC合并HT是否存在显著的差异性也缺少统一的标准,本文从临床病理特征这个角度出发,以单纯型的PTC为对照,探索HT合并PTC患者临床病理各指标的特征,以指导其早期诊断以及预后评估。
HT合并PTC一般在临床表现上并无明显特异性,体格检查可表现为HT的不典型体征,如甲状腺弥漫性轻中度肿大、表面不光滑、甲状腺结节区或甲状腺区可触及肿物、不易被发现等特点,可有咽部不适或压痛,较少引起食管、气管及喉返神经的压迫[11]。研究报道[12]HT合并PTC在临床上可表现为精神紧张或压迫相关症状,如呼吸、吞咽困难,窒息等,一半的患者出现甲状腺球蛋白抗体(thyroglobulin antibody, TGAb)和甲状腺过氧化物酶抗体(thyroid Peroxidase antibody, TPOAb)增高;也有报道[13]HT合并PTC首发症状为颈前、甲状腺区肿物,甲状腺结节质地硬,少出现压迫的表现,大部分患者的TGAb和TPOAb高于正常。B超上HT合并PTC与单纯的PTC较难鉴别。手术是治疗PTC的首选方法,对HT合并PTC这亦不例外,由于PTC合并HT较易发生早期淋巴结转移,有研究报道显示,PTC合并HT发生早期淋巴结转移的几率达到3.1%-45.7%[14],同时颈部中央区淋巴结转移也是影响治疗和预后质量的重要危害因素。因此,明确PTC合并HT出现颈部中央区淋巴结转移危险因素,对指导临床治疗和评估预后尤为重要。有学者认为HT合并PTC结节形态更不规则,边缘更不清晰,而钙化点和低回声较单纯PTC少,粗大钙化在HT合并PTC上相对多见,可作为两者鉴别诊断的有效指标。我们研究结果同样发现,PTC、PTC合并HT及HT患者的超声表现存在明显差异。朱有志等[15]研究发现,PTC合并HT患者的颈部中央区淋巴结转移率高达50.2%,同时发现女性、原发肿瘤大小及肿瘤外侵均是其发生的独立危险因素。魏巍[16]研究发现,术前血清TSH水平越高,出现侧颈部中央区淋巴结转移的风险越高,但具体影响机制仍未阐明。同时我们研究发现,研究组患者颈部中央区淋巴结转移率明显高于对照组,提示合并HT可能增加颈部中央区淋巴结转移风险,这与Paulson等[17]学者报道一致,但也有研究发现两者并无明显关系,甚至HT可作为PTC出现颈部中央区淋巴结转移的保护因素,可能受地区、人种等因素影响,但目前尚无明确定论,需后续深入研究其具体机制。此外,我们研究结果显示,研究组的血清TgAb及TPOAb水平较对照组明显升高,且是出现颈部中央区淋巴结转移的独立危险因素,可能与自身抗体破坏甲状腺组织导致TSH水平升高,以及自身组织免疫损伤及癌基因的突变有关[18]。同时,我们研究结果显示,研究组患者的肿瘤纵横比、肿瘤外侵和女性比例均明显高于对照组,且均是颈部中央区淋巴结转移的独立危险因素,分析原因可能是女性体内较高的雌激素水平促进淋巴结转移,而肿瘤纵横比增加往往提示肿瘤呈浸润生长,因此出现淋巴结转移风险更高。
综上所述,我们的研究发现了PTC合并HT患者有着较高的淋巴结转移和肿瘤外侵症状,同时发现较高的自身抗体水平及较大的肿瘤纵横比也是PTC合并HT患者出现颈部淋巴结转移的影响因素,对此类患者治疗及预后评估有着重要指导意义。
