七氟醚减轻蛛网膜下腔出血大鼠早期脑损伤
2022-08-17邢丹丹康文越
张 敏,邢丹丹,康文越,林 慧
(海南省人民医院 海南医学院附属海南医院 麻醉科,海南 海口 570000)
蛛网膜下腔出血(subarachnoid hemorrhage, SAH)由外伤、高血压、脑动脉畸形及动脉瘤等因素诱发造成,是一种出血性卒中,具有极高的病死率和致残率[1]。早期脑损伤(early brain injury, EBI)是SAH后高致死、致残率的主要原因,包括SAH后脑水肿、血脑屏障(blood-brain barrier, BBB)破坏、神经细胞的凋亡等病理变化[2-3]。挥发性麻醉气体,例如异氟烷和七氟醚(sevoflurane, Sev),已经在各种类型的脑损伤中被发现具有神经保护作用,如创伤性脑损伤、卒中、脑缺血/再灌注损伤和神经退行性疾病,包括SAH[4]。
Sev是最常用的挥发性麻醉剂之一,在手术中通过吸入进行诱导和维持麻醉。据报道,Sev可通过降低SAH患者脑脊液caspase-3水平,减缓神经元凋亡,减轻SAH后EBI[5];动物研究也证实在SAH后24 h,给予1.5%的Sev 60 min和3%的Sev 30、60 min,可改善小鼠的神经行为功能、脑水肿并减轻神经元死亡[6]。这提示,Sev对SAH后EBI具有显著的保护作用;但其发挥保护作用的具体机制尚不完全明确。Wnt/β-连环蛋白(β-catenin)通路在中枢神经系统的发育中起着重要的作用。据报道,Wnt/β-catenin信号通路的失活与SAH诱导的神经细胞凋亡有关[7];而且激活Wnt/β-catenin信号通路可显著改善SAH后的神经行为功能并减轻BBB渗漏,保持BBB完整性[8]。Sev对SAH后EBI的保护作用是否与Wnt/β-catenin信号通路有关尚还未可知;因此,本研究拟探讨Sev对SAH大鼠EBI的脑保护作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:6-8周龄SPF级SD雄性大鼠90只,体质量(280±20)g[北京维通利华实验动物技术有限公司,许可证为SCXK(京)2019-0009]。
1.1.2 药品、试剂:Sev(上海恒瑞医药有限公司);Dickkopf-1(DKK1,Wnt/β-catenin通路特异性抑制剂)(北京爱必信生物技术有限公司);伊文思蓝(Evan blue, EB)染色液(南京沃博生物科技有限公司);末端脱氧核苷酸转移酶介导的dUTP-生物素缺口末端标记(TUNEL)细胞凋亡检测试剂盒(绿色荧光)、RIPA裂解液、BCA试剂盒(上海碧云天生物科技公司);兔抗Wnt3a、糖原合成酶激酶3β(glycogen synthase kinase 3β, GSK-3β)、磷酸化GSK-3β(p-GSK-3β)、β-catenin、紧密连接蛋白(zonula occludens-1, ZO-1)和claudin-5、基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)、occludin、B细胞淋巴瘤/白血病-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、β-actin、山羊抗兔IgG H&L(HRP)(Abcam公司)。
1.2 方法
1.2.1 大鼠的分组及处理:大鼠适应性饲养3 d后,随机分为假手术组(sham组)、模型组(model组),Sev低(Sev-L,1.5%)、高剂量组(Sev-H,3%)、Sev+DKK1组(Sev 3%+DKK1 5 μg/kg)[6],每组18只。按照参考文献[9]采用血管内穿刺法建立SAH大鼠模型,具体操作为:大鼠麻醉后,于颈部正中切一小口,暴露左侧颈总动脉、颈外动脉和颈内动脉。将一4-0尼龙缝合线通过颈外动脉插入颈内动脉,推进约3 cm后感觉到有阻力时,继续将缝合线进一步推进以刺穿血管。恢复颈内动脉血流,血液便可经过穿刺口进入蛛网膜下腔,缝合颈部皮肤切口。Sev+DKK1组大鼠在模型制备前30 min,侧脑室注射5 μg/kg DKK1;Sham组仅插入缝合线,不刺破血管。模型成功标准:1)有明显的血管刺破感;2)大鼠有呼吸急促、心率加快的症状出现。3)剥离脑组织后可观察到血液散布在脑底和环池等部位。造模过程中死亡和造模失败大鼠给予补充。
在SAH诱导后1 h,Sev各剂量组和Sev+DKK1组使用小动物呼吸麻醉机面罩吸入Sev(体积分数1.5%、3%)与氧气的混合气体,连续吸入给药1 h;sham组和model组单纯吸入氧气1 h;麻醉结束后将大鼠置于笼子中至苏醒。
1.2.2 神经功能评分:在SAH后24 h对神经功能进行评分,使用改良的Garcia量表。修改后的Garcia量表(最高评分18分)包括本体触感、触须反应、自主活动、四肢对称运动、攀爬能力和前肢伸展运动;每个子测试的得分从0(最低)到3(最高)。评分越高代表神经功能越好。
1.2.3 伊文思蓝(EB)检测血脑屏障通透性:每组随机选取6只大鼠,麻醉后,尾静脉注入2%伊文思蓝(EB)溶液(5 mL/kg),6 h后行心脏PBS灌注取脑,仔细分离并去除大脑硬脑膜、小脑以及脑干。精确称取脑组织,加入2 mL三氯乙酸溶液匀浆,静置30 min,14 000 r/min离心30 min,取等量上清液(0.8 mL),用酶标仪在620 nm波长处测定吸光度(A)值,利用样品作出标准曲线,根据标准曲线求得EB含量(μg/g脑组织)。EB含量的增大,表示BBB被破坏,通透性增加。
1.2.4 蛛网膜下腔出血评分(SAH评分):每组剩余12只大鼠,通过SAH分级系统评估SAH的严重程度。取出大脑拍照,将大脑底部的照片分为6个部分,根据蛛网膜下腔血的量对其进行评分(0~3分),计算总得分(6个部位分数相加)。评分标准:0分:未见出血;1分:极少量凝血块;2分:中等量蛛网膜下腔出血,但仍可看清血管;3分:大量蛛网膜下腔出血,血管难以辨认。
1.2.5 脑含水量(brain water content, BWC)的检测:从每组剩余的12只大鼠中随机选取6只,去除大脑硬脑膜、小脑以及脑干,0.9%氯化钠溶液冲洗残留血迹后,滤纸吸干表面水分,称重(湿重)。然后,将脑组织在烤箱中干燥72 h,再次称重(干重)。计算出BWC的百分比(BWC=[湿重-干重]/湿重)×100%。
1.2.6 TUNEL免疫荧光染色检测神经元凋亡:每组剩余的6只大鼠,将脑组织冠状切分为两部分,一部分液氮速冻后,-80 ℃冰箱保存,用于Western blot实验,另一部分在室温下置于4%多聚甲醛溶液中固定24 h,石蜡包埋,切片,将切片与蛋白酶K溶液在37 ℃孵育10 min,再用0.3% H2O2处理10 min,与TUNEL反应混合物(绿色荧光)在黑暗中于37 ℃孵育60 min。PBS洗涤后与DAPI一起孵育5 min。使用荧光显微镜在颞叶皮层5个随机视野中对TUNEL阳性细胞核的数目进行计数。通过比较TUNEL阳性细胞的数目和DAPI阳性细胞的数目确定神经元凋亡。
1.2.7 Western blot检测脑组织Wnt/β-catenin信号通路、BBB及凋亡相关蛋白的表达:取出-80 ℃冰箱保存的脑组织,剥离颞叶皮层,加入RIPA裂解液研磨后,置于冰上,静置后离心,提取上清液为总蛋白溶液。用BCA法测量蛋白浓度后,将样品与上样缓冲液混合并在100 ℃下加热变性5 min,取等量样品(30 μg/孔)上样。SDS-PAGE,湿转法转膜,封闭后将膜与一抗(Wnt3a、GSK-3β、p-GSK-3β、β-catenin、occludin、ZO-1、claudin-5、MMP-9、Bcl-2、Bax,1∶1 000;β-actin,1∶5 000)4 ℃下孵育过夜,然后与HRP标记的羊抗兔IgG二抗(1∶5 000)室温孵育1 h,ECL显色,以β-actin为内参,通过与内参的吸光度比值,得出目的条带的相对表达水平。
1.3 统计学分析
所有数据分析均使用SPSS 21.0软件进行。将符合正态分布的测量数据以均值±标准差(x±s)表示。单因素方差分析(one way Anova)用于多组之间的比较,Tukey的事后检验用于单因素方差分析后的成对比较。
2 结果
2.1 各组大鼠的神经功能评分
与sham组相比,model组大鼠神经功能评分显著降低(P<0.05);与model组相比,Sev-L、Sev-H组大鼠神经功能评分明显升高(P<0.05);与Sev-H组相比,Sev+DKK1组大鼠神经功能评分明显降低(P<0.05)(表1)。

表1 各组大鼠神经功能评分和SAH评分Table 1 Neurological function score and SAH score of rats in each group (x±s, n=18)
2.2 各组大鼠的SAH评分
与sham组相比,model组大鼠SAH评分显著升高(P<0.05);与model组相比,Sev-L、Sev-H组大鼠SAH评分明显降低(P<0.05);与Sev-H组相比,(Sev+DKK1)组大鼠SAH评分明显升高(P<0.05)(图1,表1)。
2.3 各组大鼠脑组织EB渗出量和脑组织含水量(BWC)
与sham组相比,model组大鼠EB渗出量显著升高(P<0.05);与model组相比,Sev-L、Sev-H组大鼠EB渗出量明显降低(P<0.05),BWC有降低的趋势;与Sev-H组相比,Sev+DKK1组大鼠EB渗出量明显升高(P<0.05),BWC有所增加(表2)。

A.sham group; B.model group; C.Sev-L group; D.Sev-H group; E.Sev+DKK1 group图1 各组大鼠全脑蛛网膜下腔出血情况Fig 1 Whole brain subarachnoid hemorrhage of rats in each group(n=12)

表2 各组大鼠EB渗出量和BWCTable 2 EB exudation and BWC of rats in each group(x±s, n=6)
2.4 各组大鼠皮层神经细胞凋亡
与sham组相比,model组大鼠TUNEL阳性细胞比例明显上升,细胞凋亡率、Bax表达显著升高,Bcl-2表达显著降低(P<0.05);与model组相比,Sev-L、Sev-H组大鼠TUNEL阳性细胞比例明显下降,细胞凋亡率、Bax明显降低,Bcl-2表达明显升高(P<0.05);与Sev-H组相比,(Sev+DKK1)组大鼠TUNEL阳性细胞比例明显上升,细胞凋亡率、Bax明显升高,Bcl-2表达明显降低(P<0.05)(图2~3,表3)。

表3 各组大鼠皮层神经细胞凋亡率及Bcl-2、Bax表达Table 3 Apoptosis rate and expression of Bcl-2 and Bax in cortical neurons of rats in each group(x±s, n=6)
2.5 各组大鼠脑组织BBB相关蛋白的表达
与sham组相比,model组大鼠脑组织occludin、ZO-1、claudin-5表达显著降低,MMP-9表达显著升高(P<0.05);与model组相比,Sev-L、Sev-H组大鼠脑组织occludin、ZO-1、claudin-5表达明显升高,MMP-9表达明显降低(P<0.05);与Sev-H组相比,Sev+DKK1组大鼠occludin、ZO-1、claudin-5表达明显降低,MMP-9表达明显升高(P<0.05)(图4,表4)。

表4 各组大鼠脑组织BBB相关蛋白的表达Table 4 Expression of BBB related proteins in brain tissue of rats in each group (x±s, n=6)

A.sham group; B.model group; C.Sev-L group; D.Sev-H group; E.Sev+DKK1 group图2 各组大鼠皮层神经细胞凋亡(TUNEL)Fig 2 Cortical neuron apoptosis of rats in each group (TUNEL)(n=12)
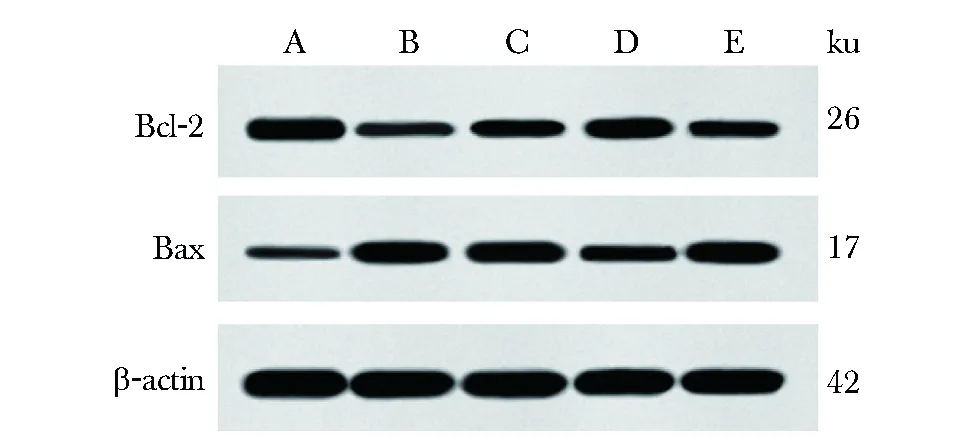
A.sham group; B.model group; C.Sev-L group; D.Sev-H group; E.Sev+DKK1 group图3 各组大鼠脑组织Bcl-2、Bax的表达Fig 3 Expression of Bcl-2 and Bax in brain tissue of rats in each group(n=12)
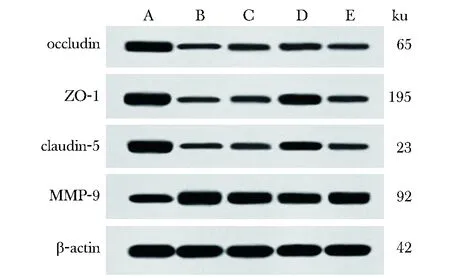
A.sham group; B.model group; C.Sev-L group; D.Sev-H group; E.Sev+DKK1 group图4 各组大鼠脑组织BBB相关蛋白的表达Fig 4 Expression of BBB related protein in brain tissue of rats in each group(n=12)
2.6 各组大鼠脑组织Wnt/GSK-3β/β-catenin信号通路相关蛋白的表达
与sham组相比,model组大鼠脑组织Wnt3a、β-catenin表达显著降低,p-GSK-3β/GSK-3β比值显著升高(P<0.05);与model组相比,Sev-L、Sev-H组大鼠脑组织Wnt3a、β-catenin表达明显升高,p-GSK-3β/GSK-3β表达明显降低(P<0.05);与Sev-H组相比,Sev+DKK1组大鼠Wnt3a、β-catenin表达明显降低,p-GSK-3β/GSK-3β比值明显升高(P<0.05)(图5,表5)。

A.sham group; B.model group; C.Sev-L group; D.Sev-H group; E.Sev+DKK1 group图5 各组大鼠脑组织Wnt/GSK-3β/β-catenin通路相关蛋白的表达Fig 5 Wnt/GSK-3 in brain tissue of rats in each group β/β-expression of catenin pathway related proteins(n=12)

表5 各组大鼠脑组织Wnt/GSK-3β/β-catenin通路相关蛋白的表达Table 5 Wnt/GSK-3 in brain tissue of rats in each group β/β-expression of catenin pathway related proteins (x±s, n=6)
3 讨论
SAH后的EBI是影响患者预后的关键因素,脑水肿、BBB破坏、神经细胞凋亡等是SAH后EBI的关键部分[10]。Sev是一种新型吸入性麻醉剂,具有诱导快、苏醒快、易于控制、呼吸道刺激小等优点。研究发现,其对不同脑部疾病的大脑具有保护作用,范围从外伤到缺血或缺氧再灌注损伤[4-5]。而且Sev可抑制SAH后神经元凋亡,减轻SAH后的EBI[6]。紧密连接蛋白(ZO-1、occludin和claudin-5)是BBB维持脑微环境动态平衡的关键成分。MMP-9降解多种神经系统疾病中的紧密连接蛋白。本研究结果显示,给予1.5%和3%的Sev干预1 h后,SAH大鼠神经功能明显改善,SAH评分、EB渗出量、神经细胞凋亡率降低,且脑组织occludin、ZO-1、claudin-5、Bcl-2表达升高,MMP-9、Bax表达降低;提示Sev可改善BBB,抑制神经元凋亡,减轻SAH后的EBI。
维持BBB完整性对于调节中枢神经系统稳态至关重要。据报道,Wnt/β-catenin信号在BBB的形成和维持中起着至关重要的作用[8]。Wnt蛋白是一类富含半胱氨酸的分泌性糖蛋白家族,目前已发现19种,其中Wnt3a在神经系统中有明显表达,参与了神经分化及发育过程。β-catenin是一种细胞骨架蛋白,是参与调节经典Wnt信号通路的关键信号分子。Wnt/β-catenin未被激活时,β-catenin会被GSK-3β组成的复合物磷酸化而降解;β-catenin的失活诱导了成年脑内皮细胞中的BBB分解和特定紧密连接蛋白claudin-5和-3的下调[11]。本研究发现,SAH大鼠BBB被破坏的同时伴随着脑组织Wnt3a、β-catenin表达降低,p-GSK-3β/GSK-3β比值升高,说明Wnt/GSK-3β/β-catenin信号通路被抑制,进一步检测了脑组织中BBB相关紧密连接蛋白的表达,结果显示,ZO-1、occludin和claudin-5的表达均降低,再次证实β-catenin的失活与BBB的破坏有关。
当Wnt信号通路激活后,Wnt分泌后能通过抑制GSK-3β等蛋白组成的β-catenin降解复合物的降解活性,稳定胞质中的β-catenin蛋白,进入细胞核后参与转录调节。槲皮素可以通过激活Wnt/β-catenin途径,减弱MMP-9激活,保护脑缺血再灌注损伤中的BBB功能障碍,且这些保护作用可被DKK1逆转[12]。Sev可通过激活Wnt/GSK-3β/β-catenin通路减轻大鼠心肌缺血再灌注损伤[13]。在SAH后小剂量短期给予Sev可能通过稳定β-catenin来减轻早期脑水肿[14];说明Sev可抑制β-catenin的降解。在本研究中,给予Sev干预后,脑组织Wnt3a、β-catenin表达明显升高,p-GSK-3β/GSK-3β表达明显降低;提示Sev可激活Wnt/β-catenin通路。此外,为了进一步验证Sev对Wnt/β-catenin通路的调控作用,对SAH大鼠应用了Wnt/β-catenin通路的特异性抑制剂DKK1,结果显示,DKK1可明显削弱Sev对SAH后EBI的保护作用,进一步证实该结论;提示,Sev可能通过激活Wnt/β-catenin通路,减轻SAH后的EBI。
综上所述,Sev可能通过激活Wnt/β-catenin通路,改善BBB,抑制神经元凋亡,减轻SAH后的EBI。本研究仅从动物水平进行了初步探究,后续可考虑从体外细胞水平进行深入研究。
