微生态食品调节肠道菌群抗抑郁研究进展
2022-08-16陈乐涛郭丽琼刘志君林俊芳
陈乐涛,郭丽琼,4,马 睿,刘志君,滕 莉,林俊芳,4
(1.华南农业大学 食品学院,广州 510640;2.华南农业大学 林学与风景园林学院,广州 510640;3.健码制药(广东)有限公司,广州 510850;4.广东省微生态制剂工程技术研究中心,广州 510640)
抑郁症是一种常见的精神障碍,其临床表现为情绪低落、思维迟缓、意志力减退、认知功能障碍等。目前主要认为抑郁症是由环境因素和遗传导致,有抑郁或者焦虑遗传背景并且暴露在压力中(如暴力)的时候患抑郁症概率增加[1],但还没有单一机制可以完全解释抑郁症的发生。研究发现,抑郁症伴随着海马体体积减小、神经信号受损、炎症加剧、神经营养因子异常、单胺类神经递质的下降等现象[2-5]。临床抗抑郁药主要有5-羟色胺再摄取抑制剂类(selective serotonin reuptake inhibitor,SSRI),但这些药物存在明显的副作用,如起效慢、治愈率低、复发率高等[6],因此,迫切需要挖掘新的治疗靶点。随着测序技术的发展,许多临床和动物研究发现肠道菌群与中枢神经系统存在相互影响,并且这种影响与包括抑郁症在内的多种神经疾病相关。基于肠道菌群与抑郁症的关系,益生菌、益生元、食药物质被用于抗抑郁的研究,其作用机制与传统抗抑郁药物有明显区别,为了与传统抗抑郁药物区分,将这些能够调节肠道菌群并通过改善炎症、HPA轴功能等途径来改善中枢神经系统功能的物质称为“微生态食品”,对以上物质的最新研究成果进行综述。
1 肠道菌群与抑郁症的关系
肠道菌群指在人肠道中的正常微生物,其数量庞大、种类丰富,与宿主相互作用,有益于宿主的生理健康。正常的肠道菌群对大脑的发育十分重要,肠道菌群异常可以导致抑郁症的发生,同样抑郁症也会影响肠道菌群的组成和功能[7-9]。研究发现抑郁症患者的肠道菌群丰富度明显降低[10],同样的结果也出现在动物抑郁模型中[11]。与健康个体相比,抑郁症患者的肠道菌群在多个分类水平上发生显著变化[12]。在动物抑郁模型中,厚壁菌门显著下降,而拟杆菌门和变形菌门明显上升,通过治疗可以逆转以上变化[13]。另一方面,研究者将抑郁症患者和健康志愿者的粪便菌群移植到正常大鼠体内,发现移植了抑郁症患者粪便菌群的大鼠表现出与患者类似的抑郁行为[14]。这些结果表明肠道菌群与抑制症存在双向联系,这种联系被称为肠道菌群-肠-脑轴[15]。
肠道菌群-肠-脑轴是由中枢神经系统、神经内分泌系统、神经免疫系统、自主神经系统、肠神经系统和肠道菌群组成。肠道菌群可以通过多个直接或间接途径影响抑郁症(图1),主要概括为4个方面:(1)炎症反应。研究发现抑郁症患者肠道中革兰氏阴性菌丰富度增加,内毒素(lipopolysaccharide,LPS)合成增加,导致肠道中的促炎症因子水平增加并且造成肠道组织损伤,进而导致血浆中内毒素水平增加,免疫细胞和神经元细胞均存在识别病原体和LPS的受体从而引发炎症反应[16-17]。若给予大鼠注射LPS,可以使大鼠出现抑郁症状[18]。(2)肠道菌群的代谢产物。肠道菌群可以产生多种代谢产物,有些产物可以跨越血脑屏障与大脑相互作用[5]。在哺乳动物血液中发现了多种肠道微生物代谢物,它们可以自由地与宿主的免疫、神经和内分泌系统相互作用,如肠道菌群中某些细菌可以影响5-羟色胺(5-hydroxytryptamine,5-HT)的产生,5-HT水平降低与抑郁症的发生相关[19-22]。肠道菌群分解碳水化合物产生的短链脂肪酸(short chain fatty acids,SCFAs)对中枢神经系统具有重要影响,SCFAs能够通过调节小胶质细胞的成熟和动态平衡而影响中枢神经系统[23],SCFAs还能特异性地诱导调节性 T 细胞(regulatory T cells,Tregs)的产生,Tregs对免疫稳定具有重要作用,而且Tregs的耗尽也与抑郁症状的加重有关[24]。(3)HPA轴。HPA轴(hypothalamic-pituitary-adrenal axis)是由下丘脑、垂体和肾上腺组成的神经内分泌应激反应体系。HPA轴功能受到促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRF)、促肾上腺皮质激素(adrenocorticotropic hormone,ATCH)和皮质酮(corticosterone,Cort)浓度的影响[25]。健康的肠道菌群对HPA轴的正常活动十分重要,Sudo等[26]研究发现,与正常小鼠相比,GF小鼠暴露在轻度压力后,皮质激素水平明显上升,通过移植正常菌群后可以显著降低皮质激素水平。同样Smith等[27]研究发现益生菌制剂可以改善小鼠的HPA轴的过度活跃。(4)迷走神经。迷走神经起源于大脑,在中枢神经系统和肠神经系统的交流中起着重要作用。研究表明益生菌可以通过迷走神经改善大鼠抑郁症状,而将迷走神经切断后,则无法减弱大鼠抑郁症状[28-29]。
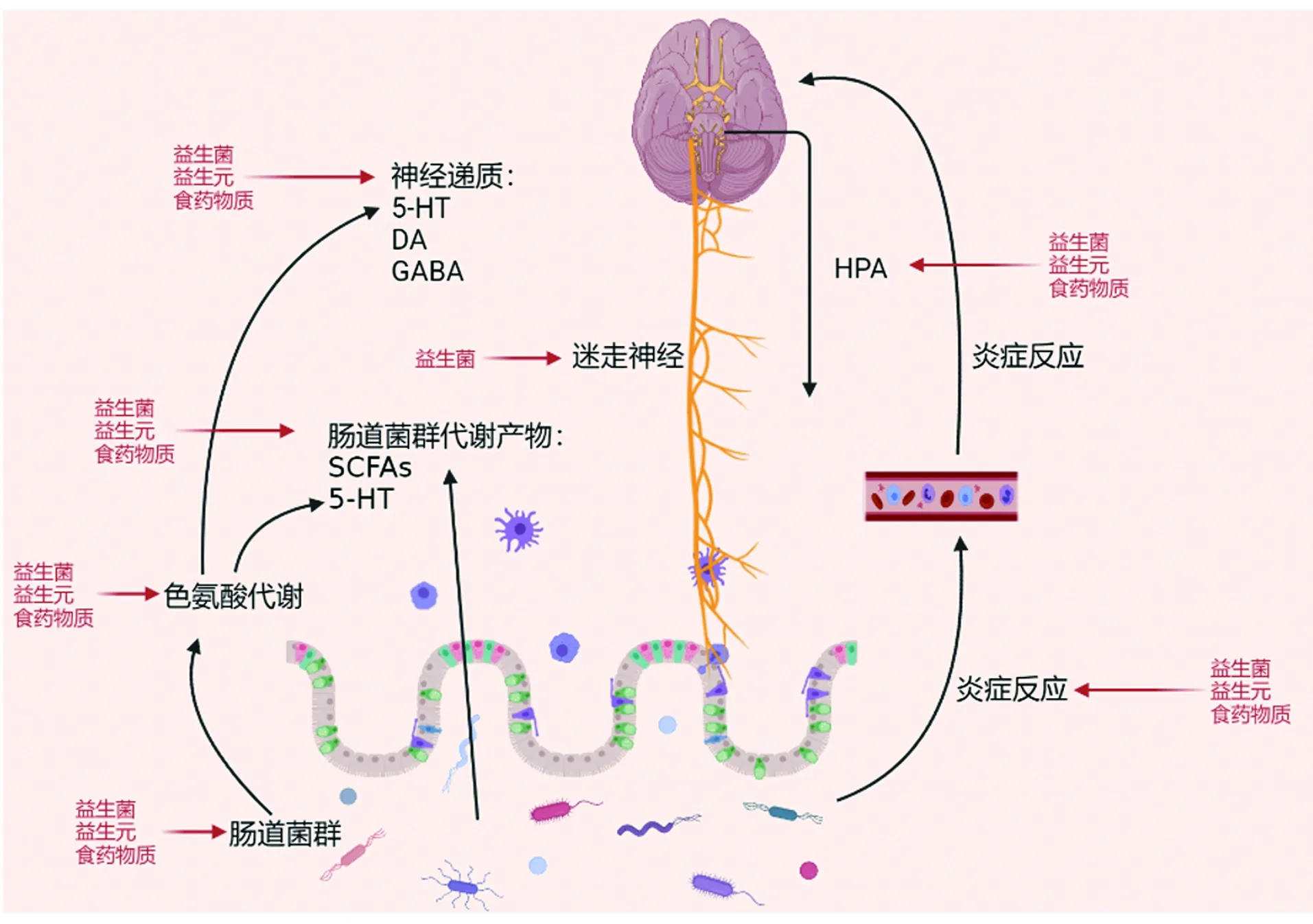
黑色箭头表示基于肠道菌群-肠-脑轴理论中肠道菌群影响抑郁症的机制;红色箭头表示微生态食物改善抑郁症的作用机制。图1 基于肠道菌群-肠-脑轴理论微生态食物改善抑郁症的潜在机制Figure 1 Potential mechanism of microecological food in improvingdepression based on the gut microbiota-gut-brain axis
2 益生菌调节肠道菌群抗抑郁作用
益生菌是指活的微生物,适量摄入可以给宿主带来益处[30]。近年来有越来越多的益生菌用于抗抑郁研究,主要包括双歧杆菌、干酪乳杆菌和瑞士乳杆菌等。益生菌通过改善肠道菌群、影响色氨酸代谢、改善HPA轴功能和炎症反应等改善抑郁症(图 1)。Gu等[31]研究慢性不可预测轻度应激(chronic unpredictable mild stress,CUMS)大鼠发现,CUMS组大鼠中普雷沃氏菌科(Prevotellaceae)和拟杆菌门(Bacteroidetes)显著升高,而厚壁菌门(Firmicutes)显著降低,通过灌胃干酪乳杆菌(Lactobacilluscasei)可以显著逆转以上变化并改善抑郁行为。Tian等[32]从人类粪便或发酵食品中分离出的双歧杆菌能促进RIN14B细胞TPH1基因的表达和5-HT的分泌。同样Liu等[33]研究发现给予GF小鼠注射植物乳杆菌PS128(L.plantarumPS128)会提高小鼠纹状体5-HT的含量。在临床研究中也发现瑞士乳杆菌(L.helveticus)和长双歧杆菌(Bifidobacteriumlongum)可以降低重度抑郁患者犬尿氨酸/色氨酸比值,增加色氨酸/异亮氨酸比率[34]。HPA轴功能障碍一直被认为是抑郁症的特征之一,短双岐杆菌CCFM1025(B.breveCCFM1025)可以降低CUMS小鼠血清CRF和Cort浓度恢复HPA轴正常功能,并且可以调控脑内脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和c-Fos的表达以及恢复肠道菌群异常[35]。此外临床和动物研究结果均表明灭活益生菌同样可以改善抑郁症[36-38]。
除了对单种益生菌进行研究之外,研究人员也研究了多种益生菌联合使用对抑郁症的影响。Murray等[39]研究了富含多种益生菌的kefir(L.lactis,L.cremoris,L.diacetylactis,L.acidophilus)对抑郁症预防作用,发现kefir可以抑制LPS诱导的促炎因子的增加,降低下丘脑、海马和前额叶皮层的中枢细胞因子mRNA的表达,并抑制LPS诱导的肠道微生物区系的改变,并且青春期服用kefir可以预防LPS诱导的抑郁行为。在临床研究中使用多种益生菌联合SSRIs治疗难治性抑郁症,大部分参与者能得到改善[40]。
然而益生菌的抗抑郁效果似乎存在益生菌菌株和治疗个体的差异。Tian等[32]从人类粪便或发酵食物中分离出的20株益生菌,只有两株在多个测试项目中取得较好结果。给予成年雄性BALB/c小鼠和SW(swiss webster)小鼠灌胃L.rhamnosusJB-1TM后,发现BALB/c小鼠在悬尾测试和皮质酮应激反应中对氟西汀和L.rhamnosusJB-1TM的抗抑郁样行为均有增强的反应,而SW小鼠对任何一种治疗都没有反应[41]。Romjin等[42]将L.helveticusR0052和B.longumR0175用于重度抑郁症患者的治疗上,发现益生菌组和安慰剂组在任何心理结果指标或任何基于血液的生物标记物上均没有显著差异。同样Chahwan等[43]研究多菌株组成的Ecologic®Barrier(包含B.bifidumW23,B.lactisW51,B.lactisW52,L.acidophilusW37,L.brevisW63,L.caseiW56,L.salivariusW24,L.lactisW19 和L.lactisW58)对抑郁症的治疗效果,结果显示益生菌治疗前和治疗后的粪便菌群α多样性和β多样性无明显区别,与安慰剂组相比,益生菌组并没有表现出更大程度的抑郁症状减轻作用。综上所述,益生菌在动物和临床研究中均取得良好成果,但不同益生菌治疗不同个体可能存在差异,因此在研究益生菌抗抑郁效果时,应对益生菌菌株和抑郁症个体加以考虑。
3 益生元调节肠道菌群抗抑郁作用
益生元是指必须满足以下3个要求的物质:(1)耐胃酸,不被哺乳动物酶水解,不被胃肠道吸收。(2)能被肠道微生物区系发酵。(3) 刺激有益宿主健康的肠道细菌生长[44]。对益生元改善抑郁症的研究逐年增多,通过分析有关益生元的抗抑郁研究报道可以发现,多数益生元的抗抑郁作用可以用肠道菌群-肠-脑轴理论来解释(图 1)。首先,益生元可以改善肠道菌群组成。研究表明,益生元可以恢复由应激引起的肠道菌群丰富度降低,增加益生菌的丰富度和降低有害菌的丰富度[45-47]。其次,当益生元在肠道中被肠道菌群利用时,除了会影响肠道菌群丰富度,也会影响肠道菌群代谢产物的浓度。给予大鼠灌胃低聚果糖后,大鼠肠道中的蓝细菌丰富度增加[45],而蓝细菌是一类能够分泌重要药理代谢产物的细菌[48]。菊粉可以恢复高脂饮食诱导的抑郁小鼠的丁酸水平,丁酸可以通过促进Tregs分泌IL-10而发挥抗炎作用[49-50]。最后,益生元可以影响促炎因子和抗炎因子水平发挥抗炎作用。Yan等[9]研究发现,CUMS抑郁模型小鼠的结肠、血浆和海马中TNF-α和IL-6 水平升高,结肠中IL-1β水平升高,秋葵多糖治疗可显著降低上述升高的细胞因子水平。
对益生元进行整理分类,具有抗抑郁效果的益生元主要包括低聚半乳糖(galacto-oligosaccharide,GOS)、低聚果糖(fructo-oligosaccharide,FOS)和多糖。(1)低聚半乳糖。实验表明低聚半乳糖可以提高啮齿类动物BDNF和5-HT浓度,具有抗炎作用,并且可以影响肠道菌群组成和肠道SCFAs浓度,表现出抗抑郁和抗焦虑的作用[51-53]。(2)低聚果糖。Chi等[45]从巴戟天提取的低聚果糖能够改善CUMS诱导抑郁行为,降低模型大鼠血浆和尿液皮质酮水平,并且通过提高大鼠肠道有益菌的丰富度(如乳酸菌)和降低有害菌的丰富度(如变形菌)来恢复CUMS大鼠肠道的生态失调。摄入菊粉可降低高脂饮食诱导的小鼠抑郁样行为,上调5-HT和NE的表达,保护小鼠肠道屏障完整性和抑制神经炎症。此外,菊粉摄入改变肠道微生物区系,增加SCFAs的形成[50]。在临床中,菊粉联合L.RhamnosusG可以降低患者的BDI、STAI-state和STAI-trait评分,降低hs-CRP,LPS和TNF-α浓度[54]。(3)多糖。与CUMS模型对照组相比,灌胃银杏叶的水溶性多糖显著改善CUMS模型小鼠尾部悬挂试验、强迫游泳试验和旷场试验中的表现,增加小鼠脑部5-HT和多巴胺(dopamine,DA)水平,可以减轻应激引起的5-HT阳性细胞和DA阳性细胞密度的降低。此外银杏叶的水溶性多糖逆转CUMS小鼠肠道生物失调,并增加了乳酸杆菌物种的丰富度[55]。在一项针对韩国成年人的调查中发现,海藻和蘑菇纤维的摄入量越高,患抑郁症的可能性越低,在另一项针对日本员工的调查中发现从蔬菜和水果中摄取的膳食纤维与抑郁症状显著负相关。这表明特定来源的膳食纤维可能是调节抑郁症的重要饮食因素[56-57]。虽然有大量研究结果表明益生元的抗抑郁作用,但益生元对肠道菌群的影响机制仍需进一步确认。
4 食药物质调节肠道菌群抗抑郁作用
食药物质指既可以作为食品又作为药材的物质,自古以来中医就有“食药同源”的理论,在《黄帝内经太素》就写到:“空腹食之为食物,患者食之为药物”。在现代医学中,研究者也提出通过特定的饮食方式来改善某些神经疾病[58],并且有许多食药物质已被证明能改善抑郁症。基于肠道菌群-肠-脑轴理论,总结归纳食药物质抗抑郁研究进展。栀子豉汤是由淡豆豉和栀子按照1∶2比例熬制而成,研究发现栀子豉汤可以改善CUMS模型大鼠的抑郁行为,能够改善肠道菌群混乱,同时提高产SCFAs的细菌和抗炎菌等有益菌的水平,降低致炎菌和影响色氨酸代谢细菌的水平,在后续的研究中也发现栀子豉汤降低CUMS模型大鼠血清、回肠和下丘脑的炎症因子水平,提高血清、海马、盲肠中5-TH水平[59]。综上,栀子豉汤可能通过改善肠道菌组成,进而影响炎症和色氨酸代谢水平。茯苓含有多糖类、三萜类、甾醇类等成分,具有免疫调节、抗炎、抗氧化等药理作用。Huang等[60]用茯苓水提物(PCW)治疗由CUMS诱导的抑郁大鼠,PCW能降低抑郁大鼠强迫游泳不动时间,抑制CUMS诱导激活的炎症反应,并且抑制额叶皮质p38、NF-κB和TNF-α的表达。茯苓微粉可以改善抑郁大鼠的抑郁行为,增加粪便菌群丰富度和多样性,降低门水平上拟杆菌门和变形菌门水平,提高厚壁菌门水平[61]。肉苁蓉提取物可以调节CUMS模型大鼠肠道菌群,降低醋酸盐和乙酸水平,并且恢复CUMS大鼠脑内5-HT和BNDF的表达[62]。蜜环菌倍半萜芳香酯(protoilludane sesquiterpenoid aromatic esters fromArmillariamellea,PSAM)可以改善CUMS小鼠抑郁行为,同时可抑制海马IL-6、IL-1β和TNF-α水平,下调海马Caspase-9和NLRP3水平,降低血清皮质醇、促肾上腺皮质激素水平和下丘脑CRH水平,上调海马BDNF、pCREB和PSD95水平和下丘脑GR水平,结果提示PSAM可能通过抑制神经炎症、抑制细胞凋亡和抑制HPA轴过度活跃、改善突触来达到抗抑郁的作用[63]。另外Lin等[64]研究发现蜜环菌水提物通过下调Iba-1的蛋白表达来抑制小胶质细胞的激活,同时也降低额叶皮质促炎细胞因子的蛋白表达,达到抗抑郁作用。
除此之外,还有其他相关食药物质抗抑郁的研究报道,灵芝多糖可以通过调节Dectin-1和先天免疫系统改善小鼠抑郁样行为[65],猴头菇乙醇提取物可以促进成年小鼠海马神经发生减少焦虑和抑郁行为[66],五味子素可以通过调节肠道菌群和抗炎作用来改善抑郁症[47]。综上所述,食药物质可以通过改善肠道菌群、降低炎症反应、调节色氨酸代谢等方式改善抑郁行为,因此食药物质对抑郁症的治疗具有重要作用,尤其是它可以作为食品食用,这大大增加了患者的治疗接受度。
5 总结与展望
现有的抑郁症治疗存在一些明显副作用,迫切需要新的治疗方向。随着肠道菌群研究的不断深入,肠道菌群-肠-脑轴理论的提出给予了抗抑郁研究新方向。益生菌、益生元和食药物质等3种微生态食品的抗抑郁研究在动物实验中均取得了很好成果,但仍然存在一些问题有待解决:相同的益生菌用于不同患者或者啮齿类动物,得到不同结果的原因未知;虽然动物实验表明服用益生菌后,益生菌可以定植在肠道中,但其影响肠道中其他菌株丰富度的原因并未被研究;益生元的服用与肠道菌群丰富度变化的关系需进一步明确;食药物质研究多以复合物的形式,其成分复杂多样,具体有效成分有待确定,另外临床和动物研究均提示了食药物质具有调节肠道菌群的作用,但其中调节的方式有待研究,并且某种细菌丰富度的升高或降低是否跟特定的成分相关还未得到确定。此外多数研究仅仅是短期的研究,很少有研究涉及抗抑郁药物的长期抗抑郁效果。未来研究可以重点关注3种微生态制剂对肠道菌群丰富度和代谢的影响方式,并且延长研究时长,以确定抗抑郁药物的长期作用效果。尽管存在一些问题有待解决,但肠道菌群-肠-脑轴将调解肠道菌群作为治疗抑郁症的新方向,将调节肠道菌群作为精神治疗方式,可以极大地提高患者的治疗接受度。
