龙葵愈伤组织生长特性及次生代谢产物积累研究
2022-08-16陈媛媛刘秀岩刘福顺杨世海
陈媛媛,刘秀岩,刘福顺,杨世海
龙葵愈伤组织生长特性及次生代谢产物积累研究
陈媛媛,刘秀岩,刘福顺,杨世海*
吉林农业大学中药材学院,国家中医药管理局药用植物栽培与育种实验室吉林 长春 130118
建立龙葵愈伤组织最优培养体系,研究愈伤组织在不同培养时间下各生理指标变化和澳洲茄碱、澳洲茄边碱的积累,为工业化制备澳洲茄碱和澳洲茄边碱奠定基础。研究不同外植体及培养基对龙葵愈伤组织诱导的影响,采用响应面试验设计方法优化愈伤组织诱导的激素配比,运用考马斯亮蓝G-250法测定可溶性蛋白含量,TTC还原法测定细胞活力,邻苯二酚法测定多酚氧化酶(polyphenol oxidase,PPO)活性,氮蓝四唑光化还原法测定超氧化物歧化酶(superoxide dismutase,SOD)活性,愈创木酚比色法测定过氧化物酶(peroxidase,POD)活性,硫代巴比妥酸显色法测定丙二醛(malondialdehyde,MDA)含量,高效液相色谱法测定澳洲茄碱及澳洲茄边碱含量。愈伤组织诱导最佳外植体为龙葵茎段,最适培养基为MS+1.43 mg/L NAA+2.15 mg/L 6-BA+2.48 mg/L KT,愈伤组织增殖最适培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA。愈伤组织鲜质量增长量呈“S”型趋势, 20 d时细胞活力达到最高峰值,可溶性蛋白含量与POD活性均呈先升高后降低的趋势,SOD活性在20 d与30 d出现2个峰值,MDA含量呈先降低后升高的变化趋势,在培养后期PPO活性下降,可能与愈伤组织褐化有关,澳洲茄碱与澳洲茄边碱含量变化趋势一致,在第30天时达到峰值。龙葵愈伤组织生长期为25 d,同时也为最适的愈伤组织鲜质量收获期,25 d后会出现不同程度褐化。其愈伤组织中的次生代谢产物积累和细胞生长过程通常是负相关的,次生代谢产物的合成大多在愈伤组织的生长后期。
龙葵;愈伤组织;增殖;生理特性;次生代谢产物;澳洲茄碱;澳洲茄边碱
龙葵L.为茄科茄属一至多年生草本双子叶植物, 主要为地上干燥部分入药,具有清热解毒、活血化瘀、利尿等功效,主治感冒发热、细菌性痢疾、急性乳腺炎、慢性支气管炎、泌尿系感染、癌性胸腹水等疾病[1-3]。现代药理研究表明以澳洲茄边碱和澳洲茄碱为代表的甾体生物碱是龙葵抗肿瘤的主要有效成分,能够抑制多种肿瘤细胞的增殖[4]。近年来,野生龙葵难以满足人们在医药和农业上的需求,而人工种植龙葵受地域、土壤、温度和大面积占用耕地等诸多因素限制。国内外对于龙葵的报道研究大多集中于有效化学成分及相关生物活性[5-10]、对土壤中砷、镉等重金属的富集作用[11-12]、种子萌发特性研究[13]以及再生体系的建立[14],迄今为止,关于龙葵愈伤组织诱导和在增殖过程中生理生化特性及其次生代谢产物积累动态研究鲜有报道。随着生物技术的发展,国内外利用植物组织培养技术生产次生代谢产物已经获得重大进展[15]。利用组织培养技术生产次生代谢产物不受季节和地理等自然条件限制,可以在完全人工控制的条件下生产次生代谢产物。愈伤组织的诱导是建立植物组织培养体系的前提,同时也为澳洲茄碱和澳洲茄边碱规模化生产奠定基础。本研究基于组织培养技术,筛选龙葵愈伤组织诱导的最佳外植体和最适培养基类别,并运用响应面法优化龙葵愈伤组织诱导培养基,测定增殖过程中龙葵愈伤组织可溶性蛋白含量和细胞活力,绘制生长曲线,测定不同阶段愈伤组织中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)的活性,丙二醛(malondialdehyde,MDA)含量,以及澳洲茄碱和澳洲茄边碱的含量;以期获得龙葵愈伤组织继代培养的最佳时间和澳洲茄碱、澳洲茄边碱含量的最佳获得周期,为细胞工程大规模生产龙葵次生代谢产物提供理论参考。
1 材料与仪器
1.1 材料与试剂
材料于2019年采自吉林省四平市梨树县龙葵规范化种植基地,经吉林农业大学中药材学院杨世海教授鉴定为龙葵L.果实自然成熟干燥种子,置于4 ℃冰箱保存。对照品澳洲茄碱(202023)、澳洲茄边碱(202026)购自成都埃法生物科技有限公司,质量分数均大于98%;MS培养基(青岛海博生物技术有限公司)、琼脂粉(天津市科密欧化学试剂有限公司)、α-萘乙酸(中国惠世生化试剂有限公司)、6-苄基腺嘌呤(中国新兴化工试剂研究所)、激动素(中国惠世生化试剂有限公司)、色谱甲醇(北京化工厂)等。
1.2 仪器
VS-840-1型超净工作台(上海博迅实业有限公司医疗设备厂),立式高压灭菌锅(宁波久兴医疗器械有限公司),Waters-e2695型检测器UV2489(美国Waters有限公司),紫外可见分光光度计(北京普析通用仪器责任有限公司),BIC-250型程控人工气候箱(上海博迅实业有限公司医疗设备厂),BAS124S电子分析天平(赛多利斯科学仪器有限公司),HHS型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂)等。
2 方法
2.1 诱导龙葵无菌苗
在超净工作台中将龙葵种子用浓度为0.1%升汞消毒7 min,后用无菌水冲洗3次,每次30 s,将其均匀接种于MS固体培养基中(蔗糖3%,琼脂0.7%,pH值为5.8~6.0),置于人工气候箱中培养(温度25 ℃、光照度60%、光照时间12 h/d)。2周后,选择生长状态良好的龙葵无菌苗作为诱导愈伤组织的外植体材料。
2.2 最适外植体筛选
使用高压灭菌过的解剖刀将龙葵无菌苗分为根、茎、叶3部分,根与茎切为1.0 cm左右的小段,叶片切为0.5 cm×0.5 cm大小,接种于MS+1.43 mg/L NAA+2.15 mg/L 6-BA+2.48 mg/L KT诱导愈伤培养基表面。每部位处理11瓶,每瓶5个外植体。置于人工气候箱中培养(温度25 ℃、光照度60%、光照时间12 h/d),28 d后统计诱导率。
愈伤组织诱导率=长出愈伤组织外植体数/接种愈伤组织外植体数
2.3 最适培养基筛选
根据以上实验结果,选用龙葵无菌苗的茎段为外植体,分别配制MS、1/2MS、B5、N6、White 5种愈伤组织诱导培养基(蔗糖3%、琼脂0.7%、pH值为5.8~6.0),移液枪分别吸取1.43 mg/L NAA、2.15 mg/L 6-BA、2.48 mg/L KT加入各培养基中,在超净工作台中将茎段接种于5种培养基,每种培养基接种11瓶,每瓶5个外植体,置于人工气候箱中培养(温度25 ℃,光照度60%,光照时间12 h/d),28 d后统计诱导率。
2.4 愈伤组织诱导最适激素配比
采用Design Expert 8.0.6统计分析软件,按照Box-Behnken实验方案进行响应面优化设计,以NAA、6-BA、KT 3种植物生长调节剂为因素,每因素设计3个质量浓度水平,以愈伤组织诱导率为响应值,设计3因素3水平响应面试验(表1)。将龙葵无菌苗的茎段接种于不同激素配比的固体MS培养基表面,共17组处理,每处理接种11瓶,每瓶5个外植体,培养条件同上,28 d后统计愈伤组织诱导率。
表1 Box-Behnken设计
Table 1 Box-Behnken design
水平因素/(mg·L−1) NAA6-BAKT 1000 21.51.51.5 33.03.03.0
2.5 最适增殖激素浓度配比
以生长状态良好的龙葵愈伤组织为试验材料,采用3因素3水平完全随机试验,6-BA(0.5、1、2 mg/L)和NAA(0.1、0.2、0.5 mg/L),共9个处理,每处理接种11瓶,每瓶接种0.3 g愈伤组织,培养条件同上,于28 d后用定性滤纸吸干其表面水分称量,统计愈伤组织增殖倍数。
愈伤组织增殖倍数=(增殖后愈伤组织质量−原愈伤组织质量)/原愈伤组织质量
2.6 愈伤组织增殖培养
根据上述实验所筛选的最适增殖激素浓度配制培养基,将初代愈伤组织0.3 g转接至增殖培养基中,培养条件同上。于试验的第5、10、15、20、25、30、35天分别取愈伤组织用于生长曲线绘制、生理生化指标和澳洲茄碱及澳洲茄边碱含量测定。
2.7 愈伤组织生长周期测定
在无菌条件下取增殖愈伤组织,用定性滤纸吸干其表面水分,测定鲜质量,每5天取样1次,每次6个重复,绘制生长曲线。
2.8 增殖过程中生理生化指标测定
采用考马斯亮蓝G-250法[16]测定可溶性蛋白含量,TTC还原法[17]测定细胞活力,邻苯二酚法[18]测定PPO活性,氮蓝四唑光化还原法[16]测定SOD活性,愈创木酚比色法[16]测定POD活性,硫代巴比妥酸显色法[16]测定MDA含量,各生理指标重复测定3次,取平均值。
2.9 澳洲茄碱与澳洲茄边碱含量测定
2.9.1 色谱条件 Agilent ZORBAXSB-C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-2 mmol/L Na2HPO4水溶液(33∶67)为流动相,柱温为25 ℃,体积流量1.0 mL/min,进样量为20 μL,检测波长为203 nm。
2.9.2 对照品溶液的制备 精密称取对照品澳洲茄碱10.4 mg、澳洲茄边碱10.2 mg置于10 mL量瓶中,以色谱甲醇定容至刻度线,分别制成1.04 mg/mL的澳洲茄碱和1.02 mg/mL澳洲茄边碱对照品溶液I。取对照品溶液I 3.75 mL于5 mL量瓶中,以色谱甲醇定容至刻度线,分别制成含0.78 mg/mL澳洲茄碱和0.765 mg/mL澳洲茄边碱对照品溶液Ⅱ,依次取对照品溶液I 2.5、1.25、0.75、0.25 mL于5 mL量瓶中,以色谱甲醇定容至刻度线,混匀,依次得到含0.52、0.26、0.156、0.052 mg/mL的澳洲茄碱和0.51、0.255、0.153、0.051 mg/mL澳洲茄边碱对照品溶液III、Ⅳ、Ⅴ、Ⅵ。
2.9.3 供试品溶液的制备 于增殖进程的第5、10、15、20、25、30、35天取龙葵愈伤组织作为供试样品,将样品烘干至恒定质量,研磨后过筛,孔径为0.25 mm。精密称取各样品粉末0.1 g置于10 mL离心管中,精密加入2 mL 80%色谱甲醇,称定并记录质量。超声处理(50 ℃、300 W、频率50 kHz)40 min,放冷,再称定质量,以80%的色谱甲醇补足减失的质量,摇匀,滤过,取续滤液,在进样前经0.22 μm微孔滤膜滤过,滤液即为龙葵澳洲茄碱、澳洲茄边碱待测样品。
2.10 数据处理
采用SPSS 20.0统计分析软件进行实验数据的分析处理,每一实验处理重复3次,并用LSD检测其差异显著性,并利用Origin 2017进行图表绘制。
3 结果与分析
3.1 不同外植体对龙葵愈伤组织诱导率的影响
以不同外植体为试验材料均可诱导出愈伤组织,但在诱导率和生长状态上均存在显著差异,见图1,以茎为外植体所得愈伤组织诱导率最佳为80%,以叶为外植体诱导愈伤组织能力次之为49.09%,以根为外植体诱导愈伤组织能力最弱为16.36%。由实验结果可知,以茎为外植体时,愈伤组织呈黄绿色质地水润较疏松;以叶片和根为外植体时,愈伤组织呈黄白色生长缓慢,后期多半褐化。因此,茎是诱导龙葵愈伤组织的最适外植体。

不同小写字母代表差异显著(P<0.05),下同
3.2 不同培养基对龙葵愈伤组织诱导率的影响
不同培养基中所含营养元素不同,诱导愈伤组织的能力也迥然不同,因此,愈伤组织诱导率和生长状态间都存在显著差异。如图2所示,诱导率:MS(87.27%)>N6(64.45%)>1/2MS(54.55%)>B5(38.18%)>White(0%)。MS和N6培养基诱导出的愈伤组织较疏松,呈黄绿色质地且生长较快,B5培养基诱导出的愈伤组织为淡黄色,而White培养基上的茎段几乎全部褐化,不能诱导出愈伤组织,故而,MS培养基为诱导龙葵愈伤组织的最适培养基。

图2 不同培养基对龙葵愈伤组织诱导率的影响(, n = 3)
3.3 不同激素配比对愈伤组织诱导率的影响
采用Design Expert 8.0.6统计分析软件的Box-Behnken方法设计分析试验,以NAA(A)、6-BA(B)、KT(C)3种植物生长调节剂为因素,诱导率为响应值。对表2数据进行多元回归拟合分析,得到诱导率与各因素变量的二次回归方程:=21.59+21.21 A+27.42 B+21.36 C-1.21 AB-2.83 AC+0.61 BC-3.74 A2-6.36 B2-4.75 C2,其二次回归方程显著性检验及方差分析见表3。
表2 愈伤组织诱导BOX-Behnken试验设计及结果
Table 2 BOX-Behnken test design and results of callus induction
试验号NAA/(mg·L−1)6-BA/(mg·L−1)C/(mg·L−1)诱导率/% 13.00.01.561.818 21.51.51.581.818 31.50.03.050.909 41.51.51.585.455 51.50.00.045.455 61.51.51.589.091 71.53.03.078.182 80.01.53.074.545 91.53.00.067.273 103.01.50.070.909 110.03.01.569.091 123.03.01.576.364 131.51.51.587.273 143.01.53.072.727 150.00.01.543.636 161.51.51.583.636 170.01.50.047.273
如表3所示,各因素对愈伤组织诱导率影响的大小依次为6-BA>NAA>KT,且NAA、6-BA、KT对愈伤组织诱导的线性效应极显著(<0.01),二次项A2、B2、C2及交互项AC的值均小于0.01,表明对诱导率的影响也极显著。
回归方程模型<0.01,表明该模型较显著;失拟项值为0.389 8(>0.05),表明失拟项相对于误差项不显著;模型拟合相关系数(2)=0.981 9,校正决定系数(2adj)=0.958 7,表明该模型拟合度良好,误差较小,可用该回归模型代替试验真实点,对诱导龙葵愈伤组织的培养基配比进行预测和分析。
表3 愈伤组织回归方程显著性检验及方差分析
Table 3 Significance test and variance analysis of callus regression equation
项目平方和自由度均方F值P值显著性 回归方程模型3 550.85 9394.54 42.30< 0.000 1** A 279.34 1279.34 29.95 0.000 9** B 992.17 1992.17106.37<0.000 1** C 258.25 1258.25 27.69 0.001 2** AB 29.75 1 29.75 3.19 0.117 3 AC 161.98 1161.98 17.37 0.004 2** BC 7.44 1 7.44 0.80 0.401 5 A2 297.75 1297.75 31.92 0.000 8** B2 863.19 1863.19 92.54< 0.000 1** C2 480.42 1480.42 51.51 0.000 2** 残差 65.29 7 9.33 失拟项 32.23 3 10.74 1.30 0.389 8 误差项 33.06 4 8.27 总和3 616.1416
**<0.01,极显著差异
**< 0.01, the difference is extremely significant
采用Design Expert 8.0.6统计分析软件,得到诱导龙葵愈伤组织的最佳培养基:MS+1.43 mg/L NAA+2.15 mg/L 6-BA +2.48 mg/L KT,预测龙葵愈伤组织的诱导率为87.069%,为验证实验结果的可靠性,使用诱导龙葵愈伤组织最适培养基进行验证试验,实验所得诱导率为86.363%,与预测值相差0.706%,表明由响应面优化法所得激素配比真实可靠。各因素对愈伤组织诱导率影响的三维响应面分析图及二维等高线图见图3。

图3 不同激素配比与愈伤组织诱导率的响应面分析
3.4 不同激素浓度配比对愈伤组织增殖的影响
将初代培养28 d且生长状况良好的龙葵愈伤组织接种到以下9组培养基中,结果如表4所示,在组激素浓度配比中第5组增殖倍数最高为7.70,愈伤组织呈黄绿色且质地疏松,生长速度较快,第1组的增殖倍数最低为5.85,后期愈伤组织几乎全部褐化。由此可得,龙葵愈伤组织最适增殖培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA。
表4 不同激素浓度配比对愈伤组织增殖的影响
Table 4 Effect of different hormone concentration ratios on callus proliferation
组别6- BA/(mg·L−1)NAA/(mg·L−1)增殖倍数 10.50.15.85±0.18d 20.50.25.95±0.28cd 30.50.57.07±0.38abc 41.00.16.18±0.45bcd 51.00.27.70±0.49a 61.00.56.79±0.34abcd 72.00.16.29±0.29bcd 82.00.27.26±0.41ab 92.00.56.51±0.26bcd
3.5 龙葵愈伤组织生长曲线
龙葵愈伤组织生长曲线呈“S”型模式,如图4所示,在外植体接种的第0~10天为生长延迟期,10~25 d为对数增长期,期间愈伤组织生长速度最快且愈伤组织为较疏松的黄绿色,25~35 d为生长平缓期,愈伤组织鲜质量虽然仍在增长,但增长量较低且伴有严重褐化。因此,25 d为龙葵愈伤组织的最适增殖时间,同时可以达到最大增长量的目的,且减少愈伤组织褐化现象。

图4 龙葵愈伤组织鲜质量增长曲线()
3.6 龙葵愈伤组织生理生化特征
3.6.1 细胞活力变化 龙葵愈伤组织细胞活力变化如图5-a所示,第5天时愈伤组织培养时间较短,愈伤组织需要适应环境,细胞活力为整个培养过程的最低值1.13 mg/(g·h),当愈伤组织适应培养环境后,5~20 d细胞活力呈上升趋势,20 d时达到细胞活力最高峰值为1.25 mg/(g·h),在20 d之后愈伤组织增殖过快,呼吸作用旺盛,使得培养基内养分消耗殆尽,愈伤组织内累积有害物质,出现褐化现象,因此后期细胞活力降低。
3.6.2 可溶性蛋白含量变化 龙葵愈伤组织可溶性蛋白含量变化呈先升高后降低的变化趋势,如图5-b,在第5~25天可溶性蛋白含量呈不断上升趋势,并且在25 d时可溶性蛋白含量达到最高值4.95 mg/g,推测是由于5~25 d愈伤组织增殖能力较强,细胞分裂速度较快,细胞内合成大量蛋白质,以维持细胞生长分化。25 d后可溶性蛋白含量降低,可能是由于生存环境逐步恶劣,愈伤组织生长速度变缓慢且伴随愈伤组织褐化,从而合成蛋白质速率降低。
3.6.3 SOD活性变化 龙葵愈伤组织SOD活性变化如图5-c,其增殖过程中出现2个峰值,分别为第20、30天。在第20天时,愈伤组织处于对数增长期,愈伤组织生长旺盛且细胞分裂较快,具有较强的抗胁迫能力,因此SOD活性较高。随后SOD活性降低,30 d时SOD活性再次升高至20 d时水平,这一现象可能是由于培养后期,MS培养基中营养元素被不断消耗,生存环境不断恶化,且伴随着愈伤组织的褐化。为降低愈伤组织衰老细胞的氧化自由基,刺激细胞提高SOD活性以抵抗不良环境。
3.6.4 POD活性变化 龙葵愈伤组织POD活性变化与可溶性蛋白含量变化趋势较为相似,呈先上升后下降变化趋势,如图5-d,在第5~25天 POD活性呈上升趋势,在第25天 POD活性到达最高峰值为2 678.67 U/g。在25 d后由于愈伤组织褐化,POD活性随之逐渐降低。
3.6.5 PPO活性变化 PPO是愈伤组织褐化的关键酶,龙葵愈伤组织在不同培养时间的PPO活性变化如图5-e所示。5~10 d PPO活性呈下降趋势,在第5天时酶活性比10 d时高,可能由于外植体接种时间较短,褐化现象不严重。10~25 d酶活性呈显著升高趋势,在第25天时达到最高峰值25.73 U/g,此阶段愈伤组织增殖速度较快,多为黄绿色,因此PPO活性升高。由于培养环境恶化,褐化加剧,25~35 d PPO活性再次降低。

图5 愈伤组织不同培养时间相关生理指标变化()
3.6.6 MDA含量变化 龙葵愈伤组织MDA含量呈现下降后上升的变化趋势,如图5-f所示。5~25 d MDA含量呈显著下降趋势,25 d时为最低峰值0.643 nmol/g。此阶段龙葵愈伤组织处于生长旺盛期,细胞代谢能力较强,愈伤组织受损伤程度较低。25~35 d MDA含量呈逐渐上升趋势,由于愈伤组织增殖速度较快,培养基养分消耗速度随之加快,pH值发生改变,从而使愈伤组织损伤程度加剧。
3.7 澳洲茄碱和澳洲茄边碱含量测定结果
根据“2.9”项方法,绘制澳洲茄碱、澳洲茄边碱标准曲线,以澳洲茄碱对照品质量浓度为横坐标,以峰面积为纵坐标绘制标准曲线,拟合的回归方程为=5×106+86 350,2=0.999 4,表明澳洲茄碱对照品梯度浓度线性关系好。以澳洲茄边碱对照品质量浓度为横坐标,以峰面积为纵坐标绘制标准曲线,拟合的回归方程为=4×106+29 272,2=0.999 8,表明澳洲茄边碱对照品梯度浓度线性关系好。按照“2.9”项方法进样,根据标准曲线计算澳洲茄碱、澳洲茄边碱含量。
龙葵愈伤组织中澳洲茄碱和澳洲茄边碱含量积累变化趋势一致,如图6,龙葵愈伤组织中澳洲茄和澳洲茄边碱含量在前20 d增长较为缓慢,20 d后增长速度加快,在第30天时澳洲茄碱和澳洲茄边碱含量达到最高峰值为1.93、2.70 mg/g,随后出现下降趋势。龙葵愈伤组织培养前期,增殖速度较快,细胞活力和愈伤组织获得量较高,但次生代谢产物含量较低。随着培养时间的增加,培养基pH值发生变化,细胞之间竞争激烈使培养基营养成分被消耗,愈伤组织受到环境胁迫,细胞活力降低,次生代谢产物含量增加。在愈伤组织增殖旺盛时澳洲茄碱和澳洲茄边碱含量较低,但在培养后期愈伤组织增殖生长缓慢时澳洲茄碱和澳洲茄边碱含量反而更高,说明龙葵愈伤组织中澳洲茄碱和澳洲茄边碱的合成和愈伤组织的生长是不平行相关的。
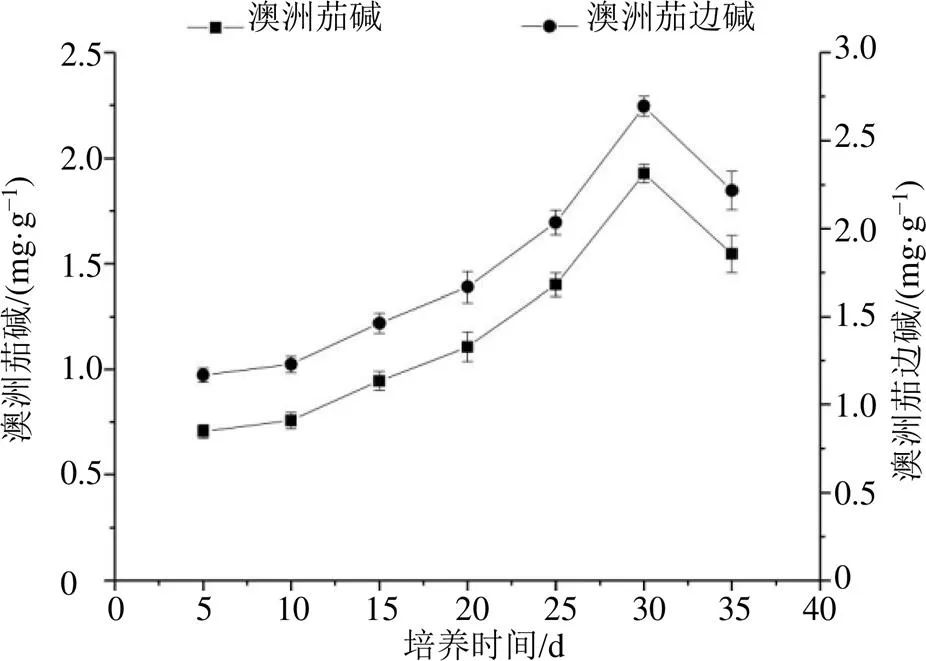
图6 愈伤组织澳洲茄碱及澳洲茄边碱含量积累(, n = 3)
4 讨论
诱导愈伤组织是建立植物再生体系和遗传性转化等的重要途径,而适宜外植体的选择是愈伤组织诱导的前提条件。王佳兴[19]对黄果龙葵的研究表明,叶片为最适宜的愈伤组织外植体来源。本实验中以龙葵无菌苗叶片、茎段和根为外植体分别诱导愈伤组织,实验结果表明:不同外植体之间愈伤组织诱导率和生长速度有显著性差异,其中茎段>叶片>根,茎段为诱导龙葵愈伤组织的最适外植体。不同种类培养基中所含营养成分不同,本实验中MS培养基诱导龙葵愈伤组织诱导率最高,这与付航等[20]对防风愈伤组织的研究结果相一致。由于MS培养基中无机盐和硝酸盐浓度较高,因此最适宜培养龙葵愈伤组织,为龙葵愈伤组织提供丰富的营养物质且有利于次生代谢产物的累积。植物组织培养过程中,植物细胞脱分化形成愈伤组织时,外源激素可以通过影响内源激素的合成及代谢来影响内源细胞分裂素和细胞生长素的水平。王佳兴[19]对黄果龙葵愈伤组织诱导中得到的最适培养基为:MS+KT 2 mg/L+NAA 0.1 mg/L,良流等[21]对少花龙葵愈伤组织诱导中得到的最适培养基为:MS+6-BA 0.5 mg/L+NAA 0.4 mg/L。本实验中采用Design Expert 8.0.6统计分析软件对龙葵愈伤组织培养体系进行优化,优化后得到培养龙葵愈伤组织的最适培养基为:MS+NAA 1.43 mg/L+6-BA 2.15 mg/L+KT 2.48 mg/L。采用2因素3水平完全随机试验得到龙葵愈伤组织最适增殖培养基为:MS+6-BA 1.0 mg/L+NAA 0.2 mg/L。
愈伤组织生长曲线是确定愈伤组织收获时间的重要依据,本实验结果表明龙葵愈伤组织的鲜质量增长量变化趋势呈“S”型,与余慧等[22]对欧洲卫矛愈伤组织在光照下的鲜质量增长量变化趋势基本一致。25 d为最适的愈伤组织鲜质量收获期,在实际生产时可考虑培育25 d后继代至另一培养基,从而保证在最大程度上使愈伤组织长期处于快速增殖状态。细胞活力的大小代表着细胞新陈代谢能力的强弱,也意味着线粒体中有氧呼吸的强弱[23]。0~10 d为生长延迟期,愈伤组织增殖速度较慢,因此细胞活力在前10 d增长趋势较为平缓。10~25 d为对数增长期,20 d时细胞代谢能力最强,此时细胞活力达到最高峰值。25 d时细胞分裂基本停止,但愈伤组织体积还在增大,25 d后细胞完全停止分裂,愈伤组织停止增殖,部分愈伤组织出现褐化现象,新陈代谢能力减弱,细胞活力出现降低趋势。
可溶性蛋白含量的变化在一定程度上反映了愈伤组织的生理代谢变化,可溶性蛋白含量高的愈伤组织,新陈代谢和细胞分裂能力较强。本实验结果表明,可溶性蛋白含量变化呈先升高后降低的变化趋势,与孙睿等[24]对雷公藤愈伤组织的研究结果相似。POD是高等植物中普遍存在的可以清理细胞代谢过程中产生有害过氧化物的酶,并且与植物的生长分化密切相关。在本实验中,POD活性与可溶性蛋白含量有一定协同关系并表现出相同的变化趋势,先上升后下降,与刘亚菊等[25]对平贝母鳞片离体培养的研究结果相似。SOD和POD 2种抗氧化酶协同作用能减少细胞中的活性氧和有害过氧化物,从而增强植物抵抗逆境胁迫的能力[24]。在龙葵愈伤组织增殖前期,SOD活性处于上升趋势,在20、30 d时均出现峰值,表明愈伤组织受到氧化胁迫,需SOD活性上升以消除多余活性氧。在愈伤增殖的前25 d,MDA含量一直处于下降趋势,且在25 d时到达最低值,表明抗氧化系统启动后,减弱了细胞受氧化自由基和有害过氧化物的胁迫。25 d后由于培养基营养成分被消耗、pH值改变、愈伤组织褐化等因素使细胞受到损伤,因此,MDA含量出现上升趋势。PPO可以氧化多酚类物质形成醌,从而导致愈伤组织产生褐化现象[26]。由实验结果可知,在愈伤组织增殖的前期PPO活性较低,随着培养时间的增加,PPO活性呈现上升趋势,在25 d时达到最大值,但此时愈伤组织基本无褐化。25 d后愈伤组织褐化严重,PPO活性较低。余慧等[22]研究得出PPO活性越高,褐化程度越低,与本研究结果一致;此外,任振兴等[26]的研究结果表明PPO活性与褐化程度呈正相关,两者结论不一,可能与植物个体特性有关,有待进一步研究。
愈伤组织中的次生代谢产物积累和细胞生长过程通常是负相关的,次生代谢产物的合成大多在愈伤组织生长的后期[24]。龙葵全草皆可入药,但青果期的龙葵果实中所含澳洲茄碱和澳洲茄边碱含量最高[3],有研究表明吉林省四平市的龙葵鲜果中澳洲茄碱和澳洲茄边碱的含量较高为7.08、7.77 mg/g,干果中澳洲茄碱和澳洲茄边碱含量为5.08、5.11 mg/g[27]。由本实验结果可知,澳洲茄碱和澳洲茄边碱含量变化趋势一致,在30 d时含量最高,为1.93、2.70 mg/g,澳洲茄碱和澳洲茄边碱含量约为鲜果的0.27、0.35倍,约为干果的0.38、0.53倍。利用植物组织培养技术诱导龙葵愈伤组织,是生产次生代谢产物快捷高效的一种方法。本研究为建立高效的龙葵愈伤组织培养体系和工业化生产澳洲茄碱及澳洲茄边碱提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 1978: 154.
[2] 梅全喜, 张志群, 管静, 等. 龙葵的临床应用研究进展 [J]. 亚太传统医药, 2011, 7(11): 168-170.
[3] 刘林凤, 高宝益, 高淑红, 等. 龙葵药材质量标准 [J]. 中国实验方剂学杂志, 2013, 19(9): 77-79.
[4] 胡淑曼, 付志飞, 张培育, 等. 响应面法优化龙葵中澳洲茄边碱的提取工艺及其体外抗肿瘤活性研究 [J]. 化学与生物工程, 2015, 32(4): 21-25.
[5] Loganayaki N, Siddhuraju P, Manian S. Antioxidant activity of two traditional Indian vegetables:L. andL [J]., 2010, 19(1): 121-127.
[6] Wang H C, Chung P J, Wu C H,.L. polyphenolic extract inhibits hepatocarcinoma cell growth by inducing G2/M phase arrest and apoptosis [J]., 2011, 91(1): 178-185.
[7] Son Y O, Kim J, Lim J C,. Ripe fruits ofL. inhibit cell growth and induces apoptosis in MCF-7cell [J]., 2003, 41(10): 1421-1428.
[8] 刘为为, 刘延庆, 戴小军. 龙葵抗肿瘤作用的研究进展 [J]. 中药材, 2009, 32(3): 462-465.
[9] 罗文娟, 王光辉, 周新兰, 等. 螺甾皂苷类化合物的体外抗人肝癌细胞增殖作用 [J]. 现代肿瘤医学, 2007, 15(3): 307-308.
[10] 唐朝辉, 张岩, 李娜, 等. 澳洲茄边碱提取纯化工艺及其抗肿瘤作用的研究 [J]. 中国中药杂志, 2011, 36(16): 2192-2195.
[11] 曾星, 李伟亚, 陈章, 等. 龙葵修复镉污染土壤的研究进展 [J]. 草业科学, 2019, 36(5): 1308-1316.
[12] 罗琼, 葛青, 刘小京, 等. 重金属超富集植物龙葵对镉响应的蛋白组学分析 [J]. 中国生态农业学报, 2015, 23(11): 1429-1436.
[13] 于爽, 高剑, 杨新宇, 等. 盐碱胁迫对龙葵种子萌发及幼苗生长的影响 [J]. 江苏农业科学, 2019, 47(17): 162-165.
[14] 张英. 龙葵再生体系建立及试管开花研究 [D]. 牡丹江: 牡丹江师范学院, 2016.
[15] 陈东芳. 刀豆愈伤组织建立及愈伤组织中刀豆氨酸的形成 [D]. 合肥: 安徽农业大学, 2010.
[16] 李合生. 植物生理生化实验原理和技术 [M]. 北京: 高等教育出版社, 2000: 263.
[17] 张玉琼, 陈娜, 周建辉, 等. 石蒜悬浮细胞系的建立及其生物碱累积的研究 [J]. 中草药, 2013, 44(24): 3540-3545.
[18] 杨暖. 北美豆梨叶色变化及生理特性研究 [D]. 泰安: 山东农业大学, 2016.
[19] 王佳兴. 黄果龙葵再生体系的建立及染色体核型分析 [D]. 牡丹江: 牡丹江师范学院, 2020.
[20] 付航, 黄涵签, 王妍, 等. 防风愈伤组织诱导及植株再生体系的建立 [J]. 中草药, 2018, 49(13): 3127-3133.
[21] 良流, 陈川平. 少花龙葵的组织培养 [J]. 琼州大学学报, 2002, 9(3): 67-68.
[22] 余慧, 丁彦芬, 卓启苗, 等. 欧洲卫矛愈伤组织分化及其生理生化特性 [J]. 安徽农业大学学报, 2019, 46(3): 460-465.
[23] 刘华. 悬浮培养红豆杉细胞活力及存活率与生长周期的关系 [J]. 生物学杂志, 2002, 19(1): 19-20.
[24] 孙睿, 朱留刚, 封磊, 等. 雷公藤愈伤组织的生长特征及内酯醇的积累 [J]. 森林与环境学报, 2016, 36(3): 306-311.
[25] 刘亚菊, 殷红, 朱四易. 噻二唑苯基脲在平贝母组织培养中的作用 [J]. 西北大学学报: 自然科学版, 2000, 30(2): 139-142.
[26] 任振兴, 耿韶华, 王梦亮, 等. 黄芩愈伤组织中多酚氧化酶活性与黄芩苷合成的关系研究 [J]. 中草药, 2009, 40(11): 1796-1799.
[27] 张帆. 基于抗肿瘤成分龙葵碱含量测定的龙葵果产地质量与煎服方法研究 [D]. 广州: 广州中医药大学, 2017.
Growth characteristics and secondary metabolite accumulation of
CHEN Yuan-yuan, LIU Xiu-yan, LIU Fu-shun, YANG Shi-hai
Laboratory of Cultivation and Breeding of Medicinal Plants of National Administration of Traditional Chinese Medicine, College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China
To establish an optimal culture system forcallus, study the changes of physiological indicators and the accumulation of solasonine and solamargine in callus at different culture time, and lay the foundation for the industrial preparation of solasonine and solamargine.The effects of different explants and culture media on callus induction ofwere investigated, response surface test design method was used to optimize the hormone ratio of callus induction, Coomassie brilliant blue G-250 method was used to determine soluble protein content, TTC reduction method was used to determine cell viability, catechol method was used to determine polyphenol oxidase (PPO) enzyme activity, nitrogen blue tetrazolium photochemical reduction method was used to determine superoxide dismutase (SOD) enzyme activity, guaiacol colorimetry was used for the determination of POD enzyme activity, thiobarbituric acid color method was used to determine the content of MDA, and the content of solasonine and solamargine was determined by HPLC.The best explant for callus induction was the stems of, and the best medium was MS + NAA1.43 mg/L + 6-BA 2.15 mg/L + KT 2.48 mg/L, and the most suitable medium for callus proliferation was MS + 6-BA 1.0 mg/L + NAA 0.2 mg/L. The fresh weight growth of callus showed an "S"-shaped trend, and the cell viability reached the highest peak at 20 d, the soluble protein content and POD activity both increased first and then decreased. SOD activity showed two peaks at 20 d and 30 d, and the MDA content decreased first and then increased. In the later period of culture, the decrease of PPO activity may be related to callus browning. Solasonine and solamargine content changed in the same trend, reaching a peak on the 30th day.The callus growth period ofis 25 d, and it is also the most suitable harvest period for callus fresh weight. After 25 d, browning will appear in varying degrees. The accumulation of secondary metabolites in the callus and the cell growth process are usually negatively correlated, and the synthesis of secondary metabolites is mostly in the late growth period of the callus.
L.;callus; proliferation; physiological characteristics; secondary metabolites; solasonine; solamargine
R286.2
A
0253 - 2670(2022)16 - 5170 - 09
10.7501/j.issn.0253-2670.2022.16.026
2022-01-06
中药标准化项目(202021800)
陈媛媛(1996—),女,在读硕士,研究方向为中药资源学。Tel: 15849515335 E-mail: 271019399@qq.com
杨世海,教授,博士生导师,研究方向为中药生物技术、中药育种、药用植物栽培。Tel: 15568877267 E-mail: jlyangs@163.com
[责任编辑 时圣明]
