Box-Behnken响应面优化蛇葡萄素纳米结构脂质载体处方工艺及体外评价
2022-08-16麦琬婷钟华帅苏晓丹陆建媚覃裕翠黄秋洁
麦琬婷,钟华帅,苏晓丹,陆建媚,覃裕翠,黄秋洁,叶 勇, 3*
Box-Behnken响应面优化蛇葡萄素纳米结构脂质载体处方工艺及体外评价
麦琬婷1, 4,钟华帅1#,苏晓丹1,陆建媚1,覃裕翠1,黄秋洁2*,叶 勇1, 3*
1. 广西医科大学药学院,广西 南宁 530021 2. 广西中医药大学药学院,广西 南宁 530001 3. 广西生物活性分子研究与评价重点实验室,广西 南宁 530021 4. 贵港市人民医院,广西 贵港 537100
目的 优化蛇葡萄素纳米结构脂质载体(ampelopsin loaded nanostructured lipid carriers,AMP-NLC)处方并对其进行质量表征,研究其对SMMC-7721细胞抑制作用和摄取情况。采用有机溶剂蒸发法制备AMP-NLC,在单因素实验基础上结合Box-Behnken响应面优化AMP-NLC处方并对其进行质量表征。用MTT法测定SMMC-7721细胞的半数抑制浓度(inhibitory concentration of 50%,IC50),并用罗丹明B染料观察其摄取情况。最优处方为山嵛酸甘油酯与中链三酰甘油的比例为1∶11.5、药脂比为1∶10.5、蛋黄卵磷脂用量为21 mg和P188的用量为2%,所制AMP-NLC的平均包封率为(81.71±1.76)%、平均载药量为(3.86±0.22)%、平均粒径为(156.50±7.11)nm和平均ζ电位为(−11.00±0.95)mV,体外释药过程符合一级释放模型=47.93(1-e−0.625 2 t),蛇葡萄素和AMP-NLC对SMMC-7721细胞的IC50分别为44.51、41.51 μg/mL,且相对蛇葡萄素原料药,SMMC-7721细胞对AMP-NLC有较好摄取。Box-Behnken响应面法所建立的模型可用于AMP-NLC处方优化,AMP-NLC能有效提高蛇葡萄素在SMMC-7721细胞的相对摄取。
蛇葡萄素;Box-Behnken响应面优化;纳米结构脂质载体;质量评价;细胞摄取;体外靶向性
蛇葡萄素(ampelopsin),又名二氢杨梅素,是一种重要的黄酮类化合物,广泛存在于葡萄科、杨梅科、杜鹃科、藤黄科、大戟科及柳科等植物中,其中以葡萄科蛇葡萄属植物显齿蛇葡萄(Hand. -Mazz.) W. T. Wang中含量最为丰富,高达37.4%~38.5%[1-2]。在广西显齿蛇葡萄又称甜茶藤,壮药名为“茶完”,目前收载在《广西壮族自治区壮药质量标准》(第一卷)[3]。作为一种壮族民间保肝的特效药材,甜茶藤常用于治疗黄疸性肝炎和感冒风热等症。研究表明,蛇葡萄素具有显著的抗肝癌[4]、抗氧化[5]、抗菌[6]、抗炎[7-8]和骨重塑[9]等作用。但是,由于其水溶性低、黏膜渗透性差和体内稳定性不佳等原因,导致其体内的生物利用度很低[10-11],从而限制了其临床应用。因此,需借助现代制剂技术改善蛇葡萄素体内吸收及稳定性差的问题。文献报道的二氢杨梅素长循环纳米脂质体包封率只有约54%[12],且稳定性和缓释性不够理想。郜娜等[13]制备了二氢杨梅素磷脂复合物纳米结构脂质载体,需先制备磷脂复合物,工艺较为繁琐,且制备过程中使用的四氢呋喃、石油醚等具有一定毒性的溶剂,此外所得包封率不高(低于80%)。黄娟等[14]制备了二氢杨梅素固体自微乳,但处方中主要含有无机材料二氧化硅,其体内安全性问题尚需深入研究[15],因此,其应用具有一定局限性。
纳米结构脂质载体(nanostructured lipid carrier,NLC)是新一代脂质纳米粒,通过加入液态脂质,扰乱固体脂质规则的晶格结构,增加晶体的混乱度,为药物的包载创造了更大空间,可大幅提高药物的包封率及载药量[16-17]。此外,NLC还能进一步延缓药物释放、增加药物透膜性及提高药物稳定性,是一种理想的纳米药物靶向载体[18]。因此,本课题拟采用Box-Behnken响应面法对蛇葡萄素纳米结构脂质载体(ampelopsin loaded nanostructured lipid carriers,AMP-NLC)的处方进行优化,并研究其质量表征及体外细胞的摄取情况,以期为后续体内抗肝癌药效学、药动学等研究奠定基础,也为壮药甜茶藤中蛇葡萄素的新制剂研发提供科学依据。
1 仪器与材料
1.1 仪器
Agilent 1260型高效液相色谱仪,美国安捷伦科技有限公司;HH-2型数显电子恒温水浴锅,常州国华电器有限公司;SU8100型扫描电子显微镜(SEM)、H-7650型透射电子显微镜(TEM),日本Htachi公司;SmartLab-9kW型转靶X-射线粉末衍射仪(XRD),日本理学株式会社;Zetasizer Nano ZS型激光粒度仪,英国马尔文公司;XS205DU型分析天平,梅特勒托利多集团;DSC1型差式扫描量热仪(DSC),瑞士梅特勒托利多公司;Eppendorf5810R型冷冻离心机,赛默飞世尔科技公司;Nicolet is 20型傅里叶红外光谱仪(FT-IR),赛默飞世尔科技公司;Aynergy H1型酶标仪,美国伯腾仪器有限公司;德国徕卡DMi8型倒置荧光显微镜,德国徕卡公司。
1.2 试药与试剂
蛇葡萄素对照品,批号Q-006-181218,质量分数98.0%,成都瑞芬思生物科技有限公司;色谱纯乙腈,赛默飞世尔科技公司,批号F21LB8201;伯洛沙姆188(P188),德国BASF有限公司,批号GNC33221B;山嵛酸甘油酯,江西阿尔法高科药业有限公司,批号20201001;中链三酰甘油,Croda Singapore Pte Ltd.,批号627884;Lipoid E80SN,Lipoid GmbH,批号512100-2190153;DMEM培养基,Gibco公司,批号8121372;胎牛血清(fetal bovine serum,FBS),美国Gemini公司,批号A61H74L;青链霉素混合液(批号20210818)、磷酸盐缓冲液(PBS,批号20211124)、四甲基偶氮唑盐[3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT,批号715F0527]、Hoechst33342(批号1118IO35),索莱宝生物科技有限公司;DMSO,批号20200401,天津市大茂化学试剂厂;罗丹明B(rhodamine B,RhB),批号C10472170,默克试剂公司。
1.3 细胞
SMMC-7721细胞均购自上海细胞生物学研究所细胞库。
2 方法与结果
2.1 AMP-NLC的制备
精密称取处方量的山嵛酸甘油酯、中链三酰甘油、卵磷脂、蛇葡萄素和无水乙醇,置于20 mL烧杯中,作为油相;另取处方量的2% P188于20 mL烧杯中,作为水相。待油相完全溶解后,将油相加入到同温度的水相中,用恒温磁力搅拌器在65 ℃条件下搅拌60 min,使其充分乳化,过0.22 μm微孔滤膜,即得AMP-NLC,4 ℃保存。
同法制备不含蛇葡萄素的空白纳米结构脂质载体(blank loaded nanostructured lipid carriers,B-NLC)和含罗丹明B的纳米结构脂质载体(rhodamine loaded nanostructured lipid carriers,RhB-NLC)。
2.2 蛇葡萄素的测定
2.2.1 溶液的配制 精密称取蛇葡萄素对照品5 mg,置于25 mL量瓶中,加甲醇超声溶解并定容至刻度,摇匀,过0.22 μm微孔滤膜,即得200 μg/mL对照品储备液。
2.2.2 色谱条件 色谱柱为日本GL Sciences C18分析柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.2%磷酸三乙胺溶液(25∶75);体积流量1 mL/min;检测波长291 nm;柱温30 ℃,进样量20 μL,经考察辅料对检测无影响,结果见图1。
2.2.3 精密度考察
(1)日内精密度:取10、50、100 μg/mL蛇葡萄素对照品溶液,按“2.2.2”项色谱条件测定,1 d连续进样6次,记录峰面积,计算RSD。结果表明,低、中、高质量浓度蛇葡萄素对照品溶液的RSD分别为1.89%、1.55%、1.08%,表明日内精密度较好。
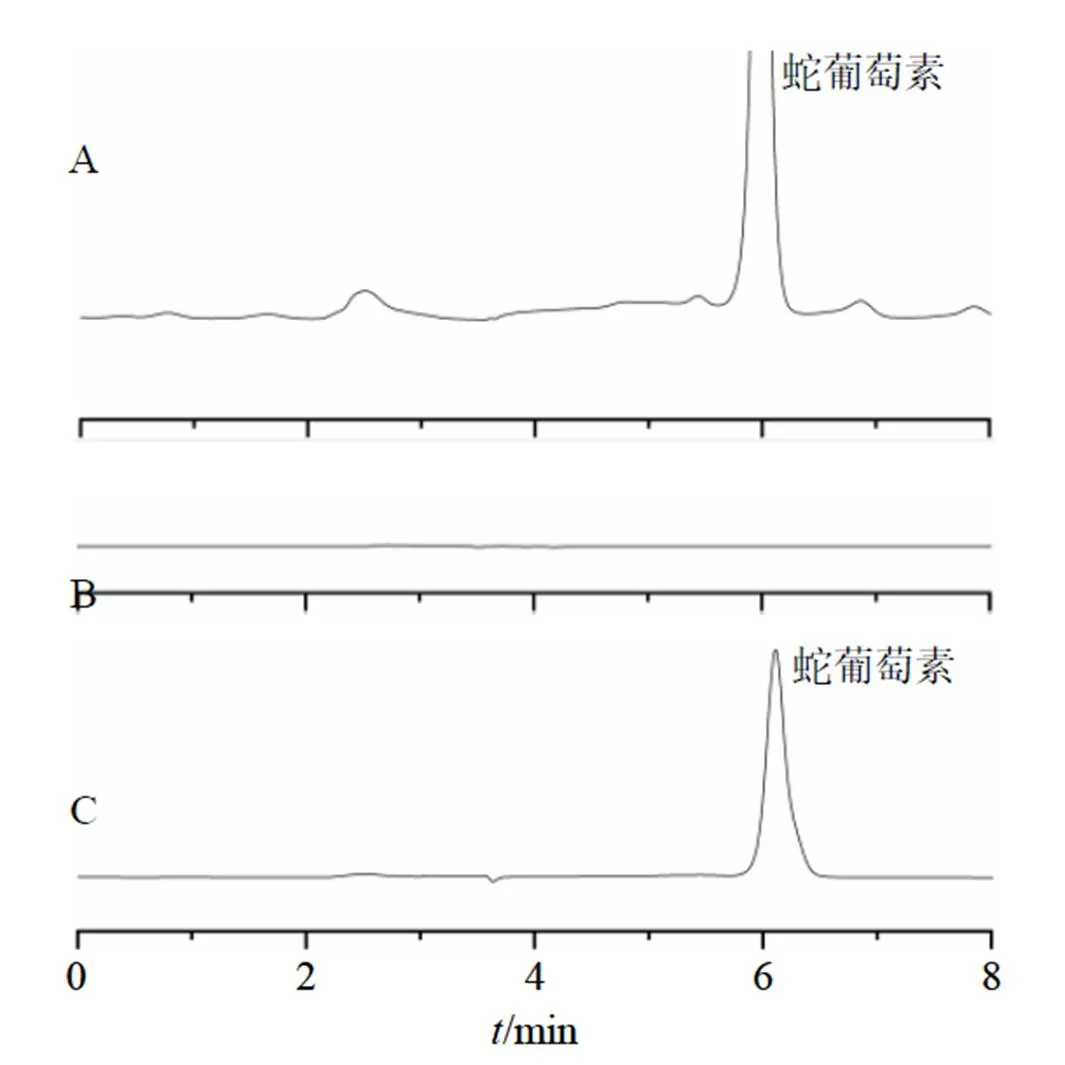
图1 蛇葡萄素对照品(A)、B-NLC样品 (B)和AMP-NLC样品 (C)的HPLC图
(2)日间精密度:取10、50、100 μg/mL蛇葡萄素对照品溶液,按“2.2.2”项色谱条件测定,连续进样6 d,记录峰面积,计算RSD。结果表明,低、中、高质量浓度蛇葡萄素对照品溶液的RSD分别为3.13%、3.59%、4.33%,表明日间精密度较好。
2.2.4 线性关系考察 取“2.2.1”项下200 μg/mL蛇葡萄素对照品溶液,分别配制成5、10、25、50、100、200 μg/mL的蛇葡萄素对照品溶液,按“2.2.2”项下色谱条件测定,记录峰面积,以峰面积为纵坐标(),以质量浓度为横坐标(),绘制标准曲线,进行线性回归,得蛇葡萄素线性回归方程=48.959-27.274,=0.999 8,表明蛇葡萄素在5~200 μg/mL线性关系良好。
2.2.5 准确度考察
(1)方法回收率:配制25、65、85 μg/mL的蛇葡萄素甲醇溶液,按“2.2.2”项下色谱条件测定,记录峰面积,将峰面积代入标准曲线方程换算得实际测定质量浓度,计算方法回收率。实验结果表明,方法回收率分别为108.92%、85.76%、108.86%,RSD为2.48%、2.48%、0.99%,均符合要求。
(2)加样回收率:按处方量的80%、100%、120%称取蛇葡萄素原料药适量,分别加入处方量的各个辅料,加入甲醇超声溶解并定容,摇匀,配成质量浓度分别为10、50、100 μg/mL,平行3次,共9份,按“2.2.2”项下色谱条件测定,记录峰面积,计算加样回收率。实验结果表明,加样回收率分别为99.01%、103.11%、105.63%,RSD为3.32%、1.19%、1.74%,均符合要求。
2.2.6 重复性试验 按“2.2.4”项方法平行制备6份蛇葡萄素对照品溶液,按“2.2.2”项下色谱条件测定,记录峰面积,计算蛇葡萄素质量分数的RSD。结果表明,RSD为2.77%,表明重复性好。
2.2.7 稳定性试验 将蛇葡萄素对照品溶液稀释至8、50、100 μg/mL,分别于0、2、4、6、8、10、12 h,按“2.2.2”项下色谱条件测定,记录峰面积,计算RSD,观察12 h内稳定情况,结果表明,RSD分别为4.43%、1.08%、1.19%,表明供试品溶液在12 h内稳定。
2.3 AMP-NLC包封率和载药量的测定
采用超滤离心法测定包封率和载药量,精密量取一定量的AMP-NLC加入6倍量的40%乙醇,置10 000截留相对分子质量的离心超滤管内管中,于10 000 r/min离心(离心半径7.5 cm)30 min,过0.22 μm微孔滤膜,按“2.2.2”项下色谱条件测定,记录峰面积,计算游离蛇葡萄素的含量。另取等量的AMP-NLC置于5 mL量瓶内,用甲醇定容至刻度,过0.22 μm微孔滤膜,按“2.2.2”项下色谱条件测定,记录峰面积,计算总蛇葡萄素的含量,按照公式(1)、(2)计算包封率和载药量。
包封率=(2-1)/2(1)
载药量=(2-1)/(2+3) (2)
1为游离药物的量,2为系统中药物的总量,3为系统中辅料的量
2.4 单因素实验
2.4.1 固态脂质种类的考察 改变固态脂质种类,其他条件不变,固态脂质种类分别为单硬脂酸甘油酯和山嵛酸甘油酯,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,使用单硬脂酸甘油酯和山嵛酸甘油酯的包封率分别为59.77%和84.34%,载药量分别为2.36%和2.38%,即选择嵛酸甘油酯做固态脂质。
2.4.2 液态脂质种类的考察 改变液态脂质种类,其他条件不变,液态脂质种类分别为中链三酰甘油、油酸和大豆油,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,使用中链三酰甘油,油酸和大豆油的包封率分别为76.90%、50.22%、56.06%,载药量分别为2.05%、0.19%、1.33%,即选择中链三酰甘油做液态脂质。
2.4.3 固态脂质与液态脂质质量比(固液脂质比)的考察 改变固液脂质比,其他条件不变,固定脂质材料总量,固液脂质比分别为1∶0.1、1∶2.3、1∶4.6、1∶6.9、1∶9.2、1∶11.5、1∶13.8、1∶16.1,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,包封率分别为68.19%、72.39%、70.40%、75.47%、84.45%、94.52%、93.00%、82.76%,载药量分别为0.94%、1.17%、1.46%、1.07%、1.44%、6.03%、5.83%、6.03%。不同固液脂质比1∶0.1~1∶16.1,包封率呈先增大后减小的趋势,而载药量呈逐渐增大的趋势,有可能是液态脂质较多时有利于蛇葡萄素的溶解在辅料中,使得载药量在6%左右。该因素影响显著,选择固液脂质比1∶0.1~1∶11.5做后续研究。
2.4.4 蛇葡萄素和总脂质比例(药脂比)的考察 改变脂药比,其他条件不变,固定脂质材料总量,药脂比分别为1∶2.5、1∶5.0、1∶7.5、1∶10.0、1∶12.5、1∶15.0,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,包封率分别为76.84%、90.12%、84.56%、97.33%、78.04%、73.97%,载药量分别为5.54%、4.54%、3.69%、3.10%、3.51%。蛇葡萄素投药量越高载药量越高,但过高的投药量,制备NLC后有大量蛇葡萄素析出,影响包封率和载药量。该因素影响显著,选择药脂比1∶2.5~1∶7.5做后续研究。
2.4.5 蛋黄卵磷脂用量的考察 改变蛋黄卵磷脂用量,其他条件不变,蛋黄卵磷脂用量分别为18、21、24、27、30 mg,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,包封率分别为79.03%、97.40%、89.03%、80.80%、79.60%,载药量分别为5.54%、4.54%、3.69%、3.10%、3.51%。随着卵磷脂的用量逐渐增大,包封率呈先增大后减小的趋势,载药呈减小趋势,根据相关文献报道和本实验研究发现磷脂在NLC中只是起到了助乳化剂的作用,因而其用量到达一定范围内合适即可。该因素影响显著,优先考虑高包封率,选择卵磷脂的用量21~30 mg做后续研究。
2.4.6 P188用量的考察 改变P188用量,其他条件不变,P188的用量分别为0.1%、0.6%、1.0%、2.0%,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,包封率分别为55.28%、81.41%、95.72%、96.92%,载药量分别为1.45%、3.45%、2.50%、2.44%。随着P188用量越多,包封率逐渐增大,但是在用于制备注射剂时,其用量不能太高,所以选择P188用量为2%。
2.4.7 有机相和水相体积比例的考察 改变有机相和水相比例其他条件不变,有机相和水相体积比分别为1∶1、1∶2、1∶3、1∶4,按“2.1”项下方法制备AMP-NLC,以包封率和载药量为指标进行考察。结果表明,包封率分别为79.71%、73.31%、91.50%、86.97%,载药量分别为1.14%、2.62%、2.70%、2.71%。选择相体积比为1∶3,其能充分溶解脂质相和药物,有利于NLC的制备。
2.5 基于Box-Behnken响应面优化
在单因素试验的基础上,选择对NLC包封率影响较大的因素作为实验因素,选择蛋黄卵磷脂用量(1)、药脂比(2)和固液脂质比(3)做响应面试验优化。采用3因素3水平的Box-Behnken响应面设计法进行优化,3因素3水平试验设计见表1。
表1 响应面实验设计与结果
Table 1 Design and results of response surface experimental
试验号X1/mgX2X3Y1/%Y2/%Y3/nmY4/mVOD值 125.5 (0)1∶7.5 (0)1∶5.8 (0)60.851.71344.0−10.070.64 225.5 (0)1∶7.5 (0)1∶5.8 (0)59.981.74332.6−4.840.75 325.5 (0)1∶2.5 (−1)1∶11.5 (+1)65.004.301 679.3−6.770.00 430 (+1)1∶12.5 (+1)1∶5.8 (0)89.201.54259.6−11.970.65 525.5 (0)1∶12.5 (+1)1∶11.5 (+1)57.112.00200.4−9.750.91 621 (−1)1∶12.5 (+1)1∶5.8 (0)59.531.22257.9−16.830.54 730 (+1)1∶2.5 (−1)1∶5.8 (0)50.933.401 355.7−13.230.46 821 (−1)1∶7.5 (0)1∶11.5 (+1)97.553.73286.0−6.930.98 925.5 (0)1∶2.5 (−1)1∶0.1 (−1)48.972.00331.7−7.920.75 1025.5 (0)1∶7.5 (0)1∶5.8 (0)80.992.24365.5−7.580.70 1125.5 (0)1∶7.5 (0)1∶5.8 (0)71.192.07136.1−8.580.83 1230 (+1)1∶7.5 (0)1∶11.5 (+1)64.144.50556.2−6.770.57 1325.5 (0)1∶7.5 (0)1∶5.8 (0)54.552.01169.4−9.680.84 1421 (−1)1∶2.5 (−1)1∶5.8 (0)81.771.00181.0−6.250.95 1530 (+1)1∶7.5 (0)1∶0.1 (−1)74.002.40135.7−7.620.83 1621 (−1)1∶7.5 (0)1∶0.1 (−1)55.481.51184.6−5.790.74 1725.5 (0)1∶12.5 (+1)1∶0.1 (−1)63.960.92107.8−8.590.00
2.5.1 总评归一法 若单以包封率(1)、载药量(2)、粒径(3)或ζ电位(4)为评定指标,每个指标优选的条件可能会相互矛盾,因此,实验中常引入归一化综合值(outside diameter,OD值),来考察指标的综合效果。根据Hassan方法[19]对各个指标进行归一化处理,对于欲达到最大化的指标,如包封率、载药量,计算方式为公式(3);对于欲达到最小化的指标,如粒径,计算方式为公式(4),OD值计算为公式(5)。由于各条件对PDI影响不显著,所以未选取其作为响应值,得到的数据和结果如表1所示。
dmax=(Y-min)/(max-min) (3)
dmin=(max-Y)/(max-min) (4)
OD=(d)1/n(5)
Y为实际测量值,max和min分别为各指标可接受的最大值和最小值
对于公式(3),当试验中某指标等于或超过max将设为1,反之小于min则设为0;对于公式(4),当试验中某指标等于或超过max将设为0,反之小于或等于min则设为1。
根据《中国药典》2020年版要求包封率作为微粒给药系统的主要指标其限度不低于80%,静脉用乳状液型注射液中90%的乳滴粒径应在1 μm以下,除另有规定外,不得有大于5 μm的乳滴,确定纳米粒最优处方粒径范围为250 nm以下,根据前期试验结果确定载药量范围为2%~10%。
2.5.2 2次回归模型的建立 采用Design-Expert V8.0.6软件对1、2、3、4和OD值与1、2和3进行多元2项式方程拟合。拟合方程2均大于0.8,表明模型拟合程度较好;方差分析结果见表2,模型<0.05,具有显著性差异,失拟项>0.05,表明失拟不显著。拟合方程分别为1=400.29-26.041-6.292+1.533+0.3412-0.05113-0.0123+0.4612-0.0522,2=0.814 5,=0.025 7;2=2.677 761-0.411 952-0.000 063-0.011 5612-0.000 0113-0.000 0523+0.013 9912-0.000 0422+0.000 0232,2=0.956 2,=0.000 6;3=−2 339.45+118.531+84.452+3.113-6.5212+0.3113+0.5523+2.6522+0.0132,2=0.893 0,=0.003 5;4=−8.15-0.471-1.622-0.0373+2.9612-0.5013-0.5823-1.2212-2.722+2.5932,2=0.850 6,=0.031 3;OD=5.924 31-0.364 971-0.057 692-0.000 563+0.000 3312-0.000 0513+0.000 0723+0.000 6312-0.000 2322-0.000 00332,2=0.959 4,=0.000 4。以OD值为评价指标对交互关系的响应面2D和3D效果图见图2。
表2 方差分析结果(OD值)
Table 2 ANOVA results (OD value)
误差来源自由度离均差平方和F值P值误差来源自由度离均差平方和F值P值 模型91.2518.370.000 4X1210.079.250.018 8 X110.068.250.023 9X2210.2330.410.000 9 X210.000.070.805 0X3210.056.080.043 0 X310.000.260.623 5残差70.053 X1X210.0911.830.010 8拟失项30.0220.920.508 3 X1X310.068.450.022 8纯误差40.031 X2X310.6991.65<0.000 1总误差161.30
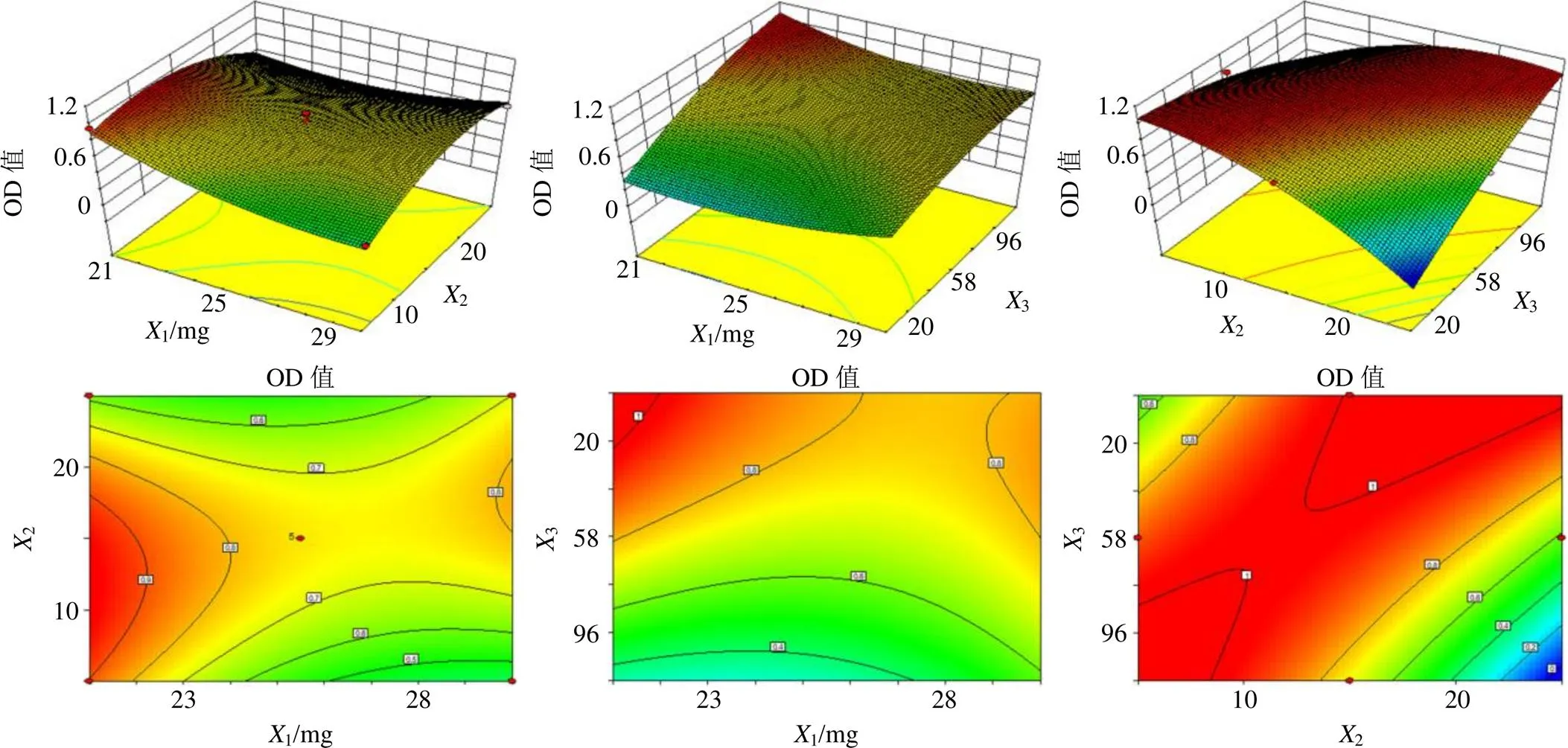
图2 因素间交互作用的响应面2D图和3D图(OD值)
2.5.3 最优处方的验证 根据软件预测结果,最终优化后处方为固液脂质比(山嵛酸甘油酯与中链三酰甘油的比例)为1∶11.5,药脂比为1∶10.5,蛋黄卵磷脂用量为21 mg,P188的用量为2%,计算软件预测值和实测值的相对偏差计算为公式(6),结果如表3。实验结果表明,除载药量和OD值外,包封率、粒径和ζ电位的偏差均在±10%左右,可能是在制备过程中,使用的磁力搅拌器虽然都调节到同一位置,但是其搅拌速度还是有一定偏差;此外,水浴锅70 ℃温度并不能保持恒定,温度有一定变化会影响AMP-NLC制备。
相对偏差=|预测值-实测值|/预测值 (6)
2.6 质量表征
2.6.1 粒径和ζ电位的测定 取AMP-NLC稀释至20倍,于马尔文粒度仪测定其粒径为(156.50±7.11)nm、ζ电位为(−11.00±0.95)mV,结果见图3-A、B。
2.6.2 DSC分析 取蛇葡萄素粉末、AMP-NLC和NLC冻干粉末进行DSC测定,DSC扫描条件为氮气,扫描温度30~300 ℃,升温速率10 ℃/min,气体体积流量50 mL/min,结果见图4。吸热谷是蛇葡萄素的熔化过程、而放热峰是蛇葡萄素的晶化过程,从这些热动力学中计算熔融焓(Δfusion)和结晶焓(Δcryst)。DSC热谱图中,蛇葡萄素的熔点为248.5 ℃(Δfusion=91.89 J/g),此外,DSC热谱图出现3个吸热峰和1个放热峰,和文献报道[20]比对,前2个吸热峰分别为93.17 ℃(Δfusion=80.38 J/g)和141.5 ℃(Δfusion=23.80 J/g),有可能是2次脱水导致。制备成NLC以后,蛇葡萄素的248.5 ℃尖锐峰消失,按照相关文献[21]推测有可能是药物被完全包裹在基质中呈无定型,且表面无药物粒子存在,表明蛇葡萄素包裹在NLC里。
2.6.3 XRD分析 取蛇葡萄素粉末、AMP-NLC和NLC冻干粉末进行XRD测定,测定条件:Cu Kα辐射(0.154 056 nm),扫描范围5°~45°,扫描速率5°/min,结果见图5。结果表明,蛇葡萄素自身有很多衍射峰,而制备成NLC后,只形成了2个独特的衍射峰,分别是23.16°和19.03°,其形成一定的结晶结构。这与DSC结果一致,说明蛇葡萄素大多是以无定型状态被包裹于制剂中。
表3 最优处方的验证
Table 3 Validation of optimal prescription
参数包封率/%载药量/%粒径/nmζ电位/mVOD值 实测值81.71±1.763.86±0.22156.50±7.11−11.00±0.950.88±0.03 预测值82.733.11174.99−10.511.08 相对偏差/%1.2324.2210.564.6618.51
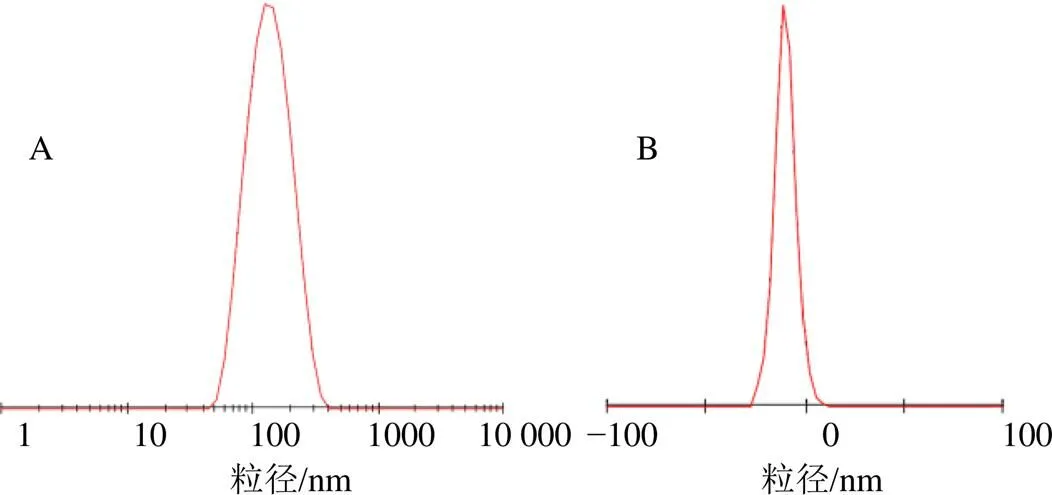
图3 AMP-NLC的粒径分布(A) 和ζ电位(B)
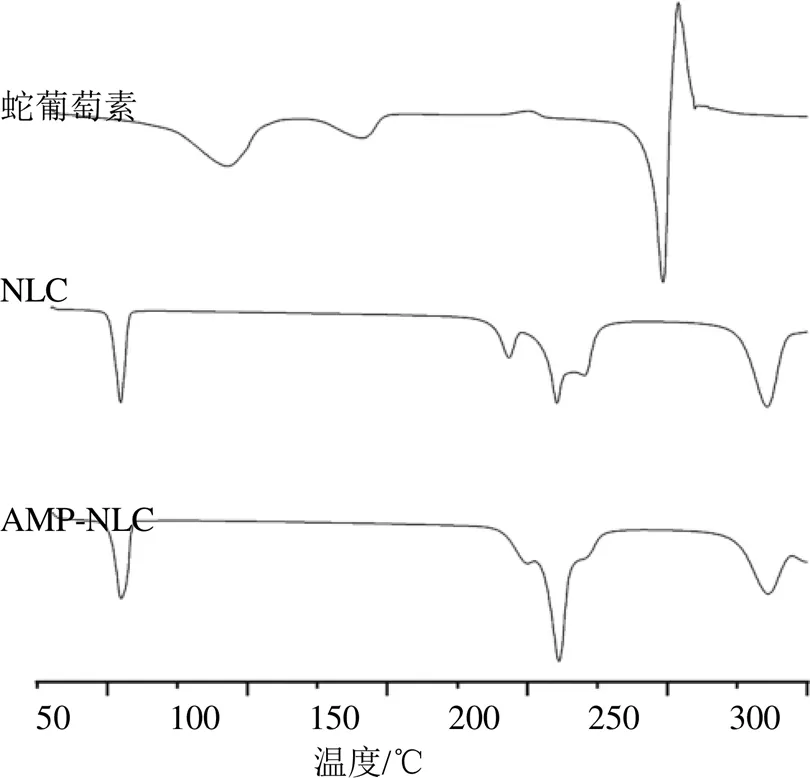
图4 AMP-NLC的DSC图
2.6.4 FT-IR的测定 取蛇葡萄素粉末、AMP- NLC、NLC冻干粉末、蛇葡萄素粉末与NLC冻干粉末的物理混合物适量分别与100 mg溴化钾基质混合研磨,10 MPa下压成薄片,置于红外光谱仪下扫描,结果见图6。结果表明,制备成AMP-NLC后蛇葡萄素的特征峰1640 cm−1(C=O)消失,表明成功将蛇葡萄素包裹在NLC中,形成AMP-NLC。
2.6.5 TEM和SEM形态观察 取新制备的AMP- NLC用水适当稀释,取少许滴至铺有碳膜的铜网上,用2%磷钨酸染色,晾干后,用TEM下观察并拍照,结果见图7-A。取一定量冻干AMP-NLC粉末于真空条件下喷金后置于SEM下观察,结果见图7-B。结果表明,制备成AMP-NLC成类球形,粒径在150 nm左右。
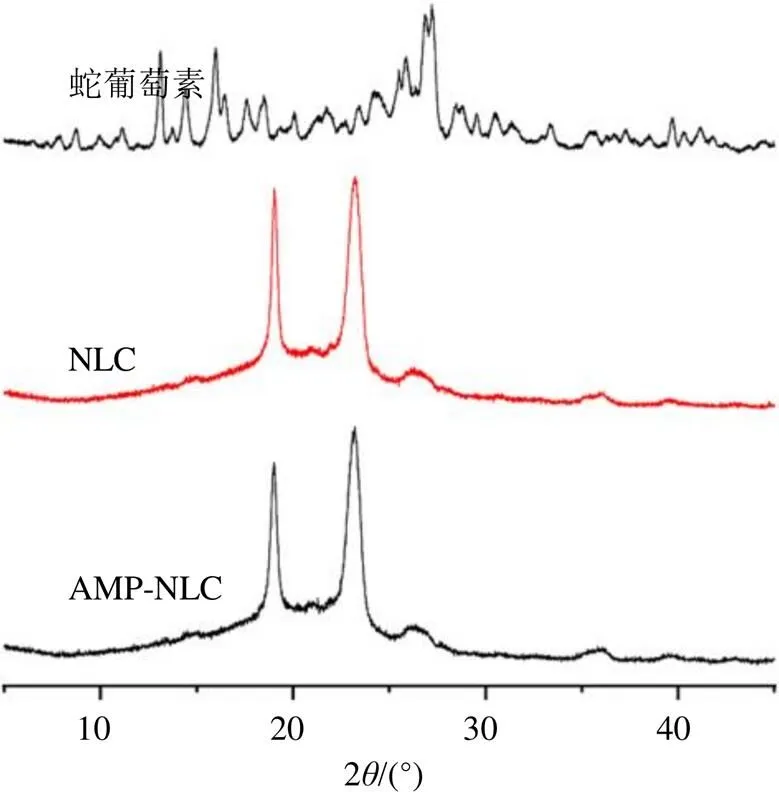
图5 AMP-NLC的XRD图
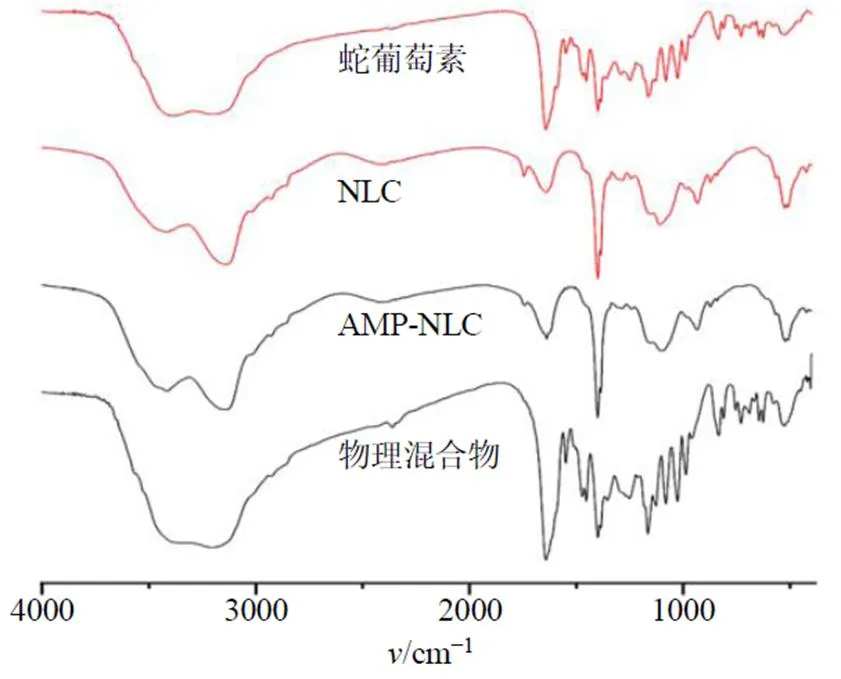
图6 AMP-NLC的FT-IR图
2.6.6 体外释药特性研究 取AMP-NLC 1 mL放入活化的透析袋(截留相对分子质量8×106~1×107)中,两端扎紧,置于10 mL的pH为5.0的PBS释放介质中,于(37.0±0.5)℃恒温振荡器中,分别在0.5、1.0、1.5、2.0、4.0、6.0、8.0、10.0、12.0、24.0、48.0、72.0 h取1 mL释放液,并补充等量等温的释放介质。取出的释放液补加0.5 mL甲醇混匀,再过0.22 μm滤膜,按“2.2.2”下方法测定,记录峰面积,计数累积释放率,绘制释放曲线见图8,并进行释药数学模型拟合,拟合结果见表4。结果表明,经制备成NLC,0.5 h内不存在突释,且在12 h内成缓释作用,12 h释放率达45%。此外,蛇葡萄素和AMP-NLC在一级和Riger-Peppas释放模型中拟合度均很高,2均达到0.80以上,经过制备成NLC,未改变其释放模式,但在体外释放呈缓慢释放,表明经制备成AMP-NLC,能起到缓释作用。板,2000个/孔,每孔100 μL,置于细胞培养箱37 ℃、5% CO2待贴壁。贴壁后,弃去旧培养基,加入用无血清培养基配制的质量浓度为10、20、40、80、100 μg/mL蛇葡萄素和AMP-NLC,每组设置3个复孔,置于细胞培养箱孵育24 h后,弃去药液,加入MTT工作液(5 mg/mL)100 μL,置于细胞培养箱孵育4 h,后加入100 μL DMSO,于490 nm处测定吸光度,计算其半数抑制浓度(inhibitory concentration of 50%,IC50)。结果表明,蛇葡萄素和AMP-NLC的IC50分别为44.51、41.51 μg/mL。

图7 AMP-NLC的TEM (A) 和SEM (B) 图
2.6.7 MTT试验 将SMMC-7721细胞接种于96孔
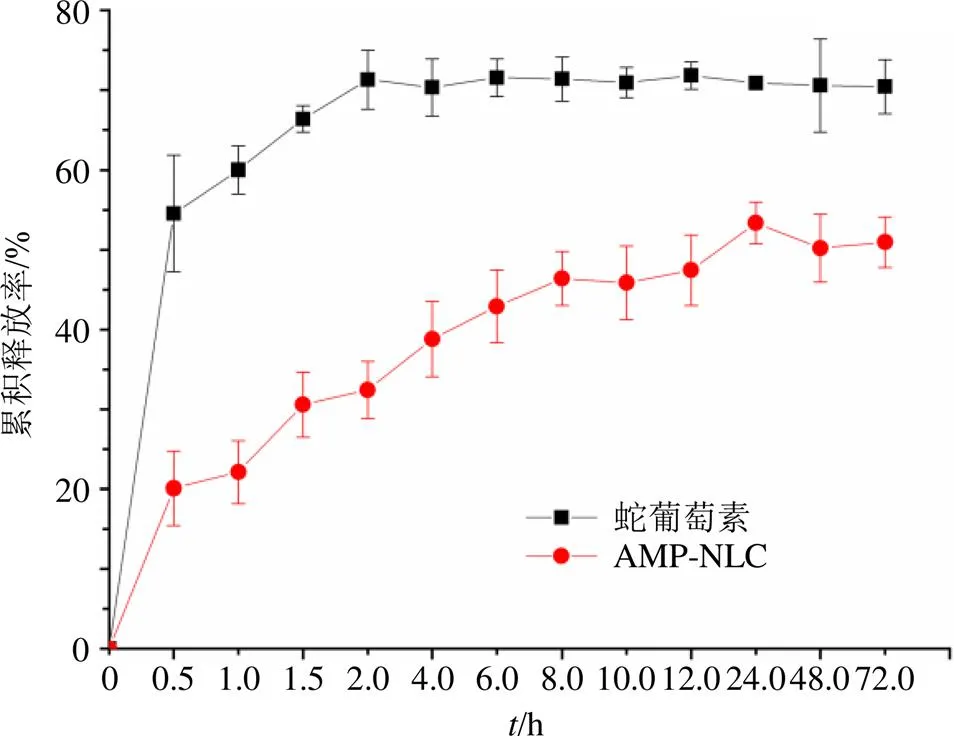
图8 蛇葡萄素和AMP-NLC体外释放曲线(, n = 3)
表4 蛇葡萄素和AMP-NLC的释药模型拟合方程
Table 4 Drug release model fitting equations of AMP and AMP-NLC
药物方程拟合方程 蛇葡萄素零级方程Q=1.582 3 t,R2=0.322 3 一级方程Q=70.51(1-e−2.59 t),R2=0.988 0 Riger-Peppas方程Q=64.00 t0.035 4,R2=0.959 8 AMP-NLC零级方程Q=1.10 t,R2=0.455 3 一级方程Q=47.93 (1-e−0.625 2 t),R2=0.948 2 Riger-Peppas方程Q=29.43 t0.157 3,R2=0.903 0
2.6.8 摄取情况考察 将SMMC-7721细胞接种于12孔板,10 000个/孔,每孔500 μL,以RhB作为对照,给药组为RhB-NLC置于细胞培养箱孵育12、24 h后,弃去药液,用预冷PBS洗2次,加入Hoechst33342染料染色30 min,再用预冷PBS洗2次,于倒置荧光显微镜下观察摄取情况(图9)。结果表明,RhB-NLC在SMMC-7721细胞中荧光强度高于RhB组,表明NLC对SMMC-7721细胞有一定被动摄取作用。
3 讨论
蛇葡萄素作为一种具有生物活性的重要天然黄酮类成分,近年来受到越来越多国内外学者的关注。然而,较低的水溶性和膜渗透性使其成药性不佳,很大程度上限制了蛇葡萄素口服制剂的研发。注射给药也因药物稳定性差而具有一定局限性。在本研究中,设计了一种新型纳米结构脂质载体来研究其在提高药物成药性能以及对体外细胞摄取的影响。
NLC能使难溶性药物的溶解度增加,且提高药物的包封率和载药量[22-23]。在初步试验中,选择了几种常用的液态脂质进行溶解度筛选。研究结果表明蛇葡萄素在中链三酰甘油中的溶解度最高,且制备的NLC包封率最高,而油酸对于属于酸性药物的蛇葡萄素来说,并不适合用其制备成NLC,文献报道碱性药物吴茱萸碱[24]使用油酸制备NLC的效果更为理想。因此,最终选择中链三酰甘油用于制备AMP-NLC。山嵛酸甘油酯比高熔点脂类单硬脂酸甘油酯具有更适合的亲水亲油平衡值(hydrophile lipophilic balance,HLB),使它更容易负载水微溶性的蛇葡萄素。山嵛酸甘油酯制备的AMP-NLC比其他固态脂质制备的NLC包封率更高且更稳定。NLC中液体脂质和固体脂质的组合比例至关重要,蛋黄卵磷脂可作为一种助溶剂,随着其用量越大,包封率逐渐降低,故选择最大为30 mg蛋黄卵磷脂进行优化。P188作为一种表面活性剂,用量越大,包封率和载药量也不断增加,但是用于iv时,其用量是有一定要求,故选择最大为2%进行优化。蛇葡萄素微溶于水,具有中等的油水分配系数,这些特性使得蛇葡萄素与常用液体油相的兼容性较差。在选择辅料的基础上,制备的AMP-NLC在一定程度上提高了蛇葡萄素的包封率和载药量。
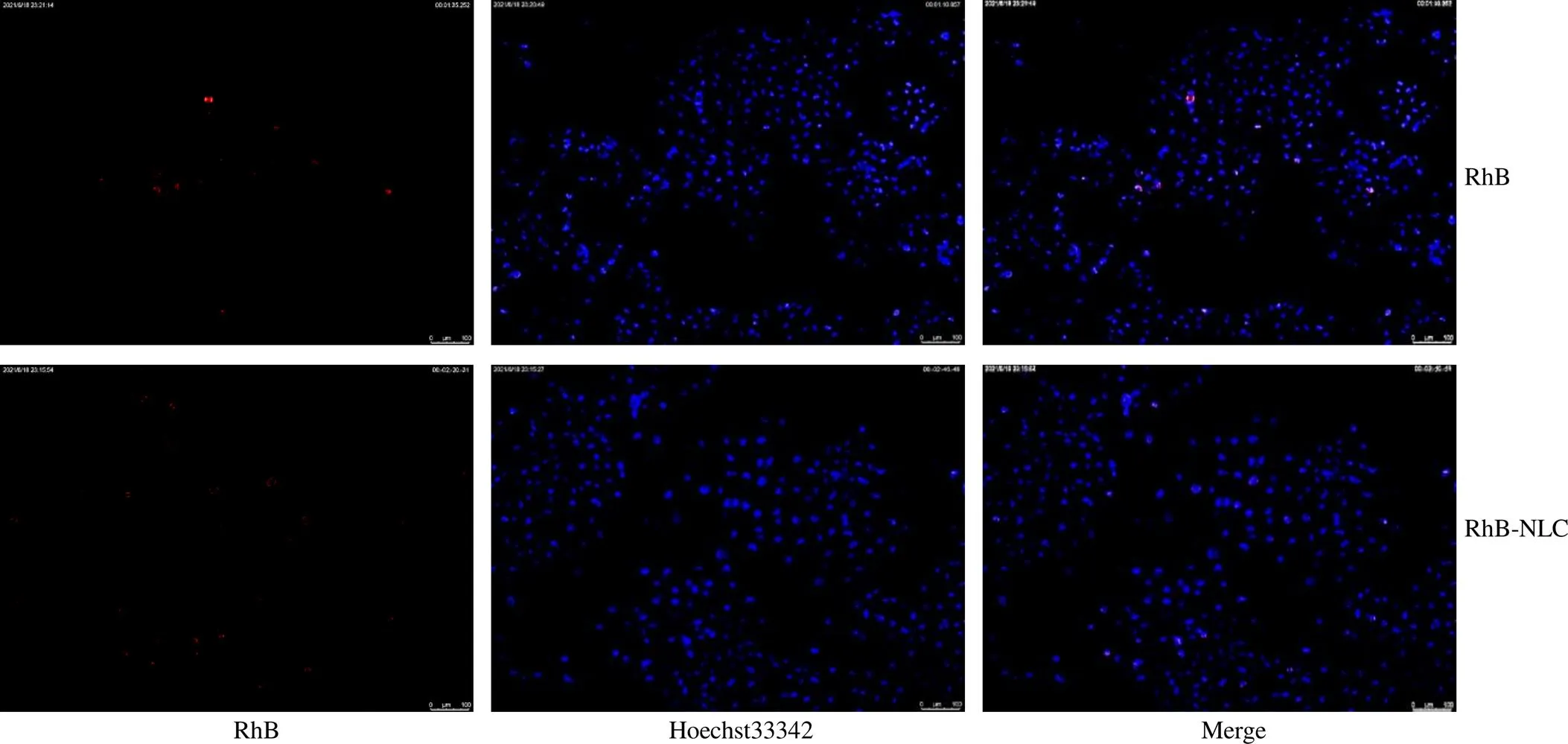
图9 SMMC-7721对RhB-NLC的摄取情况
NLC结构可分为3种:缺陷型、无定型和多层结构型。较高浓度的液态脂质会产生无定型结构,在这种结构中,α-型到β-型的结晶过程不会发生,从而防止药物在储存期间释放[25],从本实验结果推测,所制备的AMP-NLC应属于无定型。目前,尚未有蛇葡萄直接制备成NLC,但有郜娜等[13]研究先将其制备成磷脂复合物再制备成NLC,相对其制备步骤,本工艺更为简捷,且优化的AMP-NLC粒径更小,包封率更高(达到80%以上),因此推测该制剂可能更有利于iv给药。XRD表征表明,经过制备成AMP-NLC,蛇葡萄素自身的衍射信号消失,在19°和23°产生新的衍射峰,表明AMP-NLC经过冻干后形成了新的晶型。在TEM下可观察到AMP-NLC呈球形或类球形分布,粒径约为100 nm,且外层有一层脂质层包裹,有可能是中链三酰甘油、蛋黄卵磷脂和山嵛酸甘油酯形成一层脂质结构在外层。此外,AMP-NLC的Riger-Peppas释药模型拟合度较高,参考同为Riger-Peppas释放模型的温敏型纳米凝胶[26],蛇葡萄素可能被脂质包裹,药物可能经过这层脂质中释放,再经过外层中扩散渗透,则释放变得缓慢。
本研究采用单因素实验结合Box-Behnken响应面法优化处方工艺,成功地制备了AMP-NLC,对其进行包封率及载药量、粒径及Zeta电位、电镜形态、DSC、XRD、IR及体外释放度等质量表征,用MTT法研究了其对SMMC-7721细胞的抑制作用,与原料药相比,AMP-NLC对SMMC-7721细胞具有更高的抑制活性,并评估了SMMC-7721细胞摄取的能力。相对来说,本研究所设计制备的AMP-NLC具有显著的缓释效应和较高的稳定性,AMP-NLC制备工艺更为简单,包封率及载药量更高、粒径更小,从而利于体内注射给药。AMP-NLC显著改善了SMMC-7721细胞对蛇葡萄素的体外摄取,从而增强了对SMMC-7721的抑制作用。上述研究结果表明纳米结构脂质载体是一种适合蛇葡萄素注射给药的理想纳米递药载体,为AMP-NLC后续的体内药效学、靶向性及药动学等研究奠定基础,同时也为壮药甜茶藤中蛇葡萄素的新制剂研发提供了有益的探索。
利益冲突 所有作者均声明不存在利益冲突
[1] 清·刘善述. 赵素云等整理. 草木便方 [M]. 重庆: 重庆出版社, 1988: 181.
[2] 何桂霞, 裴刚, 周天达, 等. 显齿蛇葡萄中总黄酮和二氢杨梅素的含量测定 [J]. 中国中药杂志, 2000, 25(7): 423-425.
[3] 广西壮族自治区食品药品管理局. 广西壮族自治区壮药质量标准 [M]. 南宁: 广西科学技术出版社, 2011: 178.
[4] Sayed A M, Hassanein E H M, Salem S H,. Flavonoids-mediated SIRT1 signaling activation in hepatic disorders [J]., 2020, 259: 118173.
[5] 李雪晖. 二氢杨梅素抗氧化功能研究 [J]. 云南化工, 2018, 45(7): 64-65.
[6] 谢俊杰, 阮兆娟, 左国营. 蛇葡萄素与8种抗生素联用的体外抗铜绿假单胞菌作用研究 [J]. 中国药房, 2019, 30(1): 21-25.
[7] 胡琴. 二氢杨梅素通过Nrf2抑制NLRP3炎性体调控的血管内皮细胞焦亡的作用及机制研究 [D]. 重庆: 第三军医大学, 2017.
[8] 丰洁, 贺桂琼. 二氢杨梅素对APP/PS1转基因小鼠抗炎的作用及其机制初探 [J]. 免疫学杂志, 2017, 33(4): 301-305.
[9] Tong H H, Zhang X J, Tan L F,. Multitarget and promising role of dihydromyricetin in the treatment of metabolic diseases [J]., 2020, 870: 172888.
[10] Sun C C, Su H, Zheng G D,. Fabrication and characterization of dihydromyricetin encapsulated zein- caseinate nanoparticles and its bioavailability in rat [J]., 2020, 330: 127245.
[11] 吴晓珊, 倪峰, 高毓瀅, 等. 新型蛇葡萄素衍生物γ-聚谷氨酸蛇葡萄素酯的合成、表征及抗肿瘤作用评价 [J]. 中国药房, 2020, 31(22): 2720-2725.
[12] 张文娟, 陈一桢, 唐兰如, 等. 二氢杨梅素长循环纳米脂质体的制备及大鼠体内药动学研究 [J]. 中草药, 2018, 49(4): 806-813.
[13] 郜娜, 范明松, 杨庆宇, 等.二氢杨梅素磷脂复合物纳米结构脂质载体的制备、表征及药动学研究 [J]. 中草药, 2019, 50(17): 4060-4067.
[14] 黄娟, 岳晶晶, 冯璇, 等. 二氢杨梅素固体自微乳的制备及表征[J/OL]. 食品科学, [2022-03-28]. http://kns.cnki.net/kcms/detail/11.2206.TS.20211220.1742. 038.html.
[15] Castillo R R, Vallet-Regí M. Functional mesoporous silica nanocomposites: Biomedical applications and biosafety [J]., 2019, doi: 10.3390/ijms 20040929.
[16] Jansook P, Fülöp Z, Ritthidej G C. Amphotericin B loaded solid lipid nanoparticles (SLNs) and nanostructured lipid carrier (NLCs): Physicochemical and solid-solution state characterizations [J]., 2019, 45(4): 560-567.
[17] Gomaa E, Fathi H A, Eissa N G,. Methods for preparation of nanostructured lipid carriers [J]., 2022, 199: 3-8.
[18] Anantaworasakul P, Chaiyana W, Michniak-Kohn B B,. Enhanced transdermal delivery of concentrated capsaicin from chili extract-loaded lipid nanoparticles with reduced skin irritation [J]., 2020, 12(5): 463.
[19] Hassan E, Parish R, Gallo J. Optimized formulation of magnetic chitosan microspheres containing the anticancer agent, oxantrazole [J]., 1992, 9(3): 390-397.
[20] Wang C G, Xiong W, Reddy Perumalla S,. Solid- state characterization of optically pure (+)dihydromyricetinextracted fromleaves [J]., 2016, 511(1): 245-252.
[21] Chaudhari V S, Murty U S, Banerjee S. Nanostructured lipid carriers as a strategy for encapsulation of active plant constituents: Formulation andphysicochemical characterizations [J]., 2021, 235: 105037.
[22] 管庆霞, 张伟兵, 张喜武, 等. 马钱子碱纳米结构脂质载体处方与制备工艺的优化 [J]. 中草药, 2018, 49(11): 2557-2563.
[23] 王小霞, 张智强. 鞣花酸纳米结构脂质载体处方优化和口服生物利用度研究 [J]. 中草药, 2021, 52(13): 3862-3871.
[24] 董丹丹, 焦红军, 郝海军, 等. 吴茱萸碱纳米结构脂质载体处方优化和SD大鼠体内口服药动学研究 [J]. 中草药, 2022, 53(1): 60-70.
[25] Fonseca-Santos B, Silva P B, Rigon R B,. Formulating SLN and NLC as innovative drug delivery systems for non-invasive routes of drug administration [J]., 2020, 27(22): 3623-3656.
[26] 莫镇杰. 环境响应型纳米滴眼液的制备与评价 [D].广州: 广东药科大学, 2019.
Formulation optimization of ampelopsin nanostructured lipid carriers by Box-Behnken response surface method andevaluation
MAI Wan-ting1, 4, ZHONG Hua-shuai1, SU Xiao-dan1, LU Jian-mei1, QIN Yu-cui1, HUANG Qiu-jie2, YE Yong1, 3
1.Pharmaceutical College, Guangxi Medical University, Nanning 530021, China 2. Pharmaceutical College, Guangxi University of Chinese medicine, Nanning 530001, China 3. Guangxi Key Laboratory of Bioactive Molecules Research and Evaluation, Nanning 530021, China 4. Guigang City People’s Hospital, Guigang 537100, China
To optimize the formulation of ampelopsin nanostructured lipid carriers (AMP-NLC) and to characterize its quality, and to study its inhibitory effect on SMMC-7721 cells and its uptake.AMP-NLC was prepared by organic solvent evaporation, and based on the single factor test combined with Box-Behnken response surface, the AMP-NLC prescription was optimized and its quality was characterized. The IC50of SMMC-7721 was measured by MTT method, and the uptake of SMMC-7721 cells was observed by rhodamine B dye.The optimal formula was that the ratio of glyceryl behenate to medium chain triglyceride was 1:11.5, the ratio of drug to lipid was 1:10.5, the dosage of egg yolk lecithin was 21 mg and the dosage of P188 was 2%, respectively. The average encapsulation efficiency of AMP-NLC was (81.71 ± 1.76)%, the average drug loading was (3.86 ± 0.22)%, the average particle size was (156.50 ± 7.11) nm and the zeta potential was (−11.00 ± 0.95) mV. Thedrug release process conformed to the primary release model= 47.93(1-e−0.625 2 t). The IC50of ampelopsin and AMP-NLC for SMMC-7721 cells were 44.51 and 41.51 μg/mL, and compared with ampelopsin, SMMC-7721 cells had a better uptake to AMP-NLC.The model established by Box-Behnken design-response surface could be employed to optimize the formulation of AMP-NLC, and AMP-NLC could effectively improve the relative uptake of ampelopsin in SMMC-7721 cells.
ampelopsin; Box-Behnken response surface optimization; nanostructured lipid carriers; quality evaluation; cellular uptake;targeting
R283.6
A
0253 - 2670(2022)16 - 4982 - 10
10.7501/j.issn.0253-2670.2022.16.007
2022-02-16
国家自然科学基金资助项目(81960756);广西自然科学基金资助项目(2022GXNSFDA035063);广西自然科学基金资助项目(2018GXNSFAA050078);广西高校中青年教师科研基础能力提升基金资助项目(2019KY0148);广西高校中青年教师科研基础能力提升基金资助项目(2019KY0315)
麦琬婷(1995—),女,硕士研究生,研究方向为中药新剂型与新技术。E-mail: 347800540@qq.com
黄秋洁(1979—),女,副教授,主要从事中药新剂型与新技术研究。E-mail: hqj8@163.com
叶 勇(1979—),男,博士,副教授,主要从事民族药药效物质及其新制剂研究。E-mail: yong-ye@163.com
#共同第一作者:钟华帅(1997—),男,硕士研究生,研究方向为中药新剂型与新技术。E-mail: 2143327747@qq.com
[责任编辑 郑礼胜]
