口蹄疫病毒持续感染的研究进展
2022-08-15曾一歌
沈 超, 曾一歌
(武汉大学生命科学学院, 武汉 430072)
口蹄疫病毒(foot-and-mouth disease virus,FMDV)属于小RNA病毒科口疮病毒属,有7种血清型,其基因编码4种结构蛋白和10种非结构蛋白.口蹄疫(foot-and-mouth disease,FMD)由FMDV引起,是一种高度接触性、热性、急性的传染病.虽然它的致死率低,但会导致动物的体重下降进而生产力降低.并且由于FMDV毒株多样,蔓延极快,传播途径极广,对畜牧业乃至国家整体经济的危害极大,所以口蹄疫被世界动物卫生组织列为动物必报疫病之首.
在1959年,Bekkum等[1]发现在临床表现正常的牛咽部软腭可以不定期检测出FMDV的存在,首次提出了持续感染的概念.FMDV病毒通过呼吸道进入宿主体内,会形成急性感染.它首先感染咽喉处上皮,而后通过血液扩散到全身.动物开始发热,口鼻、乳头、脚趾间及无毛覆盖的皮肤出现水疱[2].急性感染一般持续一周左右,期间动物饱受发烧和水疱糜烂的折磨.无论是自然感染还是接种过疫苗的动物,有一定比例的个体在急性感染痊愈后会发展为口蹄疫病毒携带者,在康复后的很长时间内虽然不会发病,但取其咽部和软腭处液体都能检测到活病毒.无论动物接种疫苗与否,它们都可能在经历急性感染后保持持续感染的状态[3].
流行病学研究表明,易感染动物与携带病原体的动物接触是传染性疾病爆发之根源.FMDV在动物体内形成持续感染后,动物会成为临床表现不明显的病毒携带者,难以发现从而容易将病毒传播给其他个体.所以FMDV的持续感染是FMDV研究和防控的关键性问题,解决这一问题定能让我国对口蹄疫有更好的防控,为畜牧业贸易排忧解难.
1 FMDV持续感染类型概述
在病毒感染机体后,机体受感染细胞长期或终身带毒,而且机体经常或反复间断向外界排出病毒的状态叫做持续感染.病毒的持续感染大致可以分为3种类型:潜伏性感染、慢性感染、慢发性感染.潜伏性感染是指在临床急性感染痊愈后,宿主体内的病毒与免疫力处于相对平衡状态,病毒可以在体内实现长时间潜伏,一般不引起症状.但当宿主免疫力下降时,这种平衡被打破,病毒大规模增殖引发感染.比如水痘-带状疱疹病毒、单纯疱疹病毒和EB病毒引发的潜伏性感染.慢性感染是指机体在显性或隐性感染后,病毒在血液或组织中一直存在,并不断被排出体外或者经输血,注射而传播给其他个体.病程常达数月至数十年,患病个体的临床症状表现轻微.例如HBV、EB病毒、巨细胞病毒引发的感染.慢发性感染,也称慢病毒感染,潜伏期长达数月,数年甚至数十年.此类感染造成慢性持续性病变,最终常为致死性感染.如艾滋病和由缺损性麻疹病毒所致的亚急性硬化性全脑炎(SSPE).
FMDV属于三种类型中的慢性感染.FMDV的持续感染与其他病毒的不同主要体现在两个方面.一方面,FMDV病毒在体内的存在位置比较稳定,病毒在动物体内虽然被扩散到了全身,但咽部和软腭的病毒浓度一直处于全身的最高水平;另一方面,虽然病毒在被感染的动物体内持续存在,并可以随体液持续排出.但在一般情况下,动物很少因为体内FMDV的持续存在而在急性感染痊愈后复发口蹄疫或在长时间无临床症状之后病症加重.
在构成持续感染的机制方面,不同持续感染类型的病毒采取的“策略”有一定共性,也有各自的特性.构成持续感染的机制大致可以归纳为以下几种:病毒基因表达水平的改变;病毒基因的整合作用;病原体隐匿在免于免疫攻击的部位;机体的免疫系统异常;宿主细胞与病原微生物基因的变异;出现缺损干扰病毒颗粒.FMDV病毒持续感染形成的机制是让病毒与宿主细胞共选择、共进化.这种方式是上述几种机制的融合,包括双方基因的变异与病原体导致的宿主免疫系统功能异常等.至今,对于口蹄疫病毒持续感染的形成机制学术界仍无定论.
无论是在动物疾病还是人类疾病中,防治持续感染都是传染病研究中的重点和难点.一是对于受感染的机体本身来说,持续感染反复发作,难以治愈,甚至可能导致严重疾病(如自身免疫病和肿瘤),再是对于所有易感群体来说,持续感染的机体可以经常向外界排出病毒,对所有易感者造成了很大的威胁,对公共卫生有很大的危害.另外,持续感染患者需要长期使用药物治疗,日积月累下病原体对抗生素及药物的耐药性会不断增加.所以,研究FMDV的持续感染不仅对于防控口蹄疫本身有巨大的实用意义,更能让人们对所有持续感染病毒都有更深刻的认识.
2 持续感染期间FMDV在机体内存在的位置
在1966年,Burrows等[4]想要确定病毒在被感染的动物身上存在的具体位置,分别从初次感染的牛和接种疫苗后才被感染的牛身上的不同位置取样:咽、食道部分泌物(oesophageal-pharyngeal fluid, OPF)和从舌、咽、鼻甲、软腭、气管、扁桃体、食道的腺部和膀胱刮取的组织样本.定期从动物体内取样处理观察后发现,在100 d内:1) 不能在从膀胱和鼻甲取得的样本中分离出病毒;2) 在从气管、扁桃体和舌头取得的样本中可以成功分离出一次或两次病毒;3) 在其他的部位取得的样本中能够持续且稳定地分离出病毒,尤其是从咽部和软腭获得的样品,从中提取出的病毒最多.因此,FMDV持续感染时病毒存在的最佳的部位是咽部和软腭.
一般来说,咽部是病毒入侵动物体内的第一个“站点”,病毒在此复制后再进入血液扩散到全身.而后一直到动物康复后的初期阶段,在动物的许多器官和组织内都能分离出具有感染性的病毒.其中,在咽、软腭和扁桃体这些部位常常可以提取出大量病毒,且病毒的浓度较高;反而在鼻子、肺、支气管淋巴结这些部位很少得到病毒.在逆转录PCR技术问世之后,Murphy等[5]通过在器官与组织的样本中检测FMDV基因组的量验证了Burrows的发现.最近,Stenfeldt等[6]通过免疫显微镜对早期和持续性阶段的组织样本进行分析,证实了原发性和持续性FMDV感染均位于覆盖粘膜相关淋巴样组织(MALT)的鼻咽粘膜上皮的特殊区域.随着诊断与检测手段的不断创新,人们对病毒持续感染的在机体内存在的位置进行了进一步探索,在偶蹄动物的尾部也发现了病毒的存在[7-8].
3 FMDV持续感染的特性
与最初感染动物的大部分原始病毒相比,持续感染的FMDV病毒具有复制能力下降、形成空斑的能力改变、抗逆性下降的特性.Straver等[9-10]证明在持续感染过程中病毒形成的噬斑具有逐渐减小的表型,与初入宿主体内相比,这些病毒的滴度明显下降,且抗逆性降低(如对强烈理化性质、UV或热较不耐受).有证据表明,感染宿主的亲本病毒群体中存在具有后期持续感染病毒特性的个体,这说明宿主体内的细胞环境对病毒的选择可能是持续感染形成的机制之一.
FMDV持续感染病毒和亲代病毒在基因组与抗原方面的差异不大.Biswal等[11]在印度的一个奶牛场暴发FMD后的13个月内,连续从持续感染的水牛中采样并分离出O/ME-SA/Ind2001d血清型的FMDV,发现不同时期的FMDV P1衣壳编码区的核苷酸差异在0.1%~1.3%之间,且其中大部分为同义突变.一定程度上说明持续感染水牛体内的病毒与初感染的水牛的病毒基因非常接近,不足以形成基因突变带来的表型差异.同时,持续感染病毒在病毒抗原方面也呈现出变化程度很小的趋势.Salt等[12]在单克隆抗体的酶联免疫吸附剂测定实验中发现,在感染的不同时期测试病毒血清的中和活性可以发现其活性并没有发生很大的变化.然而,在后续的研究中有实验对VP1的核苷酸序列进行分析,结果显示病毒基因组的每个核苷酸每年有小至0.9×10-2,大到7.4×10-2的替代突变概率,这可能导致抗原变异[13-14],说明选择作用会使持续感染病毒的遗传物质和抗原发生一定变化.
Domingo等[15-17]提出了准物种的概念,即FMDV急性感染和持续感染的病毒种群在许多方面有所不同.但无论是初始的病毒种群还是持续感染后在体内所形成的病毒种群,它们都是由不同种类的病毒突变体混合而成,突变体之间存在一定的竞争关系[18-19].但最后存活下来的优势种群也可能并不存在于初始的群体中.在持续感染的过程中,由于宿主体内环境对病毒的影响,如病毒需要在特定细胞中进行增殖,躲避免疫系统的攻击等,病毒也可能产生新的突变体,但其具体机制有待进一步阐明.
4 FMDV持续感染的形成机制
FMDV持续感染的形成主要与病毒自身机制、宿主细胞机制与宿主免疫机制3个方面有着密切关联,后文中将详述此3种机制.除此之外,FMDV持续感染的形成也与FMDV灭活疫苗的使用和FMDV的多宿主性有一定的关系.早期FMDV疫苗比如福尔马林灭活疫苗中存在灭活不完全的病毒.这种疫苗虽然有一定的防疫贡献[20],但也与FMD的再次发生有一定的直接关系.现在更主流的控制口蹄疫的方式是清场和扑杀患病动物.在FMDV的多宿主性方面,Hughes等[21]曾经指出感染FMDV的绵羊和山羊的临床表现不明显,在国际贸易中很容易导致FMDV传到非疫区;甚至不同血清型的FMDV可以同时感染一个宿主.多宿主性导致的混合感染对于FMDV在全球范围内建立起持续感染有很大的帮助.
4.1 FMDV持续感染的研究模型
在体外细胞培养过程中,FMDV可导致培养的细胞发生细胞病变效应(cytopathic effect,CPE),但很多情况下,它也可以在细胞内建立长期的持续感染[22].de la Torre等在1985年建立了FMDV持续感染细胞系C1-BHK-Rc1和C1-IBRS-Rc1.他们用纯化后的FMDV C-S8c1病毒分别感染BHK-21和IBRS-2细胞,对存活下来的带毒细胞进行克隆与分析,得到了6种以上生长状态、细胞形态及病毒抗性方面有不同表型的细胞.
多年来本实验室相关课题组也构建了许多有效的FMDV持续感染模型.早年间用FMDV OBGF15感染叙利亚仓鼠肾细胞系(BHK-21),传代并筛选后得到了O-BHK-RN细胞株.Huang等[23]又开创性地用NH4Cl弱碱法处理感染FMDV的BHK-21,结合单克隆选择,获得了一株O型FMDV持续感染阳性克隆细胞系.用基因芯片分别分析与对比FMDV急性和持续感染细胞的基因表达图谱后发现两者存在较大的差异.分析其原因可能是宿主细胞为了适应病毒的存在而进化出了针对特定基因的调节机制[24].最终通过单细胞分析的方式(如图1所示)发现,细胞中EBP基因转录组的数量决定了细胞异质性的程度,与持续感染状态的保持有很大的关系[25].
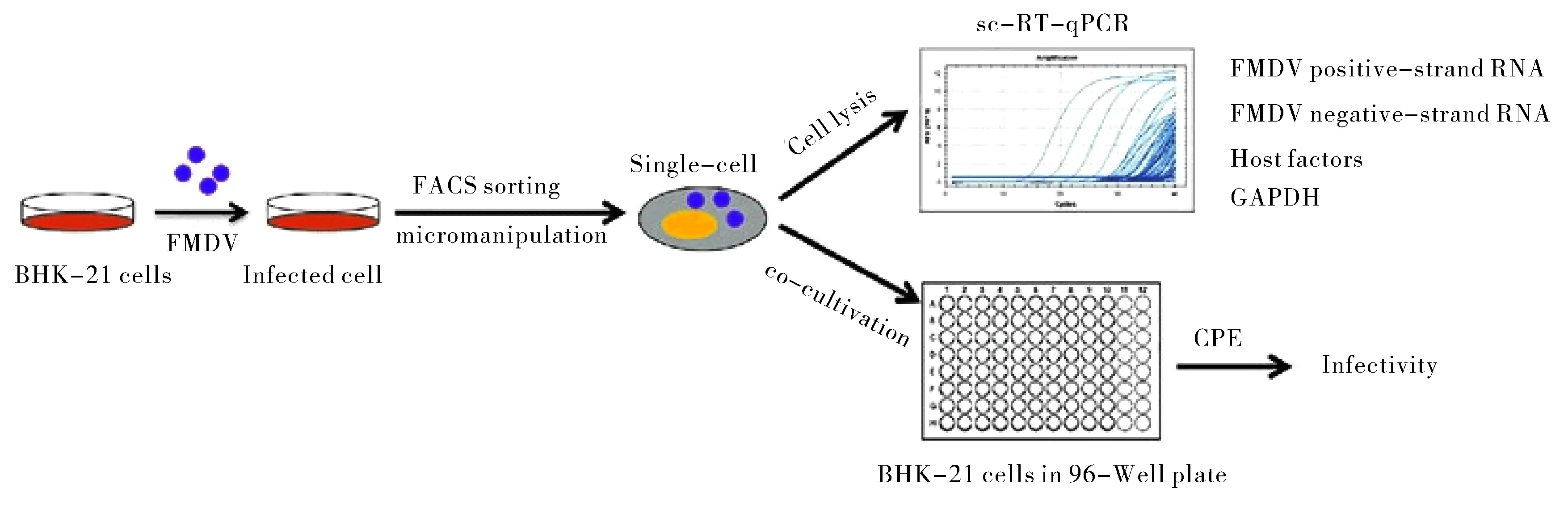
图1 口蹄疫研究中单细胞分离和测定的原理图[51]
近十年也有许多理想的持续感染细胞系模型诞生,这些模型不仅能在保持较低异质性的同时尽量贴近宿主体内的生活状态,也能在带毒量高的同时保持较长时间的存活力和代谢功能.如O’Donnell等[26]在2014年从牛咽部的部分细胞组织分离出的O型FMDV感染细胞系,此细胞系能较大程度还原宿主体内细胞与病毒的生存状态;Kopliku等[27]在2015年建立的O型FMDV感染牛肾细胞(MDBK)的持续感染细胞系,此细胞系带毒传代的稳定性较好.支持FMDV体外感染和复制的细胞模型,是研究病毒与宿主之间的相互作用、解释体内病毒的持续感染分子机制的重要工具,并在治疗新靶点的发现和候选药物功效评估等研究工作中发挥关键作用.
4.2 FMDV持续感染中病毒的变化
de la Torre等[21]在持续感染细胞系C1-BHK-Rc1传代过程中发现感染性FMDV颗粒减少,细胞能保持对口蹄疫病毒的特异性免疫,且体内的病毒抗原和病毒基因组明显减少.且有研究表明这些病毒的性状都发生了很大程度的变化,如噬斑形成能力下降,病毒的抗逆性和稳定性差.前文提到过, FMDV在传代过程中基因组几乎不发生变化[28-29].但对进入宿主体内的FMDV进行序列分析,结果表明病毒一级和二级复制位点之间的FMDV准物种组成存在显着差异[5].这样的改变与差异会导致病毒蛋白合成的异常,例如,在口蹄疫病毒VP3蛋白中,缬氨酸取代了半胱氨酸使得二硫键的形成受阻;病毒蛋白VP1中发生的氨基酸取代致使病毒抗原性也发生变化[28].
但有实验证明从传代培养细胞中分离出的口蹄疫病毒在感染新的细胞时扩增一代所需的时间甚至比初代更短;当用相同剂量的这些病毒和亲本病毒同时感染C1-BHK-Rc1细胞系时,后一组细胞的存活情况远远好于前一组.这说明病毒蛋白发生单个氨基酸替换这一程度的变化并不会使病毒本身毒力减弱,甚至能使病毒毒力增强.病毒毒力不减反增的原因可能与部分RNA的翻译活性增强有关.用FMDV感染BHK-21细胞系,细胞传到第100代时回收细胞培养物中的病毒,发现在回收的病毒基因组的内部核糖体进入位点处有两个错义突变,第376位的核苷酸替换导致了病毒 IRES的活性增强[30].
上文提到过Kopliku等[27]建立的O型FMDV感染MDBK细胞的持续感染细胞系,他们在这株细胞系中分离出第23代FMDV(FMDV Op23),并对其结构蛋白VP1进行测序,此蛋白对病毒附着和进入、免疫逃逸以及血清型特异性有重要意义.发现此蛋白与早期病毒相比,其基因组第3 415位的核苷酸发生了从T到C的替换,这导致了VP1蛋白中第 50 位的氨基酸缬氨酸被丙氨酸残基取代,这破坏了类泛素蛋白修饰分子SUMO1(small ubiquitin-like modifier,SUMO)的结合位点,一定程度上有利于病毒在细胞内生存以及免疫逃逸[27].
4.3 FMDV持续感染中宿主细胞的变化
被口蹄疫感染后的宿主细胞的性状与形态会发生一定的变化.以BHK-21细胞为例:显微观察到细胞由梭形变成圆形,且细胞贴壁与生长的速度均有所提升,甚至对病毒的抗性也会增加[31-34].进一步实验发现,当不用病毒感染细胞,仅用核苷类似物处理携带者的细胞时也可以得到具有相同特征的细胞[34-36].
de la Torre等对第一个FMDV持续感染细胞系的研究展现了进化的异质病毒群体和高度异质性的细胞之间的动态相互作用,验证了病毒和细胞之间长期的相互应答和相互选择.细胞的多样性也是病毒在细胞内实现持续感染的重要原因之一.和病毒遗传异质性一样,病毒和细胞长期存活也依赖于细胞的多样性.O’ Donnell等所分离出的O型FMDV感染细胞系得到的结果也能佐证病毒-宿主共适应的理论[26].
Hernandez等[33]用能裂解细胞的烈性FMDV感染已经感染过FMDV并治愈的BHK-21单层细胞,发现细胞存活力增加但FMDV对原始BHK-21细胞未表现出减毒,证明了细胞的遗传物质发生变化才是FMDV能够建立持续感染的真正原因.遗传物质的变化让细胞对于FMDV的抗性增加了,而并不是病毒本身独立致使的变化[33].
用功能性基因组学的方法对比持续感染细胞系与急性感染的细胞,发现持续感染细胞系一共有十二种不同的细胞基因表达模式,这说明宿主细胞在对抗FMDV感染的过程种发生了转录组水平的变化[24].比较亲本细胞与持续感染多代的细胞之间的转录图谱发现,发现许多参与细胞各方面生命活动的基因在两种细胞中显著差异表达.通过这种方法,本课题组在FMDV感染的分子机制方面有了重要的发现:对包含模式识别受体(pattern recognition receptor,PRR)、主要组织相容性复合物 (major histocompatibility complex,MHC)、白细胞介素-1(interleukin 1,IL-1)家族成员和受体等在内的69个天然免疫相关基因和4个适应性免疫相关基因的差异分析显示,这些基因的平均表达水平在持续感染多代的细胞中比亲本细胞中高,这可以表明持续感染多代的细胞比亲本细胞的免疫应答反应更强烈,而MAPK信号响应更微弱.如果使MAPK/ERK信号通路中断,则可以使FMDV的复制水平明显下降,呈现出持续感染的趋势[37].在此基础上进行的后续研究发现,在FMDV感染的后期,MAPK/ERK和MAPK/p38信号通路会被病毒的复制行为所激活,并对病毒的持续感染做出贡献,通过抑制这两条信号通路可以显著降低病毒的核酸复制水平和蛋白合成水平.根据已有的研究成果可以得出结论,MAPK信号通路的激活很大可能对FMDV持续感染起到了促进作用.
4.4 病毒与免疫系统的相互作用
病毒在生物体中持续感染要具有在宿主免疫系统的压力下生存的能力.对于口蹄疫病毒,大约有两种策略可供它们选择其一或两个全部执行.一是选择躲避在宿主体内如神经系统等一些免疫攻击较弱的部位以求长久生存;二是通过感染免疫细胞如巨噬细胞和淋巴细胞来改变宿主的免疫反应来谋求持续感染.
在逃逸免疫系统的清除方面,Sanz-Parra等[40]通过研究发现FMDV通过阻止宿主细胞合成MHC-I类分子来达到逃脱宿主的免疫应答的目的.细胞表面的MHC-I类分子表达受影响,导致病毒的抗原性物质病毒肽不能被呈递给T淋巴细胞,这对病毒起到了重要的保护作用,使病毒有机会不断繁衍、不断产生新的突变株,有利于病毒在宿主体内形成持续感染.
Nfon与Ostrowski等[41-42]发现免疫细胞的吞噬作用在小鼠和牛感染FMDV后得到了抑制,这导致了机体延迟清除病毒,有利于持续感染的发展.最近,James等[43]用IPA(Ingenuity Pathway Analysis)软件分析了所有差异表达基因,发现FMDV携带者和非携带者的鼻咽上皮之间差异表达的基因会显着影响免疫细胞的运输:减少中性粒细胞、T细胞和树突状细胞的募集,增加巨噬细胞和NK细胞向上皮细胞的迁移.Zhang等[44]通过检测牛的血清样品,发现早期感染的携带者虽然口蹄疫病毒的抗体水平与非携带者别无二致,但白介素IL-10的量总体上明显高于非携带动物,这可能是免疫细胞的运输受到影响的直接原因之一.以上都说明免疫调节作用起效对于宿主抵抗病毒入侵非常重要.
在抑制细胞的免疫应答方面,有研究发现是否接种口蹄疫疫苗会影响受FMDV感染的牛产生免疫应答[45].在感染细胞中诱导凋亡的两种主要机制是T细胞介导的细胞毒性和死亡受体信号转导,这些机制可以帮助细胞清除病毒.Eschbaumer等[45]通过比较携带FMDV与非携带FMDV的牛的成熟mRNA序列,发现在携带者中表达的促凋亡基因与补体调节因子都明显低于非携带者,说明在携带者FMDV持续感染的组织中,细胞凋亡的两种机制均受到损害[46].此外,病毒还可以通过抑制调节型T细胞介导的抗病毒免疫来维持其持续感染[47].
5 总结与展望
本文对FMDV持续感染在体内存在的位置、感染特性及持续感染各方面的机制进行了综合介绍.目前,通过单细胞分析、转录组测序等方式[50]已经筛选出了病毒与细胞中许多与持续感染相关的基因和分子,并联系信号通路阐明了二者相互作用和共同进化的部分作用机制.
研究者们发现一些细胞在病毒存在的压力下获得了更强的抵御能力,未来用基因组学、表观基因组学和蛋白质组学分析的方法在持续感染的细胞群中寻找这些细胞并鉴定其特征,或许可以对抗病毒的研究有所启发.同时,病毒与宿主相互适应,共同进化的模式也能为进化生物学的研究提供思路与证据.
当今,我国仍然经常受到口蹄疫的危害.O型、亚洲I型、A型3种血清型[8]的口蹄疫病毒在我国流行.此外还有时发的境外疫情[48-49],常传入我国,严重危害我国的畜牧业.口蹄疫的防疫与消灭工作仍将面临不少难题和挑战,任重而道远.
口蹄疫的疫情防控需要三个方面的努力:1) 开发出有效的诊断检测技术,筛查并消灭作为传染源的FMDV携带动物;2) 切断FMDV携带者与易感动物之间可能的传播途径;3) 开发出针对不同血清型口蹄疫病毒的有效疫苗并实施计划免疫保护易感动物.目前,国内外大量使用的疫苗均为口蹄疫病毒的灭活疫苗.最近的研究者们保留病毒衣壳研制了FMDV VLPs疫苗,VLPs有安全性高、细胞摄取效率高的优点,靶向给药的能力很强.除此之外,疫情防控也需要养殖户们保持饲养环境的卫生,做好日常的预防工作,严格按照免疫程序进行疫苗免疫,按照说明书规定的操作和剂量正确使用疫苗.综合多方努力解决口蹄疫病毒持续感染带来的防疫困难,进一步优化疫情防控体系.
