组蛋白去乙酰化酶抑制剂通过下调MCM2-7表达抑制神经胶质瘤细胞增殖
2022-08-11李慧锋袁忠民吴森斌马莹赵凡一何伟文梁建峰伍健伟
李慧锋,袁忠民,3,吴森斌,马莹,赵凡一,何伟文,2,梁建峰,2,伍健伟,2
(1.广州医科大学附属第二医院神经科学研究所,广东广州 510260;2.广州医科大学附属第二医院番禺院区神经外科,广东广州 511400;3.粤港澳大湾区脑科学与类脑研究中心,广东广州 510515)
神经胶质瘤(glioma)是颅内最常见的原发性肿瘤,由于其浸润性生长和放化疗耐药性,胶质瘤的复发率高,预后差,死亡率高[1-2]。因此,研究胶质瘤发生发展的分子机制及寻找新的靶向性药物,对于治疗胶质瘤和改善预后具有重要意义。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACIs)是一类新型的抗癌药物,它能够抑制肿瘤生长、阻滞细胞周期、诱导细胞分化和凋亡[3-4]。根据化学结构的不同可分为四类:短链脂肪酸类,如NaBu 和VPA;异羟肟酸类,如TSA、SAHA 和LBH589;苯酰胺类,如MS-275 和M344;环肽类,如FK-228。其中,SAHA 已被FDA 批准用于治疗皮肤性淋巴癌,其它组蛋白去乙酰化酶抑制剂也在进行肿瘤治疗的临床试验[5]。微小染色体维持蛋白(minichromosome maintenance proteins,MCMs)是一类DNA 复制起始时发挥关键作用的解旋酶,参与每个细胞周期内的新DNA 生成[6]。MCM2、3、4、5、6 和7 在G1 期早期形成MCM2-7 六聚体加载到DNA 复制起始位点,在G1 后期形成MCM2-7 双六聚体启动S 期DNA 复制。在癌细胞中MCM2-7高表达,这使得六聚体向双六聚体转换时间较正常细胞短,加速细胞周期,促进细胞恶性增殖[7-8]。本研究利用多种HDACIs 处理神经胶质瘤细胞株U251 和H4,观察对细胞增殖、细胞周期及MCM2-7 表达的影响,探讨HDACIs 抑制胶质瘤细胞增殖的机制。
1 材料与方法
1.1 实验材料
人胶质瘤细胞株U251 和H4 细胞由国家实验细胞资源共享平台提供。高糖培养基DMEM 和0.25%胰酶购自Invitrogen 公司,胎牛血清购自Gibco 公司。LBH589、M344、SAHA、TSA 和CPX 购自Selleck公司。RT-qPCR试剂购自日本Toyobo 公司。96 孔板和6 孔板购自NEST 公司。Anti-BrdU、anti-MCM2、anti-MCM7、anti-Ac-H3K9、anti-Ac-H3K27 和anti-H3购自Cell Signaling Technology。Anti-MCM3 和anti-MCM6 购自生工生物工程有限公司,Anti-MCM4、anti-MCM5 和anti-GAPDH 购自Proteintech公司。
1.2 实验方法
1.2.1 胶质瘤细胞培养及药物处理方法 用体积分数10%胎牛血清、1%双抗的高糖DMEM 培养基培养U251 和H4 细胞,设置培养箱温度为37 ℃,CO2浓度为5%,每2~3 d 用胰酶消化传代1 次。取对数生长期细胞进行实验。HDACIs 储存浓度为1 000×工作浓度,溶剂为DMSO。环丙沙星盐酸盐溶于水,储存浓度为分别为0.05mmol∕L×200,0.2 mmol∕L×200,0.5 mmol∕L×200,1.0 mmol∕L×200,使用时用培养基200倍稀释。
1.2.2 MTT 法检测组蛋白去乙酰化酶抑制剂对U251 和H4 细胞增殖的影响 将对数期生长U251和H4细胞用胰酶消化后接种于96孔板,每孔100µL细胞悬液,每组设6 个平行复孔。当细胞生长至融合度为50%时,分别用0.2、0.5、1.0 和2.0 µmol∕L LBH589 处理U251 和H4 细胞24 h。用0.5 µmol∕L LBH589 处理U251 和H4 细胞8、12、16 和24 h。多种组蛋白去乙酰化酶抑制剂(0.5 µmol∕L LBH589、1.0µmol∕L M344 和1.0µmol∕L SAHA)处理24 h,对照组加入等量溶剂DMSO,MTT 法检测细胞存活率,方法同上。处理结束后每孔加入10µL MTT 溶液(5 g∕L)继续培养4 h后终止培养,弃培养液,每孔加入100µL二甲基亚砜(DMSO),摇床振荡10min,用酶标仪检测490 nm 波长下各孔的吸光度值[9]。
1.2.3 BrdU 掺入试验检测组蛋白去乙酰化酶抑制剂对U251 细胞DNA 复制的影响 6 孔板U251细胞密度达到60%至70%时,分别用0.5µmol∕L LBH589、0.5µmol∕L TSA 处理U251 细胞,对照组加入等量溶剂,24 h 后向培养基中加入终浓度为10µmol∕L 5-溴脱氧尿嘧啶核苷(5-bromo deoxyuridine,BrdU),培养箱孵育4 h,40 g∕L 多聚甲醛室温固定30min,用PBS洗3遍后加入2mol∕L的盐酸(溶于0.1%Tween-20 的PBS)37 ℃孵育30 min,正常山羊血清封闭1 h,加入BrdU 一抗(1:100),4 ℃过夜,再用PBS洗3次,加入Cy3标记的二抗室温孵育1 h。洗3 遍后,用Hochest33258 室温染核10 min,免疫荧光显微镜观察并拍照[10-11]。
1.2.4 流式细胞仪检测多种组蛋白去乙酰化酶抑制剂对U251 和H4 细胞周期的影响 用多种组蛋白去乙酰化酶抑制剂(0.5 µmol∕L LBH589、1.0µmol∕L M344 和1.0µmol∕L SAHA)处理U251和H4细胞12h后,使用PBS洗一遍,胰酶消化吹散后收集于1.5mL EP管,离心(4 ℃,644×g,5 min,r=9.5 cm)后弃上清,加入1 mL PBS 洗两遍,4 ℃,644×g,r=9.5 cm,离心5 min。加入75%溶于PBS的乙醇500 µL,于-20 ℃冰箱过夜后离心弃上清,PBS 洗两遍,加入500µL 溶于PBS 终浓度为50µg∕mL 的碘化丙啶(Propidium iodide,PI)于室温避光染色30 min,使用流式细胞仪检测细胞周期[12]。
1.2.5 RT-qPCR 法检测组蛋白去乙酰化酶抑制剂对U251 和H4 细胞MCM2-7 mRNA 表达的影响用多种组蛋白去乙酰化酶抑制剂(0.5 µmol∕L LBH589、1.0 µmol∕L M344 和1.0 µmol∕L SAHA)处理U251和H4细胞12 h后,用Trizol法提取总RNA,RT-qPCR 分别检测MCM2-7 的表达。引物序列见表1。

表1 MCM2-7及GAPDH引物序列Table 1 Primers of MCM2-7 and GAPDH
1.2.6 Western blotting 检测组蛋白去乙酰化酶抑制剂对U251和H4细胞MCM2-7蛋白表达的影响组蛋白去乙酰化酶抑制剂(0.5 µmol∕L LBH589、1.0 µmol∕L M344 和1.0 µmol∕L SAHA)处理U251和H4细胞12 h后,每孔加入2 mL冰PBS洗两遍后,用加入蛋白酶抑制剂的IP buffer 收集细胞,BCA 法测定蛋白浓度并配平。灌制4%集成胶和10%分离胶,200 V 电压电泳45 min,100 V 电压转膜100 min,50 g∕L 脱脂奶粉室温封闭1 h。分别加入一抗(Anti-MCM2-7、anti-AcH3K9、anti-AcH3K27、anti-H3 1:1 000 和 anti-GAPDH 1:10 000)4 ℃孵育过夜,回收一抗后再分别加入HRP标记抗兔或抗鼠二抗室温孵育1 h,ECL 发光后曝光。
1.2.7 MTT 法检测CPX 对U251 和H4 细胞增殖的影响 分别用不同浓度CPX(0.05、0.2、0.5 和1.0 mmol∕L)处理U251 和H4 细胞24 h,0.5 mmol∕L CPX处理U251 和H4 细胞不同时间(8、12、16 和24 h),MTT法检测相对细胞数,方法同上。
1.2.8 流式细胞术检测CPX 对细胞株U251 和H4细胞周期的影响 用0.5 mmol∕L 的环丙沙星处理U251 或H4 细胞12 h 后,流式细胞仪检测细胞周期,方法同上。
1.3 统计学方法
使用SPSS 25.0 统计软件进行统计学分析,计量资料采用均数±标准差()表示。3 组及以上样本的均数比较采用单因素方差分析,随后的组间比较如符合方差齐性采用LSD 法,否则采用Dunnett-t3 检验。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 HDACIs 对U251和H4细胞增殖的影响
2.1.1 不同浓度LBH589对U251及H4细胞增殖的影响 分别用0.2、0.5、1.0 和2.0µmol∕L LBH589 处理U251及H4细胞24 h后,MTT 法测定吸光度值后统计分析每组相对细胞数。差异具有统计学意义(U251:F=229.200,P=0.000,H4:F=32.328,P=0.000,图1A)。采用LSD 法进一步作两两比较,与对照组相比差异均具有统计学意义(P<0.05),LBH589 浓度0.2 µmol∕L 与0.5 µmol∕L 组差异具有统计学意义(P<0.05),LBH589 浓度为0.5 µmol∕L达到半数抑制浓度后随浓度增加相对细胞数差异不具有统计学意义(P>0.05)。
2.1.2 0.5µmol∕LLBH589作用不同时间对U251和H4细胞增殖的影响分别用0.5µmol∕L LBH589 处理U251 和H4 细胞8、12、16 和24 h,相对细胞数差异具有统计学意义(U251:F=67.211,P=0.000,H4:F=53.195,P=0.000;图1B)。采用LSD 法进一步两两比较,除了U251 细胞8 h 组与对照组相比无统计学意义(P>0.05)外,其他处理与对照组相比,相对细胞数均减少(P<0.05)。随着处理时间的延长,相对细胞数越少(P<0.05)。
2.1.3 不同种类组蛋白去乙酰化酶抑制剂对U251和H4细胞增殖的影响分别用0.5µmol∕LLBH589、1.0µmol∕L M344 和1.0µmol∕L SAHA 处理U251 和H4 细胞24 h 后,MTT 法测定吸光度后统计相对细胞数,差异具有统计学意义(U251:F=26.600,P=0.000,H4:F=55.461,P=0.001;图1C 和D)。采用LSD 法进一步统计分析,与对照组相比,相对细胞数均减少(P<0.05)。

图1 HDACIs抑制神经胶质瘤细胞增殖Fig.1 HDACIs suppresses the proliferation of glioma cells
2.2 HDACIs抑制U251细胞的DNA合成
用0.5 µmol∕L LBH589、0.5 µmol∕L TSA处理U251 细胞24 h 后,加入BrdU 继续孵育4 h 后检测细胞增殖率。与对照组比较,BrdU 的掺入率降低,差异具有统计学意义(F=161.628,P=0.000;图2)。采用LSD 法进一步作两两比较,与对照组相比,差异均具有统计学意义(P<0.05)。

图2 HDACIs抑制U251细胞DNA合成Fig.2 HDACIs suppresses DNA synthesis of U251 cells
2.3 HDACIs阻滞U251和H4细胞周期
分别用0.5 µmol∕L LBH589、1.0 µmol∕L M344和1.0µmol∕L SAHA处理U251和H4细胞12 h后,流式细胞仪检测细胞周期,细胞周期的S 期的比例差异具有统计学意义(U251:F=4.478,P<0.05;H4:F=3.821,P<0.05;图3)。采用LSD法进一步两两分析,与对照组相比,差异具有统计学意义(P<0.05)。
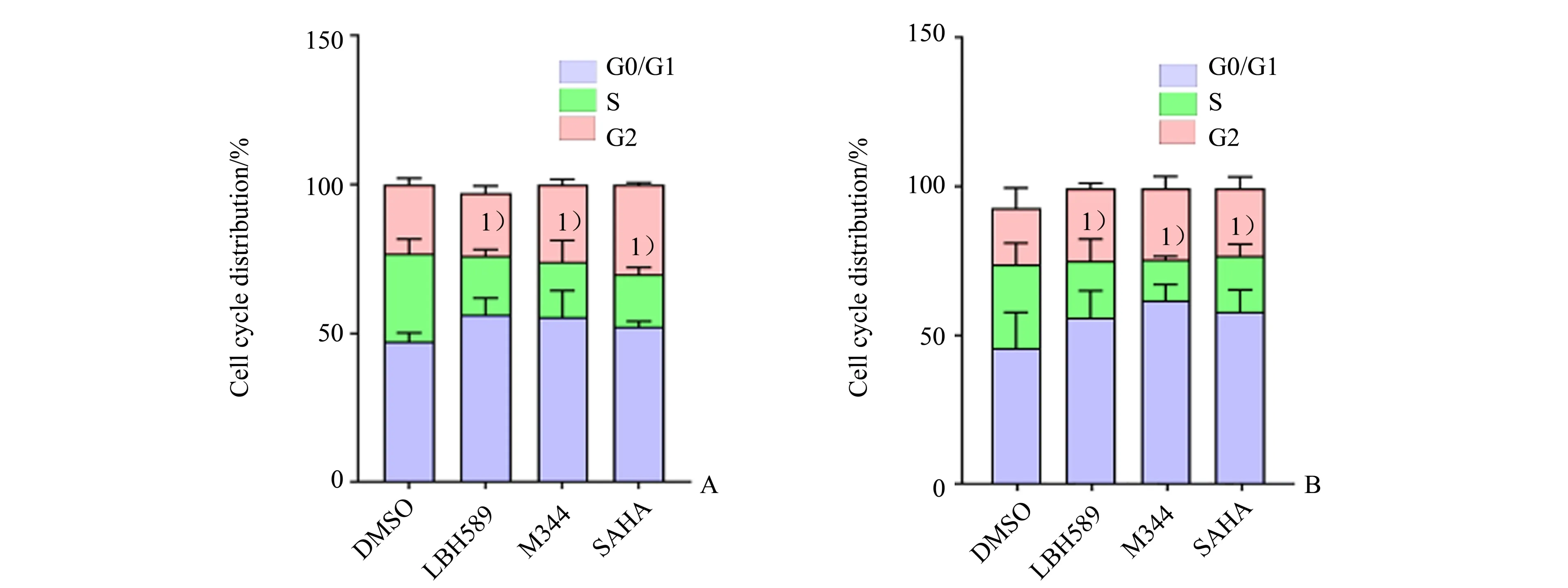
图3 HDACIs减少U251和H4细胞周期的S期在整个细胞周期比率Fig.3 HDACIs reduce the S-phase of U251 cell cycle
2.4 HDACIs下调U251 和H4 细胞内MCM2-7 mRNA水平
分别用0.5 µmol∕L LBH589、1.0 µmol∕L M344和1.0 µmol∕L SAHA 处理U251 和H4 细胞12 h 后,RT-qPCR 检测MCM2-7 mRNA 的表达。与对照组相比,MCM2-7 的表达均减少,差异均具有统计学意义(P<0.05)。
HDACIs 处理U251(图4A)和H4(图4B)细胞株MCM2-7 的统计结果分别为:MCM2(U251:F=1036.480,P=0.000,H4:F=77.715,P=0.000);MCM3(U251:F=158.980,P=0.000,H4:F=381.592,P=0.000);MCM4(U251:F=657.406,P=0.000,H4:F=83.059,P=0.000);MCM5(U251:F=803.059,P=0.000,H4:F=382.211,P=0.000);MCM6(U251:F=352.036,P=0.000,H4:F=88.841,P=0.000);MCM7(U251:F=49.167,P=0.000,H4:F=325.376,P=0.000)。

图4 HDACIs下调MCM2-7 mRNA水平Fig.4 HDACIs inhibit MCM2-7 mRNA expression
2.5 HDACIs减少U251 和H4细胞MCM2-7 蛋白表达
为了探讨组蛋白去乙酰化酶抑制剂是否也抑制胶质瘤细胞MCM2-7蛋白的表达,用多种组蛋白去乙酰化酶抑制剂(包括0.5 µmol∕L LBH589、1.0µmol∕L M344 和1.0 µmol∕L SAHA)处理U251 和H4细胞12 h 后,Western blotting 结果显示,与对照组相比,MCM2-7 蛋白表达均减少,差异具有统计学意义(P<0.05;图5)。

图5 HDACIs减少U251和H4细胞MCM2-7 蛋白表达Fig.5 HDACIs inhibit MCM2-7 protein expression
U251 和H4 细胞株MCM2-7 蛋白表达的统计结果分别为:MCM2(U251:F=19.770,P=0.000,H4:F=61.786,P=0.000);MCM3(U251:F=21.068,P=0.000,H4:F=211.440,P=0.000);MCM4(U251:F=162.830,P=0.000,H4:F=55.091,P=0.000);MCM5(U251:F=24.646,P=0.000,H4:F=1 132.800,P=0.000);MCM6(U251:F=41.849,P=0.000,H4:F=103.920,P=0.000);MCM7(U251:F=52.731,P=0.000,H4:F=113.600,P=0.000)。
Ac-H3K9(U251:F=29.615,P=0.000,H4:F=358.502,P=0.000);Ac-H3K27(U251:F=370.974,P=0.000,H4:F=13.960,P=0.002)。
2.6 环丙沙星抑制MCM2-7 活性对U251 和H4细胞增殖的影响
2.6.1 不同浓度环丙沙星对U251 和H4 细胞增殖的影响 环丙沙星(CPX)是解旋酶MCM2-7 活性抑制剂,为了确定抑制MCM2-7 后U251 细胞的增殖率是否降低,MTT 法检测向U251和H4细胞后加入0.05、0.2、0.5和1.0 mmol∕L CPX 24 h后,各组相对细胞数差异具有统计学意义(U251:F=65.099,P=0.000,H4:F=287.348,P=0.000;图6A),进一步对U251 和H4细胞采用LSD法两两比较,与对照组相比,差异具有统计学意义(P<0.05),随着浓度的增大,细胞增殖率逐渐减少,差异具有统计学意义(P<0.05)。
2.6.2 环丙沙星作用不同时间对U251和H4细胞增殖的影响 用0.5 mmol∕L 的环丙沙星分别作用U251 和H4 细胞8、12、16 和24 h 后,MTT 法检测细胞相对数,差异具有统计学意义(U251:F=152.488,P=0.000,H4:F=187.348,P=0.000;图6B)。

图6 环丙沙星抑制胶质瘤细胞U251和H4增殖Fig.6 CPX suppresses the proliferation of glioma cells
2.7 环丙沙星阻滞U251和H4细胞周期
为了确定抑制MCM2-7后U251和H4细胞周期是否改变,流式细胞术检测发现加入0.5 mmol∕L CPX 12 h 后,与对照组相比,U251 和H4 细胞周期S 期均显著减少,差异具有统计学意义(U251:t=5.306,P=0.000,H4:t=2.306,P=0.000;图7)。
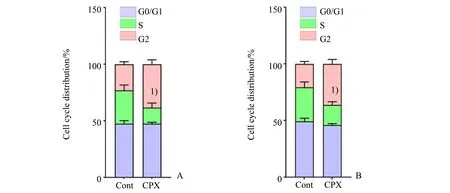
图7 环丙沙星减少U251和H4细胞周期的S期Fig.7 CPX reduces the S-phase of U251 and H4 cells cell cycle
3 讨论
由于局部侵袭性强且缺少针对性治愈方法,胶质瘤是目前最具致命性的癌症之一。尽管手术切除和放化疗手段在不断提高,胶质瘤生存率仍未得到改善[13-14]。分子生物学的发展提高了对胶质瘤发病机制的认识,完善了胶质瘤的诊断、分级和治疗手段。恶性胶质瘤伴随DNA 复制能力增强的特点,DNA 复制调控蛋白MCM2-7 的表达与肿瘤的WHO分级密切相关[15-16]。
乙酰化和去乙酰化的动态平衡调节着基本的生理功能如细胞存活、死亡、周期等,而乙酰化失衡引起的基因表达异常会导致上述功能紊乱,继而造成多种疾病的发生[17-18]。特别是,HDACs活性增强介导的去乙酰化事件已被证明是胶质瘤等多种肿瘤发生、发展的重要病理原因[19]。在这种微环境条件下,一系列抑癌基因如p21、p16、Rb 的表达下调,而原癌基因如Raf1、EGFR、c-Jun 高表达,促进癌症发生[20-21]。我们发现HDACs 活性介导了MCM2-7 表达,增强了DNA 复制能力,这可能是肿瘤细胞适应恶性增殖的一种特征。HDACs 的底物包括组蛋白和非组蛋白,它们一方面通过去乙酰化核小体上组蛋白H3、H4、H2A 和H2B,使染色体结构重塑以调控基因转录[22]。另一方面,还通过改变转录因子乙酰化状态,影响其活性,调控基因表达[23]。但HDACs通过何种机制调控MCM2-7表达,尚需进一步研究。
总之,本研究阐明了HDACIs 抑制MCM2-7 表达和DNA 复制起始进程是其重要抗癌机制之一。另一方面,这些研究结果还表明在胶质瘤细胞内MCM2-7 的表达依赖HDACs 活性,高活性的HDACs 促进MCM2-7 表达以增强DNA 复制能力,适应恶性增殖。我们的研究不仅揭示了HDACIs的抗癌新机制,还首次报道了MCM2-7 表达依赖HDACs 活性,为认知胶质瘤的发生本质和靶向治疗提供了新的理论和实验依据。
