miR-130b-5p下调胰岛素样生长因子-1抑制人绒毛膜滋养层细胞迁移及侵袭的作用及机制
2022-08-11相萌张旭东
相萌,张旭东
(1.西安医学院临床医学院妇产科教研室,陕西西安 710021;2.西安医学院临床医学院拉吉姆实验室,陕西西安 710021)
胎儿生长受限(fetal growth restriction,FGR)是最常见的产前疾病之一,可造成早产及成年期神经障碍及慢性疾病发生率增加,怀孕初期子宫螺旋动脉重构不足是造成其发生的主要原因,而人绒毛膜滋养层细胞侵袭功能异常可导致子宫螺旋动脉重构障碍的发生,因此了解人绒毛膜滋养层细胞的侵袭、迁移机制,对胎儿的生长发育及健康十分重要[1-3]。微小RNA(miRNA)作为转录后调节剂,可与其靶基因mRNA 3'-非翻译区(3'-UTR)特异性结合,以此抑制其翻译,从而参与FGR、先兆子痫、流产、妊娠期糖尿病等妊娠疾病的发生[4]。妊娠期糖尿病可导致FGR 的发生,而在妊娠期糖尿病患者胎盘滋养细胞系中miR-130b 表达水平异常增加,除此之外miR-130b-5p 与多种细胞的侵袭、迁移能力有关[5-6]。胰岛素样生长因子-1(insulinlike growth factor-1,IGF-1)主要分泌于胎盘中,其作为子宫内生长调节剂,在FGR 发生时其循环浓度异常降低[7]。研究发现在胶质母细胞瘤中miR-130b 与IGF-1表达水平呈负相关关系[8]。目前,关于miR-130b-5p 是否可通过调控IGF-1来影响人绒毛膜滋养层细胞(HTR-8∕SVneo)迁移及侵袭还未可知,因此本研究通过对其探究,以期为FGR 的治疗提供新的靶点。
1 材料与方法
1.1 试剂和仪器
HTR8∕SVneo 细胞(南京赛泓瑞生物科技有限公司,货号:SHC1187);Lipofectamine™2000 Transfection Reagent 转染试剂盒(杭州沃森生物技术有限公司,货号:11668019);青链霉素、DMEM 基础培养基、胎牛血清、胰酶溶液(上海中乔新舟生物科技有限公司,货号:0503、ZQ-100、0025、0103);蛋白提取试剂盒(武汉纯度生物科技有限公司,货号:CD-13559-ML);HRP 标记的山羊抗兔IgG 二抗抗体(艾美捷科技有限公司,货号:AAT-16793);BCA蛋白检测试剂盒(北京索莱宝科技有限公司,货号:PC0020);兔抗β-actin、波形蛋白(Vimentin)、c-Myc、神经型钙粘附蛋白(N-cadherin)抗体(Cell Signaling Technology,货号:4967、5741、5605、13116);细胞周期蛋白D1(CyclinD1)(Biorbyt,货号:orb77046);兔抗基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)、钙粘附蛋白E(E-cadherin)抗体(Proteintech,货号:20874-1-AP、10375-2-AP、10373-2-AP);pcDNA3.1、pcDNA3.1-IGF-1、miR-130b-5pmimics、miR-NC 由赛默飞世尔科技合成;CCK-8 细胞增殖及细胞毒性检测试剂盒(贝博-Bestbio,货号:BB-4202)。
CFX384™Touch 荧光定量PCR 系统购自伯乐(Bio-Rad)公司;M4激光全息细胞成像及分析系统购自瑞典Phiab 公司;Invitrogen 凝胶成像系统购自赛默飞。
1.2 实验方法
1.2.1 HTR8∕SVneo 细胞培养 将已复苏的HTR8∕SVneo 细胞接种于含1%青链霉素及10 g∕L 胎牛血清的DMEM 培养基后,在体积分数5%CO2、37 ℃培养箱中培养到细胞融合至约80%时经2.5 g∕L 胰酶消化、传代培养。
1.2.2 双荧光素酶报告基因检测miR-130b-5p 和IGF-1 的靶向关系 TargetScan 网址确定miR-130b-5p和IGF-1的结合位点并对二者间的靶向关系进行验证。将与miR-130b-5p 靶向序列相结合的IGF-1 3'-UTR 片段经扩增、酶切后进行连接,构建野生型pmirGLO-IGF-1-wt,再通过基因突变技术对结合位点进行突变,构建突变型pmirGLOIGF-1-mut 载体;根据转染试剂盒说明书将pmir-GLO-IGF-1-wt 及pmirGLO-IGF-1-mut 分别与miR-130b-5p mimics 和miR-NC 进行共转染,分为pmirGLO-IGF-1-wt+miR-130b-5p mimics 组、pmirGLO-IGF-1-wt+miR-NC 组、pmirGLO-IGF-1-mut+miR-130b-5p mimics 组、pmirGLO-IGF-1-mut+miR-NC 组,于48 h 后添加报告基因细胞裂解液(200µL)及荧光素酶反应液(50µL)检测荧光强度A,之后添加反应终止液检测荧光强度B,A∕B 即为荧光素酶相对活性。
1.2.3 分组及HTR8∕SVneo 细胞转染 设置对照组、miR-NC 组、miR-130b-5pmimics 组、miR-130b-5pmimics+pcDNA3.1 组和miR-130b-5pmimics+pcDNA3.1-IGF-1 组;将HTR8∕SVneo细胞(1mL)以2×106个∕孔的密度接种到6孔板中(设置5个复孔)培养至贴壁后,按照Lipofectamine™2000说明书进行操作,以5 nmol∕L 为终浓度分别将miR-NC、miR-130b-5pmimics、pcDNA3.1、pcDNA3.1-IGF-1 转至相应的HTR8∕SVneo 细胞中后培养48 h,检测miR-130b-5p表达水平。
1.2.4 qRT-PCR检测HTR8∕SVneo细胞样本中miR-130b-5p 及IGF-1 表达水平 将各组转染后的HTR8∕SVneo 细胞根据Trizol 法提取细胞中总RNA并检测其浓度,取所得RNA反转录为cDNA后进行qRT-PCR扩增(5个复孔);引物由Oligo 7软件设计(表1),上海生工合成,以U6和GAPDH为内参分别对miR-130b-5p 及IGF-1进行标准化,2-ΔΔCt计算基因表达水平。

表1 qRT-PCR引物Table 1 qRT-PCR primers
1.2.5 CCK-8法检测HTR8∕SVneo细胞增殖情况将转染后的HTR8∕SVneo 细胞以1×104个∕孔的密度接种于96 孔板中(重复5 孔),培养24 h 后添加CCK-8(10µL∕孔)培养2 h后在酶标仪450 nm 处测定OD 值,计算HTR8∕SVneo 细胞增殖抑制率(%)=[(对照组OD值-实验组OD值)∕(对照组OD值-空白组OD值)]× 100%。
1.2.6 全息细胞仪分析HTR8∕SVneo 细胞迁移能力 将转染后的HTR8∕SVneo 细胞以2×105个∕孔的密度接种于6 孔板中培养24 h 后,通过激光全息细胞分析及成像系统监测细胞在24 h 内的迁移情况。
1.2.7 Transwell 法检测HTR8∕SVneo细胞侵袭能力用无血清培养基以1:8 的比例稀释Matrigel后加入到Transwell 小室上室4 h 孵育,将各组200µL HTR8∕SVneo 细胞悬液以1×105个∕mL 接种到上室后在下室加入600 µL DMEM 培养基培养12 h,PBS 清洗后用棉签擦拭上室HTR8∕SVneo 细胞,10 min 甲醇固定后30 min 结晶紫染色,选取5 个视野进行观察,对穿膜细胞进行计数。
1.2.8 Western blot 检测HTR8∕SVneo细胞中的蛋白表达情况添加400µL RIPA 蛋白裂解液裂解HTR8∕SVneo 细胞后12 000 r∕min(r=10 cm)10 min离心取上清,BCA 法定量分析总蛋白;将40 µg 蛋白样品通过SDS-PAGE 凝胶电泳(40 µg∕孔)进行分离后在低温条件下将蛋白转移至PVDF膜上,1 h脱脂奶粉封闭后加入兔抗MMP9、MMP2、c-Myc、CyclinD1、E-cadherin、N-cadherin、Vimentin、β-actin、IGF-1 抗体(1:1 000)一抗孵育(4 ℃)过夜,用Tris-HCl 缓冲盐溶液加Tween(Tris Buffered saline Tween,TBST)进行洗膜后添加HRP 标记的山羊抗兔IgG 二抗(1:10 000)进行孵育2 h,TBST 洗膜、化学发光试剂(ECL Reagent)显色,蛋白凝胶成像仪显影观察后Image J 软件检测条带灰度值,β-actin为内参,计算蛋白含量(重复5孔)。
1.3 统计学方法
2 结果
2.1 miR-130b-5p 和IGF-1 在HTR8/SVneo 细胞中的靶向关系验证
TargetScan 在线网址预测结果显示:miR-130b-5p 和IGF-1二者间具有靶向结合位点(图1);如图2 所示,荧光素酶报告基因实验结果显示:与pmirGLO-IGF-1-wt+miR-NC 组相比,pmirGLOIGF-1-wt+miR-130b-5p mimics组荧光素酶活性显著降低(t=6.040,P<0.001);其余两组荧光素酶活性无显著变化(t=0.243,P>0.05)。
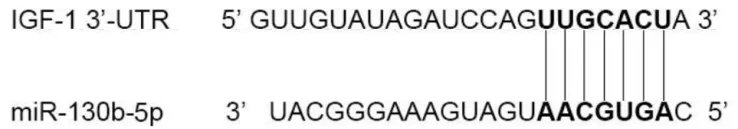
图1 miR-130b-5p和IGF-1间的具有靶向结合位点Fig.1 Targeted binding site between miR-130b-5p and IGF-1
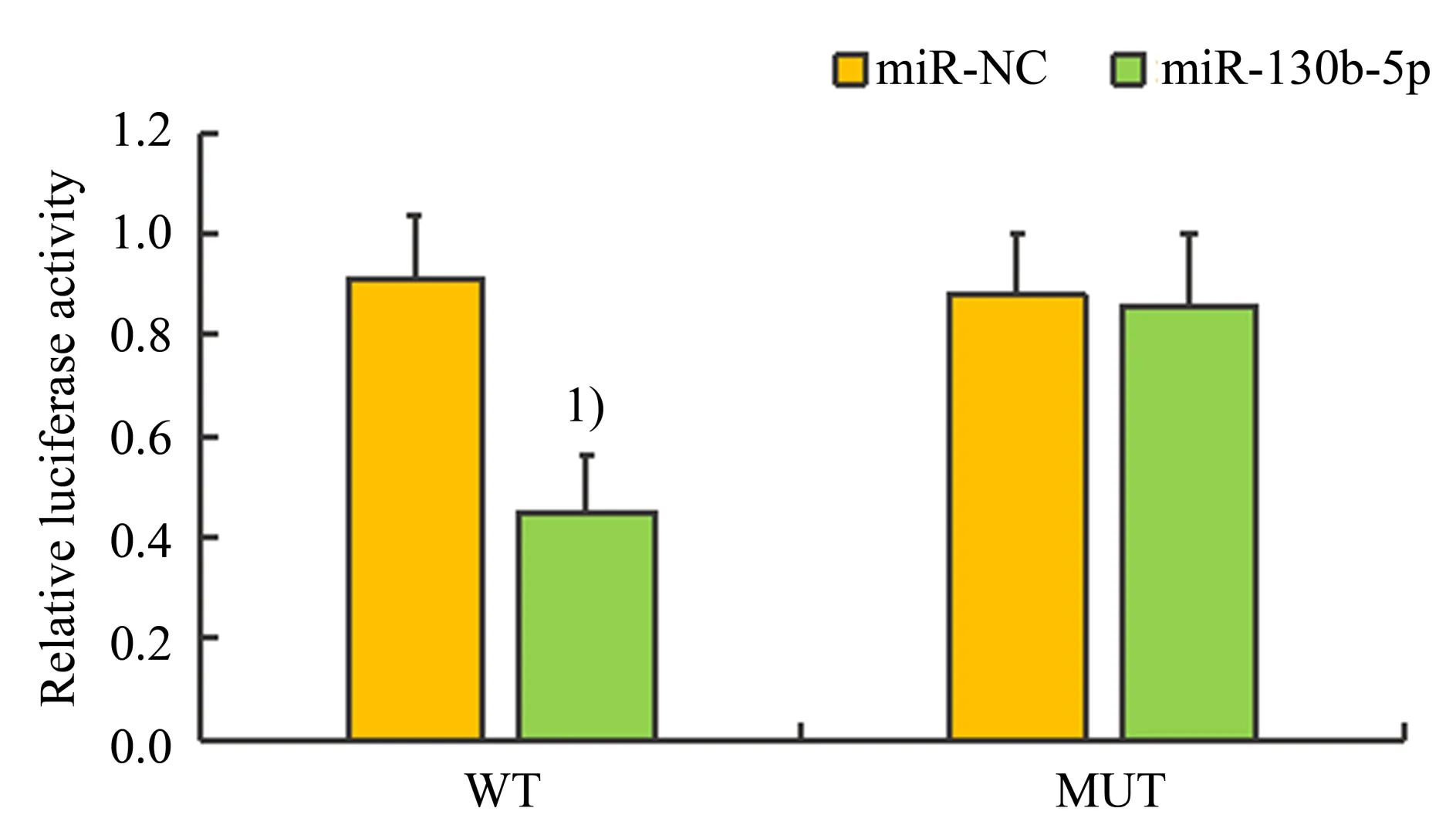
图2 荧光素酶活性检测Fig.2 Luciferase activity assay
2.2 miR-130b-5p及IGF-1表达水平检测
如表2 所示,相较于对照组,HTR8∕SVneo 细胞中miR-130b-5p、IGF-1 蛋白及mRNA 表达水平在miR-NC 组中的差异无统计学意义(P>0.05);相较于miR-NC 组,miR-130b-5pmimics组中miR-130b-5p 表达水平显著增加,IGF-1 蛋白及mRNA表达水平显著降低(P<0.05;表2,图3)。

图3 HTR8/SVneo细胞中IGF-1蛋白表达情况Fig.3 Expression of IGF-1 protein in HTR8/SVneo cells
表2 miR-130b-5p及IGF-1表达水平检测Table 2 Detection of expression levels of miR-130b-5p and IGF-1(n=5,)
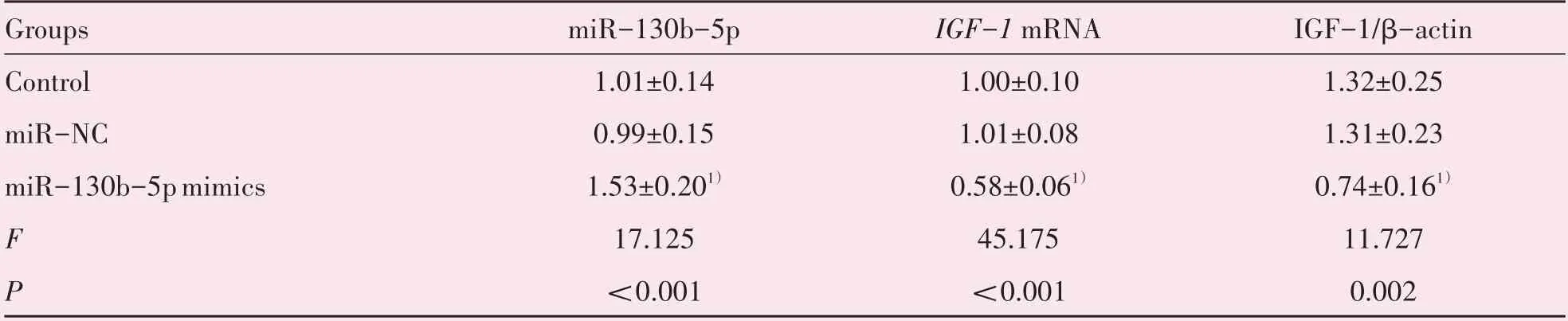
表2 miR-130b-5p及IGF-1表达水平检测Table 2 Detection of expression levels of miR-130b-5p and IGF-1(n=5,)
Compared with the miR-NC group,1)P<0.05.IGF-1:insulin-like growth factor-1.
2.3 miR-130b-5p 对HTR8/SVneo细胞增殖的影响
相较于对照组,HTR8∕SVneo 细胞增殖抑制率、c-Myc 和CyclinD1 表达水平在miR-NC 组中的差异无统计学意义(P>0.05);相较于miR-NC组,miR-130b-5p mimics 组中细胞增殖抑制率显著增加,c-Myc 和CyclinD1 表达水平显著降低(P<0.05);相较于miR-130b-5p mimics 组,HTR8∕SVneo 细胞增殖抑制率、c-Myc 和CyclinD1表达水平在miR-130b-5pmimics+pcDNA3.1 组中的差异无统计学意义(P>0.05);相较于miR-130b-5pmimics+pcDNA3.1 组,miR-130b-5pmimics+pcDNA3.1-IGF-1 组中细胞增殖抑制率显著降低,c-Myc 和CyclinD1 表达水平显著增加(P<0.05;表3,图4)。
表3 miR-130b-5p对HTR8/SVneo细胞增殖的影响Table 3 The effect of miR-130b-5p on the proliferation of HTR8/SVneo cells(n=5,)

表3 miR-130b-5p对HTR8/SVneo细胞增殖的影响Table 3 The effect of miR-130b-5p on the proliferation of HTR8/SVneo cells(n=5,)
Compared with the miR-NC group,1)P<0.05;Compared with the miR-130b-5p mimics+pcDNA3.1 group,2)P<0.05.

图4 miR-130b-5p对HTR8/SVneo细胞增殖相关蛋白的影响Fig.4 The effect of miR-130b-5p on the proliferation-related proteins of HTR8/SVneo cells
2.4 miR-130b-5p 对HTR8/SVneo细胞迁移的影响
相较于对照组,HTR8∕SVneo 细胞迁移距离在miR-NC 组的差异无统计学意义(P>0.05);相较于miR-NC 组,miR-130b-5p mimics 组中细胞迁移距离显著降低(P<0.05);相较于miR-130b-5p mimics 组,miR-130b-5pmimics+pcDNA3.1 组中HTR8∕SVneo 细胞迁移距离的差异无统计学意义(P>0.05);相较于miR-130b-5pmimics+pcDNA3.1 组,miR-130b-5pmimics+pcDNA3.1-IGF-1 组中细胞迁移距离显著增加(P<0.05;图5)。
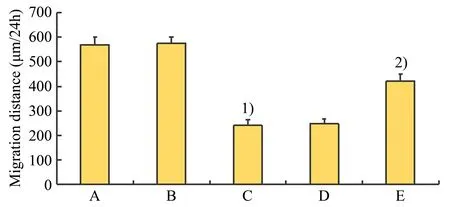
图5 miR-130b-5p对HTR8/SVneo细胞迁移的影响Fig.5 The effect of miR-130b-5p on the migration of HTR8/SVneo cells
2.5 miR-130b-5p 对HTR8/SVneo细胞侵袭的影响
如表4 所示,相较于对照组,HTR8∕SVneo 细胞侵袭细胞数、MMP9 和MMP2 表达水平在miR-NC组的差异无统计学意义(P>0.05);相较于miR-NC组,miR-130b-5p mimics 组中细胞侵袭细胞数、MMP9和MMP2表达水平显著降低(P<0.05);相较于miR-130b-5p mimics 组,miR-130b-5pmimics+pcDNA3.1组中HTR8∕SVneo细胞侵袭细胞数、MMP9 和MMP2 表达水平的差异无统计学意义(P>0.05);相较于miR-130b-5pmimics+pcDNA3.1组,miR-130b-5pmimics+pcDNA3.1-IGF-1 组中细胞侵袭细胞数、MMP9 和MMP2 表达水平显著增加(P<0.05;图6,图7)。

图6 miR-130b-5p对HTR8/SVneo细胞侵袭的影响Fig.6 The effect of miR-130b-5p on the invasion of HTR8/SVneo cells

图7 miR-130b-5p对HTR8/SVneo细胞侵袭相关蛋白的影响Fig.7 Effects of miR-130b-5p on invasion-related proteins of HTR8/SVneo cells
表4 miR-130b-5p对HTR8/SVneo细胞侵袭的影响Table 4 The effect of miR-130b-5p on the invasion of HTR8/SVneo cells(n=5,)

表4 miR-130b-5p对HTR8/SVneo细胞侵袭的影响Table 4 The effect of miR-130b-5p on the invasion of HTR8/SVneo cells(n=5,)
Compared with the miR-NC group,1)P<0.05;Compared with the miR-130b-5p mimics+pcDNA3.1 group,2)P<0.05.MMP9:matrix metalloproteinase 9;MMP2:matrix metalloproteinase 2.
2.6 miR-130b-5p 对HTR8/SVneo细胞Ecadherin、Vimentin和N-cadherin蛋白表达的影响
如表5 所示,相较于对照组,HTR8∕SVneo 细胞中E-cadherin、Vimentin 和N-cadherin 表达水平在miR-NC 组的差异无统计学意义(P>0.05);相较于miR-NC 组,miR-130b-5p mimics组中E-cadherin表达水平显著增加,Vimentin 和N-cadherin 表达水平显著降低(P<0.05);相较于miR-130b-5p mimics 组,miR-130b-5pmimics+pcDNA3.1 组中E-cadherin、Vimentin 和N-cadherin 表达水平的差异无统计学意义(P>0.05);相较于miR-130b-5pmimics+pcDNA3.1 组,miR-130b-5pmimics+pcDNA3.1-IGF-1 组中E-cadherin 表达水平显著降低,Vimentin 和N-cadherin表达水平显著增加(P<0.05;图8)。
表5 miR-130b-5p对HTR8/SVneo细胞E-cadherin、Vimentin和N-cadherin蛋白表达的影响Table5 EffectsofmiR-130b-5pontheexpressionofE-cadherin,VimentinandN-cadherinproteinsinHTR8/SVneocells(n=5,)

表5 miR-130b-5p对HTR8/SVneo细胞E-cadherin、Vimentin和N-cadherin蛋白表达的影响Table5 EffectsofmiR-130b-5pontheexpressionofE-cadherin,VimentinandN-cadherinproteinsinHTR8/SVneocells(n=5,)
Compared with the miR-NC group,1)P<0.05;Compared with the miR-130b-5p mimics+pcDNA3.1 group,2)P<0.05.
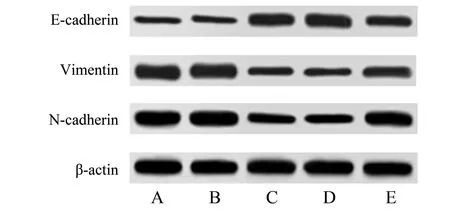
图8 miR-130b-5p对HTR8/SVneo细胞EMT相关蛋白的影响Fig.8 Effects of miR-130b-5p on EMT-related proteins in HTR8/SVneo cells
3 讨论
FGR 是一种产科疾病,可导致胎儿生长受损,增加围产期死亡率[9-11]。绒毛膜滋养层细胞是胎盘的主要组成细胞之一,侵袭功能受到抑制会造成子宫螺旋动脉重塑障碍、胎盘缺氧缺血的发生,从而导致FGR、先兆子痫和胎盘增生等妊娠并发症的发生[3,12]。因此详细了解绒毛膜滋养层细胞在FGR中的侵袭机制对疾病治疗极其重要。
miRNA 作为高度保守的非编码RNA,近几年有研究发现其参与调控绒毛膜滋养层细胞的侵袭和迁移[13]。miR-130b-5p 参与多种癌症的侵袭迁移过程,其在宫颈癌组织中表达异常降低,通过促进ELK1表达来促进癌细胞的增殖、侵袭和迁移[14]。而最近有研究表明miR-130b-3p 在妊娠期糖尿病胎盘滋养层细胞中表达异常增加,沉默其表达可保护细胞免受氧化应激损伤[5]。MMP9、MMP2 由于可降解子宫内膜主要成分Ⅳ型胶原而在HTR8∕SVneo 细胞侵袭子宫内膜过程中具有重要作用[3]。人绒毛膜滋养层细胞经过上皮间充质转化(Epithelial-Mesenchymal Transition,EMT)渗入母体蜕膜间质和血管中,因此EMT 过程对绒毛膜滋养层细胞的侵袭功能十分重要[15]。本研究发现miR-130b-5p 过表达可显著促进HTR8∕SVneo 细胞增殖抑制率和E-cadherin 表达水平,降低c-Myc、CyclinD1表达水平、迁移距离、侵袭细胞数、MMP9、MMP2、Ncadherin、Vimentin 表达水平,该结果表明miR-130b-5p 过表达可显著抑制HTR8∕SVneo 的增殖和迁移、侵袭能力。
研究发现在发育70 d 的猪仔肝脏中miR-130b-3p靶向促进IGF-1表达[16]。本研究双荧光素酶报告基因结果显示,IGF-1是miR-130b-5p 的潜在靶基因;miR-130b-5p 过表达可显著降低IGF-1表达水平,与前人研究结果相似。IGF-1 已被证明是滋养层细胞增殖和侵袭的重要调节剂,IGF-1 表达上调可促进MMP-2 表达,以此促进HTR-8∕SVneo 细胞的侵袭能力[17-18]。胎盘功能不全造成的宫内生长受限患者胎盘中由于胰岛素样生长因子结合蛋白1(insulin-like growth factor-binding protein-1,IGFBP-1)过度磷酸化,导致IGF-1 表达水平显著降低[19]。本研究发现miR-130b-5pmimics+pcDNA3.1-IGF-1 组对miR-130b-5p 所造成的细胞增殖、侵袭和迁移的抑制起到逆转作用。提示,miR-130b-5p 过表达对HTR8∕SVneo 细胞的增殖、侵袭和迁移的抑制可能与其抑制IGF-1表达有关。
综上所述,miR-130b-5p 过表达可能通过抑制IGF-1表达来抑制HTR8∕SVneo 细胞的增殖、侵袭和迁移。本研究不仅为FGR 的发生机制研究提供进一步参考,还为其治疗提供了新的潜在治疗靶点。但在未来的研究中还需对miR-130b-5p 在FGR 中的下游调控机制进行深入探究。
