miR-96-5p 靶向叉头状转录因子O1 对Ishikawa 细胞的作用
2022-08-11冯艳奇张娥张蕾郝颂华倪婷婷
冯艳奇,张娥,张蕾,郝颂华,倪婷婷
(1.河南医学高等专科学校妇科教研室,河南郑州 451191;2.河南中医药大学第一附属医院妇产科,河南郑州 450000;3.河南中医药大学,河南 郑州 450046)
子宫内膜癌是女性生殖道最常见的恶性肿瘤,近年来其发病率呈上升趋势[1]。目前治疗子宫内膜癌的方法主要包括手术切除、放化疗法和激素疗法[2]。但是,由于晚期转移性或复发性子宫内膜癌患者失去了手术机会,治疗失败率较高,因此,需要研制新的治疗方法。目前,越来越多的分子靶向药物正在临床测试应用,且部分药物已显示出有效结果[3-4]。微小RNA(microRNA,miRNA)是可以调节一组靶基因并导致翻译抑制或mRNA 降解的分子[5]。最近的研究表明,子宫内膜癌中大量miRNA失调并调节细胞的生长和转移,继而影响肿瘤的发生和发展[6]。有研究发现,miR-96-5p 在结肠癌[7]、卵巢癌[8]和肺癌[9]中的表达均明显上调,并促进癌细胞的增殖和迁移;miR-96-5p在子宫内膜癌中表达上调,可能与患者不良预后相关[10]。而叉头状转录因子O1(forkhead box transcription factor O1,FOXO1)在各种癌症(包括子宫内膜癌)的进展中起抑癌作用[11]。因此,本文主要探讨了miR-96-5p 是否通过调控FOXO1影响子宫内膜癌细胞的增殖和侵袭。
1 材料与方法
1.1 临床组织标本
收集2018 年4 月至2020 年5 月在河南中医药大学第一附属医院行子宫切除术的50 例患者子宫内膜癌和癌旁正常组织样本,-80 ℃保存。子宫内膜癌均经病理学确诊,且术前未接受过任何其他治疗。本研究经河南中医药大学第一附属医院伦理委员会批准(批件号:HNZYYDXFSYY-2020-029),所有参与者均知情同意。
1.2 主要试剂及仪器
DMEM 培养基、胎牛血清(fetal bovine serum,FBS)(美国Gibco 公司);Lipofectamine2000 和Trizol试剂(美国Invitrogen 公司);cDNA 反转录试剂盒和SYBR Green PCR Master Mix 试剂盒(日本TaKaRa公司);CCK-8试剂、RIPA 裂解缓冲液、BCA 试剂盒和ECL发光剂(上海碧云天生物技术有限公司);兔抗FOXO1 抗体(ab39670)、兔抗细胞周期蛋白D1(cyclin D1)抗体(ab16663)、兔抗活化多聚ADP 核糖聚合酶(cleaved poly-ADP ribose polymerase,cleaved PARP)抗体(ab32064)、兔抗p21抗体(ab109520)、兔抗波形蛋白抗体(ab92547)、兔抗GAPDH(ab9485)(英国Abcam 公司);辣根过氧化物酶偶联的山羊抗兔二抗(#7074,美国CST 公司);双荧光素酶报告系统(美国Promega 公司)。高速低温离心机(美国Beckman 公司);Varioskan LUX酶标仪(美国Thermo Fisher公司);Promotor®实时荧光定量PCR 仪(杭州艾康生物技术有限公司);Primo Star iLED 显微镜(德国蔡司公司);电泳仪,电转仪(北京六一生物科技有限公司);Tanon 3500凝胶成像系统(上海天能公司)。
1.3 方法
1.3.1 细胞培养及细胞转染 子宫内膜癌Ishikawa 细胞购自美国菌种保藏中心(American type culture collection,ATCC)。Ishikawa 细胞在含有100 mL∕L FBS 的DMEM 培养基(含100 U∕mL 青霉素和100 µg∕mL 链霉素)于37 ℃和50 mL∕L CO2的加湿培养箱中培养。当细胞达到80%融合时,根据Lipofectamine2000试剂说明书进行转染。向Ishikawa细胞转染pcDNA、pcDNA-FOXO1、inhibitor NC、miR-96-5p inhibitor、mimic NC、miR-96-5p mimic以及共转染miR-96-5p mimic 和pcDNA-FOXO1,分别记为pcDNA 组、FOXO1 组、inhibitor NC 组、miR-96-5p inhibitor组、mimic NC 组、miR-96-5p组和miR-96-5p+FOXO1 组,对照组不进行转染。以上载体和基因序列均由上海吉玛基因公司设计和提供。
1.3.2 qRT-PCR 检测正常组织和子宫内膜癌组织中miR-96-5p 和FOXO1 mRNA 的表达 采用Trizol 试剂提取组织标本及转染细胞的总RNA,然后用分光光度计检测RNA 纯度。根据反转录试剂盒说明,取10 ng RNA 用于cDNA 合成。反应程序:16 ℃30 min;42 ℃30 min,85 ℃5 min。使用SYBR Green PCR Master Mix 试剂盒进行qRT-PCR反 应,程序如下:95 ℃ 2 min;95 ℃ 15 s,60 ℃1 min,40 个循环;以U6 或GAPDH 对照,采用2-ΔΔct法计算miR-96-5p 和FOXO1 的表达。qRTPCR 反应特异性引物如下所示:FOXO1,正向5'-TGGACATGCTCAGCAGACATC-3',反向 5'-TTGGGTCAGGCGGTTCA-3';GAPDH,正向5'-TATGATGATATCAAGAGGGTAGT-3',反向 5'-TGTATCCAAACTCATTGTCATAC-3';miR-96-5p,正向 5'-ACACTCCAGCTGGGTTTGGCACTAGCACATTT-3',反向5'-CTCAACTGGTGTCGTGGA-3';U6,正向5'-CTCGCTTCGGCAGCACA-3',反向5'-AACGCTTCACGAATTTGCGT-3'。
1.3.3 Western blot 检测FOXO1、cyclin D1、cleaved-PARP、p21 和Vimentin 蛋白表达 用RIPA 裂解缓冲液裂解组织,12 000×g离心后收集上清液,BCA测定蛋白浓度。凝胶电泳分离等量的蛋白质并电转移到聚偏二氟乙烯(polyvinylidene fluoride,PVD)膜。50 g∕L 的脱脂牛奶封闭后,PVDF 膜用抗GAPDH(1:1 000)、FOXO1(1:1 000)、cyclin D1(1:1 000)、cleaved PARP(1:1 000)、p21(1:1 000)和波形蛋白(1:1 000)的一抗4 ℃孵育过夜。然后用辣根过氧化物酶(horseradish peroxidase,HRP)偶联的山羊抗兔二抗(1:3 000)在37 ℃下处理2 h,再用化学发光液观察蛋白条带。
1.3.4 CCK-8 法检测细胞活力 将传至第3~5 代的Ishikawa细胞接种于96孔板内,转染后各组连续培养24、48、72 h,每孔加入10 µL CCK-8 试剂,37 ℃培养2 h后使用酶标仪在450 nm检测吸光度。
1.3.5 Transwell 小室检测细胞侵袭情况 每个上室的膜用Matrigel(100 µg∕cm2)包被,然后37 ℃孵育过夜以胶凝。转染后Ishikawa 细胞重悬于无血清培养基中,并以3×104细胞∕孔密度接种到上层Transwell 室中。下室加入500 µL 含100 mL∕L FBS的DMEM培养基作为化学诱导剂。温育24 h后,除去未侵袭的细胞,用5 g∕L 的结晶紫对侵袭的细胞进行染色,并于显微镜下计数。
1.3.6 双荧光素酶报告基因验证实验 Targetscan网站预测分析FOXO1 3'UTR 上miR-96-5p 的结合位点。将FOXO1 wt 或FOXO1 mut 质粒分别与mimic NC 或 miR-96-5p mimic使用 Lipofectamine2000 试剂共转染至Ishikawa 细胞。培养48 h后,按照说明书操作测定细胞裂解液中的荧光素酶活性。
1.4 统计学处理
采用Graphpad 6.0 软件进行数据统计和分析。结果表示为平均值±标准差(),采用单因素方差分析数据,进一步两两比较采用LSD 检验;两个分类变量的关联程度分析,先采用χ2检验,再计算miR-96-5p 表达或FOXO1 表达与子宫内膜癌临床病理特征的关联系数φ或Cramér's V。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-96-5p 和FOXO1 在子宫内膜癌组织中的表达
qRT-PCR 和Western blot 检测结果显示,各组FOXO1mRNA 和蛋白表达水平差异有统计学意义(t=23.850,P<0.001;t=33.99,P<0.001;图1),各组miR-96-5p表达水平差异有统计学意义(t=12.550,P<0.001)。与正常组织比较,子宫内膜癌组织中FOXO1mRNA 和蛋白表达量显著下调,miR-96-5p表达量显著上调(P<0.001)。
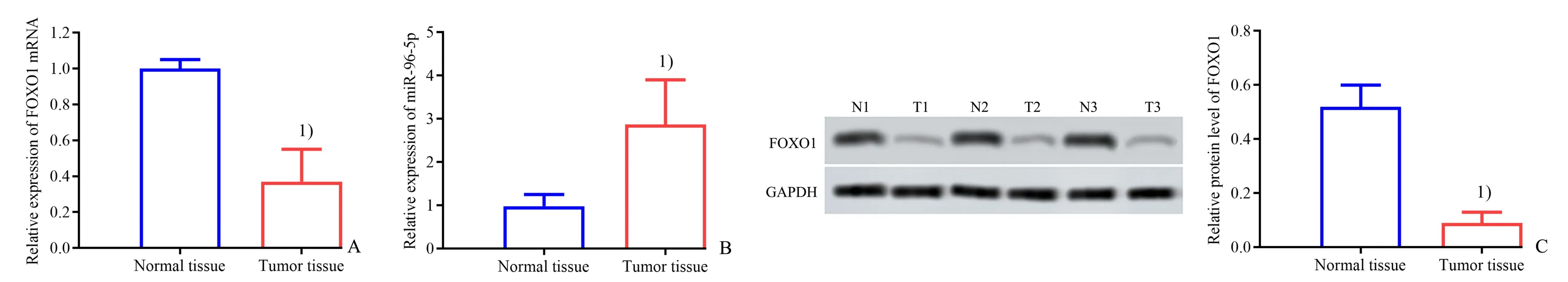
图1 FOXO 1蛋白在子宫内膜癌组织中的表达Fig.1 Expression of FOXO 1 protein in endometrial carcinoma
2.2 miR-96-5p 和FOXO1 表达与子宫内膜癌临床病理特征的关系
子宫内膜癌患者中miR-96-5p 高表达与病理分级和临床分期呈正相关(Cramér's V=0.367,P=0.034;φ=0.362,P=0.010),即随着miR-96-5p 表达升高,病理分级和临床分期等级越高,而与年龄和是否绝经无明显相关性(P=0.370,P=0.166);子宫内膜癌患者中FOXO1 低表达与病理分级和临床分期呈负相关(Cramér's V=0.389,P=0.023;φ=0.384,P=0.007),即随着FOXO1 表达降低,病理分级和临床分期等级越高,与年龄和是否绝经无明显相关性(P=0.344,P=0.144;表1)。
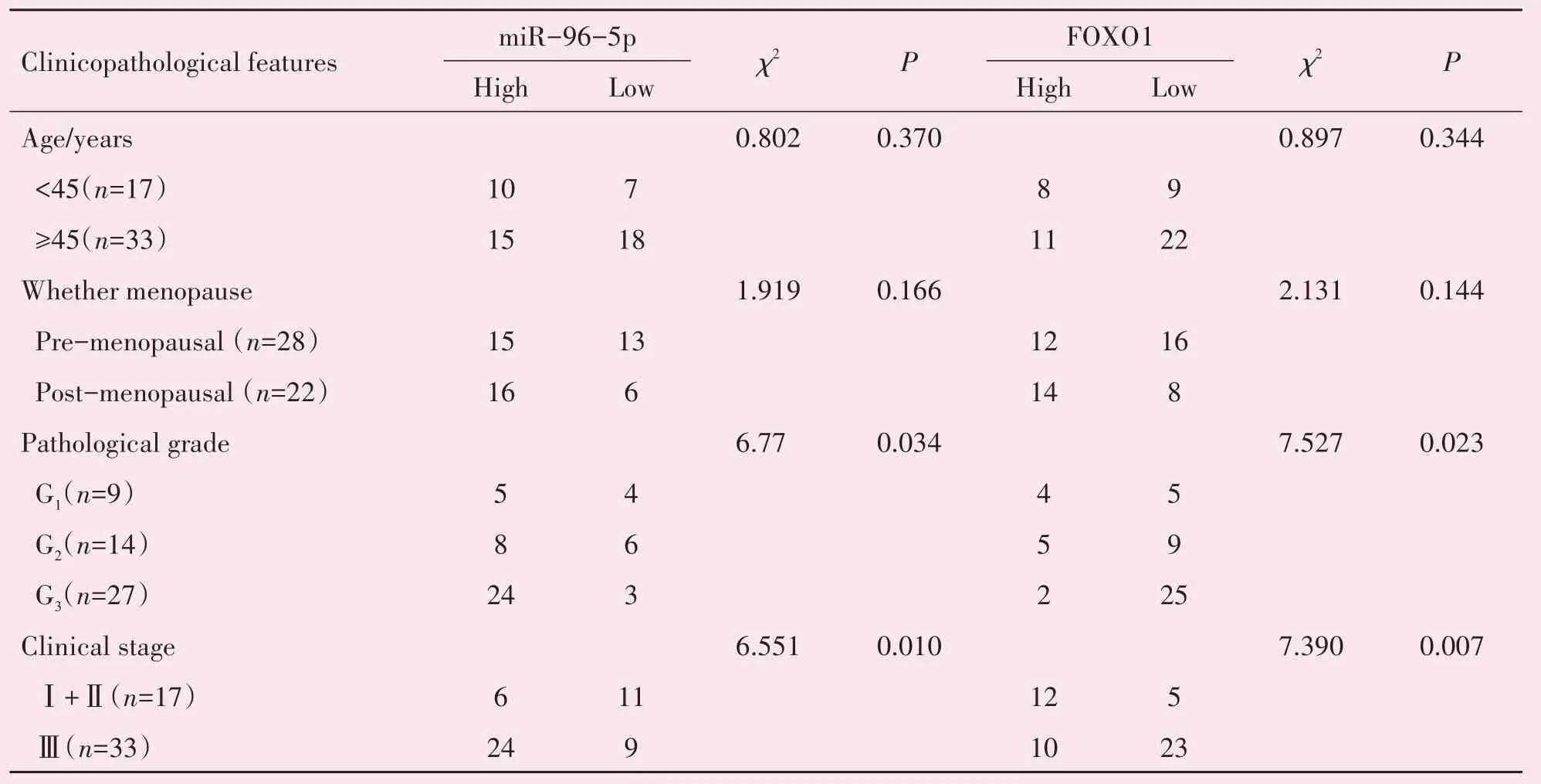
表1 miR-96-5p和FOXO1表达与子宫内膜癌临床病理特征的关系Table 1 Relationship between miR-96-5p and FOXO1 expression and clinicopathological features of endometrial carcinoma
2.3 FOXO1 过表达对子宫内膜癌Ishikawa 细胞存活和侵袭的影响
Western blot 实验结果显示,各组FOXO1 蛋白表达水平差异有统计学意义(F=123.400,P<0.001)。与对照组比较,pcDNA 组FOXO1 蛋白表达量变化无统计学意义(P>0.05),FOXO1 组Ishikawa 细胞中FOXO1 蛋白表达量明显上调(P<0.01;图2A)。CCK-8 结果显示,各组吸光度值在总体差异上均具有统计学意义(F=17.890,P<0.001)。如图2B 所示,与pcDNA 组比较,FOXO1组48 h 和72 h 的细胞活力均明显降低(P<0.05)。Transwell 实验结果表明,2 组侵袭细胞数差异具有统计学意义(t=8.546,P=0.001)。Western blot结果显示,2 组中各蛋白表达水平差异具有统计学意义(cyclin D1:t=7.298,P=0.002;cleaved PARP:t=5.637,P=0.005;p21:t=5.040,P=0.007;Vimentin:t=8.328,P=0.001)。与pcDNA 组相比,FOXO1 组侵袭细胞数目明显减少(P<0.01;图2C),Cyclin D1 和波形蛋白的表达水平明显降低,cleaved PARP 和p21 蛋白表达水平明显升高(P<0.01;图2D)。
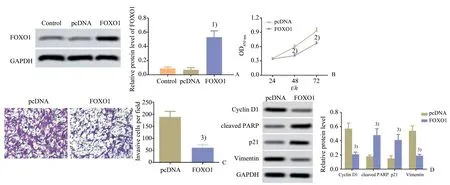
图2 Western blot检测Ishikawa细胞FOXO1蛋白的表达情况Fig.2 Expression of FOXO1 protein of Ishikawa cell detected by Western blot
2.4 抑制miR-96-5p 表达对子宫内膜癌Ishikawa细胞存活和侵袭的影响
qRT-PCR 结果显示,各组miR-96-5p 表达水平差异有统计学意义(F=137.600,P<0.001)。与对照组比较,inhibitor NC 组Ishikawa 细胞中miR-96-5p 表达量变化无统计学差异(P>0.05),miR-96-5p inhibitor 组中miR-96-5p 表达量明显下调(P<0.05;图3A)。CCK-8 结果显示,各组吸光度值在总体差异上均具有统计学意义(F=10.320,P=0.003)。如图3B 所示,与inhibitor NC 组比较,miR-96-5p inhibitor组Ishikawa细胞48 h和72 h的细胞活力明显减弱(P<0.05)。Transwell 实验结果表明,2 组侵袭细胞数差异具有统计学意义(t=12.480,P=0.002)。Western blot 结果显示,2 组中各蛋白表达水平差异具有统计学意义(cyclin D1:t=22.860,P=0.001;cleaved PARP:t=15.760,P=0.003;p21:t=12.280,P=0.002;Vimentin:t=18.070,P=0.001)。与inhibitor NC 组比较,miR-96-5p inhibitor 组侵袭细胞数明显减少(P<0.01,图3C),cyclin D1 和波形蛋白的表达水平明显降低,cleaved PARP 和p21 蛋白表达水平明显升高(P<0.01;图3D)。
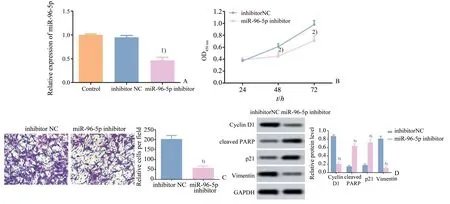
图3 抑制miR-96-5p表达对Ishikawa细胞活力和侵袭的影响Fig.3 Effects of inhibition of miR-96-5p expression on Ishikawa cell viability and invasion
2.5 miR-96-5p靶向负调控FOXO1的表达
Targetscan 预测结果显示,FOXO1 3'UTR 部分序列与miR-96-5p 互补配对(图4A)。荧光素酶报告基因实验结果显示,各组总体差异有统计学意义(F=47.000,P<0.001)。如图4B 所示,与mimic-NC+FOXO1 wt 组比较,转染FOXO1 mut 的细胞荧光素酶活性无明显变化,miR-96-5p+FOXO1 wt 组细胞荧光素酶活性明显降低(P<0.01)。qRT-PCR和Western blot 检测结果显示,各组FOXO1 mRNA和蛋白表达水平差异有统计学意义(F=236.000,P<0.001;F=148.70,P<0.001),各组miR-96-5p表达水平差异有统计学意义(F=241.600,P<0.001)。如图4C-E所示,与mimic NC 组比较,miR-96-5p 组miR-96-5p表达明显上调,FOXO1mRNA和蛋白表达明显下调(P<0.01);与inhibitor NC 组比较,miR-96-5p inhibitor 组miR-96-5p 表达明显下调(P<0.05),FOXO1mRNA 和蛋白表达明显上调(P<0.01)。
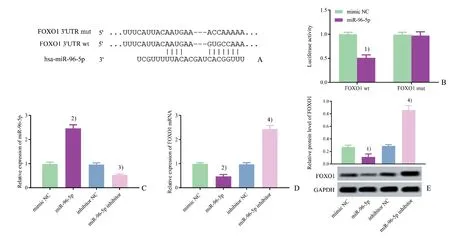
图4 miR-96-5p靶向调控FOXO1的表达Fig.4 miR-96-5p targeted the expression of FOXO1
2.6 miR-96-5p 靶向调控FOXO1 促进Ishikawa细胞的活力和侵袭
CCK-8结果显示,各组吸光度值在总体差异上均具有统计学意义(F=8.126,P<0.001)。与对照组比较,miR-96-5p 组Ishikawa 细胞活力明显升高,与miR-96-5p 组比较,miR-96-5p+FOXO1 组细胞活力明显降低(P<0.05;图5A)。Transwell 实验结果表明,各组侵袭细胞数差异具有统计学意义(F=37.910,P<0.001)。Western blot 结果显示,各组蛋白表达水平差异具有统计学意义(Cyclin D1:F=110.600,P<0.001;cleaved PARP:F=34.200,P<0.001;p21:F=81.120,P<0.001;Vimentin:F=28.660,P=0.001)。如图5B-D 所示,与对照组比较,miR-96-5p 组侵袭细胞数明显增多(P<0.01),cyclin D1 和波形蛋白表达水平明显升高,cleaved PARP 和p21 蛋白水平明显降低(P<0.01),表明细胞凋亡被抑制;与miR-96-5p组比较,miR-96-5p+FOXO1 组侵袭细胞数明显减少(P<0.01),cyclin D1和波形蛋白表达水平明显降低,cleaved PARP和p21蛋白表达水平明显升高(P<0.05,P<0.01),表明细胞凋亡被诱导。

图5 miR-96-5p通过调控FOXO1表达对Ishikawa细胞活力和侵袭的影响Fig.5 Effects of miR-96-5p on Ishikawa cell viability and invasion by regulating FOXO1 expression
3 讨论
由于高复发、高转移、预后差及5 年生存率低,子宫内膜癌的临床治疗已越来越受到关注[3]。叉头蛋白家族成员FOXO1 转录因子是PI3K∕Akt 信号通路调控细胞存活的一个关键底物,在细胞的增殖、发育、凋亡和代谢的过程中发挥重要作用[12]。FOXO1 参与了包括子宫内膜癌在内的等多种癌症的发生发展,与癌症的进展、侵袭与转移密切相关[13-14]。MiR-96-3p 在多种肿瘤中发挥癌基因作用,Qin等[15]研究表明miR-96-5p可通过激活MEK∕ERK 信号传导促进乳腺癌的迁移。Wang等[16]研究表明miR-96-5p 可通过直接靶向FOXF2 促进口腔癌细胞的增殖和侵袭。
本研究结果表明子宫内膜癌组织中miR-96-5p 明显上调,FOXO1 明显下调,且在子宫内膜癌中miR-96-5p 高表达或FOXO1 低表达与肿瘤病理分级和临床分期具有相关性,与患者年龄和是否绝经无明显相关性。抑癌基因p21 通过停滞细胞周期,阻断细胞分裂,有利于基因组的损伤后修复[17]。Cleaved PARP 为Caspase 家族凋亡基因启动子,蛋白表达增加时说明细胞凋亡增加[18]。波形蛋白是间质标志物,在癌症转移等过程中发挥了重要作用[19]。过表达FOXO1 或抑制miR-96-5p 表达均明显抑制Ishikawa细胞的活力、侵袭及Cyclin D1和波形蛋白表达,明显促进cleaved PARP 和p21 蛋白表达,从而诱导细胞凋亡。上述结果揭示miR-96-5p在子宫内膜癌中发挥促癌作用,而FOXO1 起着抑癌作用。
一系列miRNA(miR-9、miR-27、miR-96、miR-153、miR-182、miR-183)明显降低了HEC-1B 细胞中FOXO1 的丰度,并促进子宫内膜的肿瘤发生[20]。此外,miR-135通过下调FOXO1明显刺激了Ishikawa细胞的增殖[21]。本研究结果显示,miR-96-5p直接靶向负调控FOXO1。miR-96-5p 过表达对Ishikawa 细胞活力和侵袭的促进作用可被过表达FOXO1 所逆转。因此,miR-96-5p 通过下调FOXO1 的表达水平在子宫内膜癌中发挥促癌作用。
综上所述,miR-96-5p 在子宫内膜癌中表达上调,FOXO1 表达下调,并与子宫内膜癌的临床分期和病理分级有关。miR-96-5p 通过靶向负调控FOXO1 的表达促进子宫内膜癌细胞的存活和侵袭,表明miR-96-5p可能成为治疗子宫内膜癌的有效靶点。
