扬子鳄源普通变形杆菌FliL基因缺失株的构建及其特性分析
2022-08-11李林俐朱来旭张雪费荣梅
李林俐,朱来旭,张雪,费荣梅*
(1.南京农业大学农业农村部动物细菌学重点实验室,江苏 南京 210095;2.深圳海关,广东 深圳518026)
扬子鳄(Alligatorsinensis)为我国一级重点保护野生动物,被《世界自然保护联盟》(IUCN)的红色名录列为极度濒危物种。自1987年我国开始扬子鳄的人工饲养繁育,现已经取得巨大成功。近年来,由于种群密度增大、遗传进化等原因,扬子鳄疾病时有发生。对越冬期间人工养殖条件下的发病扬子鳄取样检测,均发现有尿酸盐沉积、肾病等症状,从发病的扬子鳄体内分离到多株普通变形杆菌,且该变形杆菌与人工养殖扬子鳄的发病不无关联[1]。
变形杆菌(Proteus)为革兰阴性条件致病菌,属于肠杆菌科变形杆菌属,广泛存在于动物肠道、土壤和养殖水体等环境中[2]。近年来,关于该菌属细菌引起的人食物中毒及动物细菌性疾病的案例多有报道,如对虾、中华鳖、石斑鱼等[3-8]。变形杆菌的FliL、ZapA、HpmA、HpmB、RpoA等毒力因子均可在不同毒性扬子鳄源普通变形杆菌菌株中检测到,但并未发现这些毒力因子与菌株毒力强弱的线性关系[9]。变形杆菌可分化为2种细胞形态:在液体环境中的短杆状的泳动细胞(swimmer cell)长度1.5~2.0 μm,每个细菌有4~10根鞭毛[10];在黏性环境中的群集细胞(swarmer cell)中,长度10~80 μm,其胞质内有多个均匀间隔的类核,每个小区由数百或数千鞭毛推动[11-13],这些细胞沿该细胞体长轴紧密排列形成1个群体,可在鞭毛的推动下,快速迁移运动[14]。群集细胞的细胞质内有多个均匀间隔的小区,每个小区由数百或数千鞭毛推动,群集细胞可独特地适应宿主细胞表面环境,是调节几种重要致病因子的关键。在奇异变形杆菌中有超过50种基因参与群集细胞的分化[15]。细菌的周期性群集运动(swarming motility,SM)是指运动细菌以群体方式在培养基表面由接种点向周围进行的依赖鞭毛的迁移运动。对变形杆菌的进一步研究表明,其分化能力和SM均与其致病性紧密相关[16]。FliL基因是鞭毛操纵子中的第一个基因,其编码蛋白是一种单跨膜蛋白,由160个氨基酸组成的小蛋白质(相对分子质量:18 000),位于Mot蛋白附近,可与位于细胞质膜上方的MS(membrane/supramembrane)环相互作用,可在高负荷条件下(如高黏性环境中)对加强鞭毛马达功能起重要作用[17-18]。
鉴于细菌鞭毛与细菌的致病性和趋利避害的化学趋向性运动紧密相关,为探究FliL基因对扬子鳄源普通变形杆菌生物学特性的影响,本试验通过Red重组系统对扬子鳄源普通变形杆菌进行FliL基因敲除,构建FliL基因缺失株和互补株,通过比较野生株与FliL基因缺失株在细菌运动性和对小鼠致病性上的差异,来探究FliL基因在扬子鳄源普通变形杆菌中的作用,为研究人工养殖扬子鳄痛风症的致病机制提供理论支持,也为人工养殖扬子鳄的疾病防控提供基础依据。
1 材料与方法
1.1 菌株、引物和质粒
扬子鳄源普通变形杆菌XX2株由笔者所在实验室分离、纯化和保存,于2012—2013年分离于安徽省宣城扬子鳄繁殖研究中心发病扬子鳄。根据GenBank已公布的变形杆菌HI4320(NC_010554.1)的FliL基因序列,使用Primer Premier 5.0设计特异性引物。引物由苏州金唯智生物科技有限公司合成(表1)。质粒pKD4、pKD46、pCP20、pGEN-MCS均由笔者所在实验室保存。

表1 本试验所用的引物序列Table 1 Primers sequences in this study
1.2 主要试剂
1.3 FliL同源重组片段(打靶片段)的扩增
以pKD4质粒(2边带有FRT位点和Kanr基因)为模板,利用引物对C-FliL-F/R扩增打靶片段,目的片段为1 647 bp。50 μL PCR反应体系:2×FastTaqPCR Master Mix 25 μL,上、下游引物(10 mol·L-1)各 1 μL,菌液模板2 μL,ddH2O 21 μL。反应条件:95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 90 s,共29个循环;72 ℃ 10 min。PCR产物于10 g·L-1琼脂糖凝胶中进行电泳分析。
1.4 重组菌XX2/pKD46的制备
将XX2菌液按照1∶100(体积比)转接LB培养基,置于37 ℃培养箱中培养至对数期,冰浴20 min,5 000 r·min-1离心10 min,收集菌体,先用ddH2O充分洗涤2次,再用10%灭菌甘油洗涤2次,最后用10%灭菌甘油以1∶100重悬细胞,制成XX2感受态细胞。
将pKD46质粒(带有Ampr基因)电击转化XX2感受态细胞。电击参数:电压2.25 kV,电阻200 Ω,电容 25 μF。电击后加入30 ℃预热的LB液体培养基,30 ℃、100 r⋅min-1振荡培养约1 h后,取100 μL涂布于含50 μg·mL-1Amp的抗性LB平板,30 ℃培养2~3 h后筛选阳性克隆。
1.5 XX2/pKD46感受态细胞的制备及电转化
将筛选好的XX2/pKD46重组菌按照1∶100转接到LB液体培养基,置于37 ℃培养箱中培养至对数期,按照1∶100加入L-阿拉伯糖诱导1 h,再按照1.4节方法制备电转化感受态细胞,利用电转化法导入打靶片段,进行重组替换,依次用含有Kan和Amp的平板筛选出对Amp敏感且有Kan抗性的重组菌XX2ΔFliL∶∶Kan。用FliL基因鉴定引物对R-FliL-F/R对FliL基因进行PCR验证。50 μL PCR反应体系:2×FastTaqPCR Master Mix 25 μL,上、下游引物(10 mol·L-1)各1 μL,菌液模板2 μL,ddH2O 21 μL。反应条件:95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 90 s,共29个循环;72 ℃ 10 min。PCR产物于10 g·L-1琼脂糖凝胶中进行电泳分析。
用卡那抗性基因同源臂鉴定引物对E-FliL-F/R对重组菌株进行PCR鉴定。50 μL PCR反应体系:2×FastTaqPCR Master Mix 25 μL,上、下游引物(10 mol·L-1)各1 μL,菌液模板2 μL,ddH2O 21 μL。反应条件:95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 90 s,共29个循环;72 ℃ 10 min。PCR产物于10 g·L-1琼脂糖凝胶中进行电泳分析。
1.6 XX2ΔFliL∶∶Kan菌株Kan抗性的消除
将pCP20质粒(温敏性质粒)电击转化XX2ΔFliL∶∶Kan菌株以消除其Kanr基因,37 ℃培养过夜。先将菌液接种普通LB平板,再挑单菌落接种含有Kan的LB平板,挑选出不能在含Kan的LB平板上生长的单菌落。最后于42 ℃培养消除pCP20质粒,获得普通变形杆菌XX2FliL基因缺失株XX2ΔFliL。
1.7 缺失互补株的构建
以XX2菌株的基因组DNA为模板,用引物对MCS-F/R扩增FliL基因。50 μL PCR反应体系:2×FastTaqPCR Master Mix 25 μL,上、下游引物(10 mol·L-1)各1 μL,菌液模板2 μL,ddH2O 21 μL。反应条件:95 ℃ 5 min;95 ℃ 45 s,60 ℃ 45 s,72 ℃ 90 s,共29个循环;72 ℃ 10 min。PCR产物于10 g·L-1琼脂糖凝胶中进行电泳分析。
将该片段克隆至转移载体pGEN-MCS(转移质粒),获得互补质粒pGEN-MCS-FliL。质粒经上海生工生物工程技术有限公司测序验证后,再按照1.4节方法制备电转化XX2ΔFliL感受态细胞,将互补质粒转化XX2ΔFliL感受态细胞,用含有Amp的LB平板进行筛选,PCR验证后获得互补株XX2ΔFliL/pFliL。
你们看不起我。我说着,从裤兜里掏出一把小刀,刺啦一下划破自己的手臂,血像一条红色的蚯蚓,翻滚着掉在地上。我今天以血为誓,咱走着瞧,非混出个样子来给你们看看,这瞎巴大学,我不读,照样出人头地。我骂完这一句,咣当一声甩开门,出了宿舍。
1.8 生长曲线的绘制
将培养过夜的XX2株、XX2ΔFliL株和XX2ΔFliL/pFliL株分别以1∶100的体积比接种至100 mL LB液体培养基,37 ℃振荡培养,每隔30 min取样1次,共取样24次,测定不同时期菌液D600值,使用软件Graphpad Prism 8.0绘制生长曲线。
1.9 细菌群集运动和细菌动力试验
挑取XX2株和XX2ΔFliL株单菌落于1 mL LB液体培养基中,37 ℃培养过夜。在Mot半固体琼脂(3 g·L-1琼脂)培养基和LB固体琼脂培养基中心点接种过夜培养物。通过分时段测量细菌在LB固体琼脂培养基表面的迁移距离和迁移速度来测定细菌的群集运动。通过分时段测量细菌在Mot半固体琼脂培养基表面的迁移距离和迁移速度来判断细菌动力,再将过夜培养的菌液以1∶100稀释后接种于新鲜LB液体培养基中,37 ℃、200 r·min-1培养2.75 h(此时菌株可产生最多的假性群集细胞[15]),将培养物涂布于LB固体琼脂培养基,37 ℃培养4.5 h。显微镜观察前用2 mL PBS冲洗LB琼脂表面。
1.10 菌株致病性的测定
分别将XX2株和XX2ΔFliL株的LB培养物以1∶100接种THB液体培养基,37 ℃培养8 h。用生理盐水稀释菌液并配制成1×104、1×105、1×106、1×107和1×108CFU·mL-1的菌液。取清洁级雄性小鼠40只,随机分为2大组,每大组又随机分为5小组,每小组4只小鼠。每组分别腹腔注射不同浓度稀释菌液0.2 mL。饲养、观察并记录小鼠的死亡情况。
2 结果与分析
2.1 FliL基因缺失株的PCR鉴定
以pKD4为模板扩增FliL基因上、下游同源臂及Kan抗性基因所得的同源重组片段,PCR产物大小与目标片段1 647 bp大小相符(图1-A)。将同源重组片段电转化至XX2感受态细胞后,FliL基因与同源片段进行重组,再利用重组菌株带有Kan抗性的特点对获得菌株进行初步筛选,得到疑似FliL基因缺失的菌株。因为FliL编码基因全序列短于同源臂DNA片段长度,用引物对C-FliL-F/R进一步进行PCR鉴定,筛选出FliL基因缺失株(如图1-B所示),缺失阴性株能够检测到目标FliL基因770 bp大小的条带。再用E-FliL-F/R与R-FliL-F/R引物对进行PCR鉴定,结果如图1-C所示。

图1 FliL基因缺失株的PCR鉴定Fig.1 PCR identification of FliL gene fragment deletion strain A. 引物对C-FliL-F/R扩增同源重组片段(M. DNA标准品;1、2. 同源重组片段);B. 引物对R-FliL-F/R对重组菌株的鉴定(M. DNA标准品;1. FliL基因缺失株;2. 缺失对照);C. 引物对E-FliL-F/R对重组菌株的鉴定(M. DNA标准品;1~10. Kan抗性阳性株;11. Kan抗性阴性株;12. 空白对照)。A. The peimer pairs C-FliL-F/R amplified homologous recombination fragment(M. DNA Marker;1,2. Homologous recombination fragment).B. The peimer pairs C-FliL-F/R identified the recombinant strains(M. DNA Marker;1. XX2ΔFliL strain;2. Deletion control). C. The peimer pairs E-FliL-F/R identified the recombinant strains(M. DNA Marker;1-10. Kanr positive strain;11. Kanr negative strain;12. Blank control).
2.2 XX2ΔFliL/pFliL互补株的鉴定
互补质粒pGEN-MCS-FliL电转化至XX2ΔFliL感受态后,经含有Amp的LB平板筛选挑取疑似菌落进行PCR验证,PCR产物经10 g·L-1琼脂糖凝胶电泳。结果(图2)显示,有与预期大小相符的2 784 bp特异性条带,表明互补质粒pGEN-MCS-FliL成功转入XX2ΔFliL菌株,获得互补株XX2ΔFliL/pFliL。
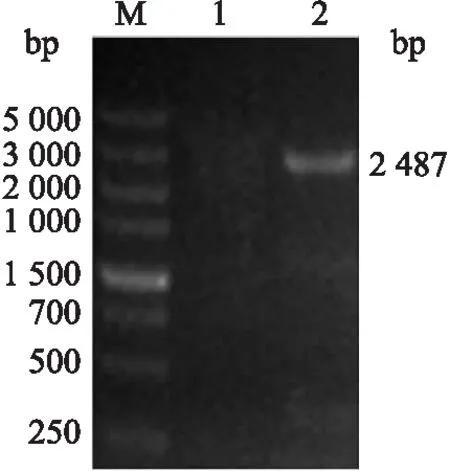
图2 互补株XX2ΔFliL/pFliL的PCR鉴定Fig.2 PCR identification of complementary strains of XX2ΔFliL/pFliL M. DL5000 DNA标准品;1:互补株阴性;2. 互补株阳性。M. DL5000 DNA marker;1. Complementary strain of negative;2. Complementary strain of postivite.
2.3 生长速度测定
如图3所示:XX2株、XX2ΔFliL株和XX2ΔFliL/pFliL株的生长速度在接种后的前5 h没有明显区别(X2=4.134×10-3,P>0.05),5 h后野生株XX2的生长速度均快于FliL基因缺失株XX2ΔFliL和互补株XX2ΔFliL/pFliL,而互补株XX2ΔFliL/pFliL的生长速度快于FliL基因缺失株XX2ΔFliL。

图3 XX2株、XX2ΔFliL株和XX2ΔFliL/pFliL株的生长曲线Fig.3 The growth curve of XX2、XX2ΔFliL and XX2ΔFliL/pFliL strains

图4 细菌在LB固体琼脂培养基(A)和Mot半固体琼脂培养基(B)上的运动情况Fig.4 The movement of bacteria on LB solid agar medium(A)and Mot semi-solid agar medium(B)
2.4 细菌群集运动和细菌动力试验
XX2株和XX2ΔFliL株过夜培养物接种Mot半固体琼脂培养基和LB固体琼脂培养基,观察细菌群集细胞的迁移运动,如图4所示。分时段测量并记录XX2株和XX2ΔFliL株在LB固体琼脂培养基和Mot半固体琼脂培养基上迁移距离与迁移速度。如图5所示,在LB固体琼脂培养基表面XX2ΔFliL株的迁移距离远低于XX2株,迁移速度低于XX2株。在Mot半固体琼脂培养基上XX2ΔFliL株的迁移距离略低于XX2株,其迁移速度也没有显著差异(X2=3.649,P>0.05)。
将稀释后的过夜培养物接种新鲜LB液体培养基,取37 ℃、200 r·min-1培养2.75 h后的假性群集细胞培养物涂布LB固体琼脂培养基,37 ℃培养4.5 h后在光学显微镜下观察。如图6所示:视野可见野生株在培养基表面细胞体长轴上紧密排列形成一个群体,而FliL基因缺失株则为单细胞状态。
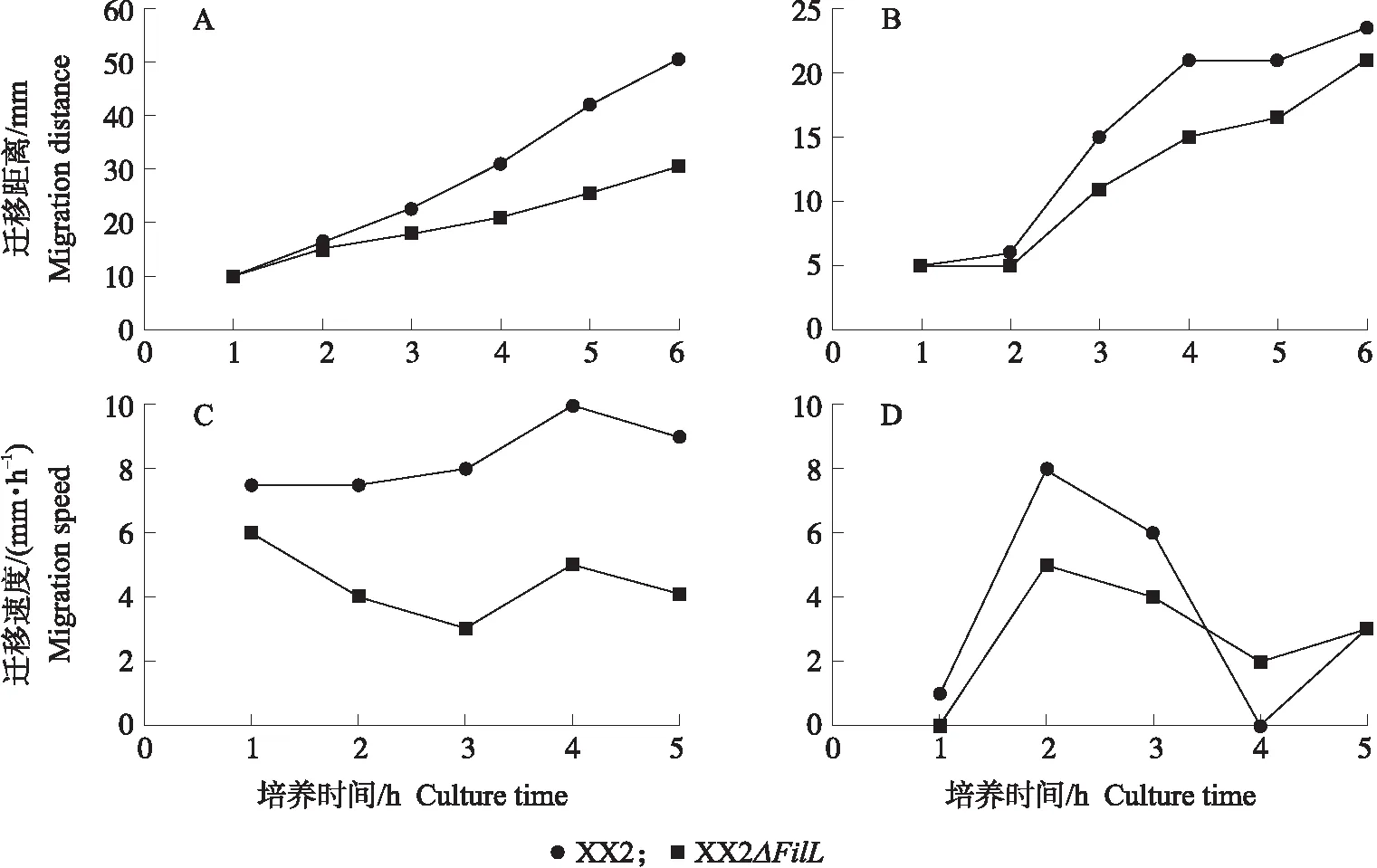
图5 细菌在LB固体培养基(A、C)和Mot半固体培养基(B、D)上的迁移情况Fig.5 The migration of bacteria on LB solid medium(A,C)and Mot semi-solid medium(B,D)
2.5 XX2株和XX2ΔFliL株小鼠致病性试验
小鼠致病性试验结果显示,XX2株对小鼠的LD50为2.3×106CFU·mL-1,致病力强XX2ΔFliL株对小鼠的LD50为4.9×108CFU·mL-1,FliL基因缺失株LD50升高了约100倍,致病力弱。表明FliL基因的缺失会导致扬子鳄源普通变形杆菌毒力的下降。
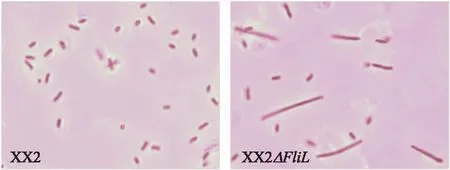
图6 细菌在LB培养液中培养4.5 h后的形态Fig.6 The morphology of bacteria after culturing in LB medium for 4.5 h

表2 XX2株和XX2ΔFliL株对小鼠的半数致死量(LD50)
3 讨论
变形杆菌为革兰阴性菌,具鞭毛、无荚膜、无芽胞,在固体培养基上呈扩散生长,可形成迁移生长现象[19]。鞭毛作为细菌运动最常见的细胞器之一,是由细胞表面突出的丝状螺旋桨结构和嵌入细胞膜的旋转马达组成。FliL基因是变形杆菌中的1个重要毒力因子,同时也是鞭毛操纵子中的第1个基因,其编码的单跨膜蛋白可与位于细胞质膜上的MS环相互作用,在高负荷条件下(如高黏性环境中)起到加强鞭毛马达功能的作用[17-18]。
本试验利用Red重组系统对扬子鳄源普通变形杆菌的FliL基因进行敲除,成功构建FliL基因缺失株和互补株。细菌生长曲线结果显示:接种5 h后FliL基因缺失株生长速度慢于野生株,说明FliL基因的缺失确实会影响扬子鳄源普通变形杆菌的增殖,但其机制仍有待进一步研究。有研究表明,FliL基因缺陷会导致特异性表型的变化,如在螺旋体中,曾观察到FliL基因突变体在运动性上具有缺陷,并伴随周质鞭毛方向的逆转[20]。在α-杆菌属物种中,FliL基因无效突变可导致非运动表型[21]或鞭毛的释放[22]。在肠道细菌如大肠杆菌、鼠伤寒沙门菌和奇异变形杆菌中,FliL基因的缺失并不影响其泳动运动,但在群集运动中具有明显的缺陷[23],在本试验中该现象同样得到证实。本试验细菌群集运动和动力试验结果显示:在LB固体琼脂培养基表面FliL基因缺失株的迁移距离远低于野生株,其迁移速度也低于野生株,说明FliL基因缺失株的群集运动明显下降,表明FliL基因对普通变形杆菌的群集运动是必不可少的。而在Mot半固体琼脂培养基上FliL基因缺失株的迁移距离虽略低于野生株,但是迁移速度并没有明显不同,表明FliL基因仅在一定程度上影响了细菌的运动能力。
群集细胞可独特地适应生命体组织器官的表面环境[24-26],其感知和响应宿主细胞表面环境的能力是调节几种重要致病因子的关键[27-28]。群集细胞的分化除了可使细菌进行鞭毛依赖的群集运动外,还可产生其他毒力因子如尿素酶、溶血酶和蛋白酶等,可协助细菌在膀胱和肾脏器官的定殖与感染[29]。除了作为运动器官外,鞭毛也与细菌致病力紧密相关,鞭毛及其运动性可促进细菌对宿主细胞的黏附与侵袭,参与大分子蛋白质的转运,在细菌生物被膜形成过程中起重要作用,并且鞭毛与细菌毒力因子的分泌也密切相关。本试验FliL基因缺失株LD50升高了约100倍,为低致病力菌株,表明FliL基因与细菌毒力紧密相关,FliL基因缺失可降低扬子鳄源普通变形杆菌的毒力。
综上所述,本试验结果明确了FliL基因对普通变形杆菌群集运动是必不可少,并在一定程度上影响了细菌的运动能力,FliL基因缺失株与野生株的LD50相差约100倍,表明FliL基因的缺失会影响普通变形杆菌的毒力,为进一步研究扬子鳄源变形杆菌对扬子鳄痛风等疾病奠定基础。
