氮、磷污染水体中荷花的生态效应和生理响应
2022-08-11常宝亮周浩民上官凌飞汪锡文王彦杰金奇江徐迎春
常宝亮,周浩民,上官凌飞,,汪锡文,王彦杰,金奇江,徐迎春*
(1.南京农业大学园艺学院/农业农村部景观设计重点实验室,江苏 南京 210095;2.安徽芜湖东源新农村开发股份有限公司企业博士后工作站,安徽 芜湖 241399)
近几十年来,随着人类对环境资源开发和不合理的利用,大量氮、磷营养物质排入河流、湖泊,水环境迅速恶化,富营养化程度不断加重并危害到生活用水和工业用水供给[1]。水体内源污染还是水体富营养化的重要原因[2]。我国的主要河流湖泊底泥污染严重,外源污染一部分会沉降到表层沉积物中造成污染隐患[3-4],因此,水体富营养化问题日益严峻。治理和修复富营养化水体主要有物理、化学、生物等方法。与其他水体净化措施相比,以水生植物为主体的生物治理法,具有投资、维护和运行费用低,观赏价值高,管理方便,生态效益良好等特点[5]。因此,该方法已成为当前研究热点之一[6]。
荷花(Nelumbonucifera)为我国十大传统名花中唯一的水生花卉,对富营养化水体具有较好的净化效果[7]。近年来,人们开始强化水生植物景观营造与可持续利用的研究,不再局限于单一的污染治理,而是根据实际情况进行植物选择与景观生态修复。目前对于荷花净化富营养化水体的研究大多集中在不同荷花品种对富营养化水体净化效果的差异性[8-9]、荷花原位修复富营养化水体[10]、荷花净化效果的季节性差异[11]等方面,研究内容主要关注的是荷花对富营养水体与底泥中氮、磷的去除效果[12]。然而,在应用中不仅要关注荷花的净化效果,还要探明荷花在富营养化水体中的生长和生理响应情况,以营造良好的景观效果及达到可持续利用的目的。实际污染程度较高水体中,荷花是否为适合应用的水生观赏植物,还尚未明确。
本研究以荷花品种‘红巨子’为研究对象,通过人工配制模拟不同富营养化程度污水,分析荷花对不同浓度富营养化水体及底泥中氮、磷的吸收情况,结合荷花开花情况、叶片形态及叶绿素含量、叶片氮、磷含量,并检测荷花丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)活性变化,探究荷花对不同程度富营养化水体、底泥的净化能力及生理响应情况,旨在为利用荷花治理富营养化水体提供借鉴与参考。
1 材料与方法
1.1 材料
供试荷花品种为‘红巨子’,种藕由南京艺莲苑花卉有限公司提供。挑选生长健壮、大小基本一致的种藕(长约20 cm,直径约5 cm)种植,所用花盆为380 mm标准口径塑料无孔花盆。待生长出第1片立叶后,挑选生长状态一致的荷花幼苗作为试验材料。
1.2 方法
1.2.1 试验处理和处理方法试验于2018年7月1日开始,试验场地为南京农业大学白马基地遮雨棚内(北纬31°61′和东经119°18′)。参考国家地表水质量标准和相关文献[13-16],采用KNO3、NH4Cl、KH2PO4并参考改良过的Hoagland营养液配方,以蒸馏水配制试验用水。设置高[HC,总氮(TN):30 mg·L-1;总磷(TP):3 mg·L-1]、中(MC,TN:20 mg·L-1;TP:2 mg·L-1)和低(LC,TN:10 mg·L-1;TP:1 mg·L-1)3种不同氮、磷浓度水平的富营养水体。以自来水正常培养荷花为对照组(CK0,TN:0.67 mg·L-1;TP:0.02 mg·L-1),高、中、低3种氮、磷浓度富营养化水体无荷花种植对照分别为CK1、CK2、CK3。每盆加入15 L相关处理用水,10 kg基地种植池底泥(TN:1.54 g·kg-1;TP:0.16 g·kg-1),每个处理设5盆重复。试验用水中硝态氮与铵态氮的质量比为1∶1。每隔3 d,添加蒸馏水以补充损耗。每隔7 d,采集各组水样、底泥、植物叶片,用于相关指标的测定。
1.2.2 测定指标及方法采用碱性过硫酸钾消解-紫外分光光度计法测定水体总氮浓度;采用钼酸铵分光光度计法测定水体总磷浓度[17]。采用硫酸-过氧化氢消解,连续流动分析法测定植物叶片总氮含量[18];采用微波消解仪进行消解,电感耦合等离子体发射光谱仪(ICP)测定植物叶片总磷含量。采用凯氏定氮法测定底泥总氮含量;采用氢氧化钠熔融-钼锑抗比色法测定底泥总磷含量。采用姚睿等[16]的方法测定植物叶片各项生理指标。采用95%乙醇浸提法测定植物体叶绿素含量;采用硫代巴比妥酸法测定丙二醛(MDA)含量;采用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性;采用愈创木酚法测定过氧化物酶(POD)的活性。
1.3 数据处理
采用Excel 2016软件进行数据处理;采用GraphPad 8.0.2软件绘制图表;采用SPSS 26.0软件对试验数据进行单因素方差分析。
2 结果与分析
2.1 不同氮、磷浓度下荷花生长情况及叶绿素含量变化
由图1和表1可见:与对照组相比,处理组的荷花开花数量、叶面积均增加,且花期明显提前。处理组的荷花叶片浓绿程度均高于对照组,且低浓度处理组荷花生长情况最好,叶片浓绿程度最高。处理组荷花叶片中叶绿素含量明显增加,低浓度处理组荷花叶片的叶绿素含量在处理7 d后急剧上升至22.86 mg·L-1,并与中、高浓度处理组间存在显著性差异(图2)。试验期间,对照组(CK0)荷花叶片的叶绿素含量为12.89~14.15 mg·L-1。3个氮、磷浓度处理组荷花叶片的叶绿素含量在处理7 d后均显著升高,之后缓慢降低,中、高浓度处理组在21 d达到最低值,之后开始回升,至试验结束时仍高于对照组。至试验结束时(35 d),3个氮、磷浓度处理组荷花叶片的叶绿素含量达到同一水平且显著高于对照组(CK0)。

图1 各试验组荷花叶片状态(7 d)Fig.1 The leaves status of Nelumbo nucifera in each experiment group(7 d) CK0:正常培养(对照组);HC:高浓度处理组[总氮(TN):30 mg·L-1;总磷(TP):3 mg·L-1];MC:中浓度处理组(TN:20 mg·L-1;TP:2 mg·L-1);LC:低浓度处理组(TN:10 mg·L-1;TP:1 mg·L-1)。下同。CK0:Normal culture(control group);HC:High concentration treatment group[total nitrogen(TN):30 mg·L-1;total phosphorus(TP):3 mg·L-1];MC:Medium concentration treatment group(TN:20 mg·L-1;TP:2 mg·L-1);LC:Low concentration treatment group(TN:10 mg·L-1;TP:1 mg·L-1). The same as follows.

图2 不同氮、磷浓度下荷花叶片叶绿素含量变化Fig.2 Changes of chlorophyll content in N. nucifera leaves treated with different nitrogen and phosphorus concentrations

表1 不同氮、磷浓度下荷花生长与开花状况
2.2 荷花对污染水体中总氮(TN)、总磷(TP)的净化效果
由图3可知:试验期间,随着处理时间的延长,不同氮、磷浓度处理组水体中的TN浓度不断下降,荷花对水体TN的去除率上升,且远高于各自浓度对照组。处理7 d内,低浓度处理组荷花对水体TN的净化效率较高,而后趋于平缓。中和高浓度处理组荷花净化水体TN的净化效率较为稳定,并保持在较高水平。处理35 d时,高、中和低浓度处理组荷花对水体TN浓度去除率分别达到79.49%、73.95%和57.34%。由此可见,荷花能够吸收水体中过量的氮素,具备在不同污染程度富营养化水体中净化TN的能力。
试验期间,不同浓度处理组水体TP浓度不断下降,荷花对水体TP的去除率上升,且均远高于各自对照组,说明荷花能够吸收水体中过量的磷素,具备净化富营养化水体TP的能力。随着处理时间的延长,不同浓度处理组荷花对水体TP的去除效率逐渐降低。处理21 d后,低、中浓度处理组水体TP浓度较为稳定,变化较小。处理35 d时,高、中和低浓度富营养化处理组中荷花对水体TP浓度去除率分别达到83.69%、89.99%和84.75%。由此可见,荷花对于不同浓度富营养化水体TP均具有较好的净化效果。
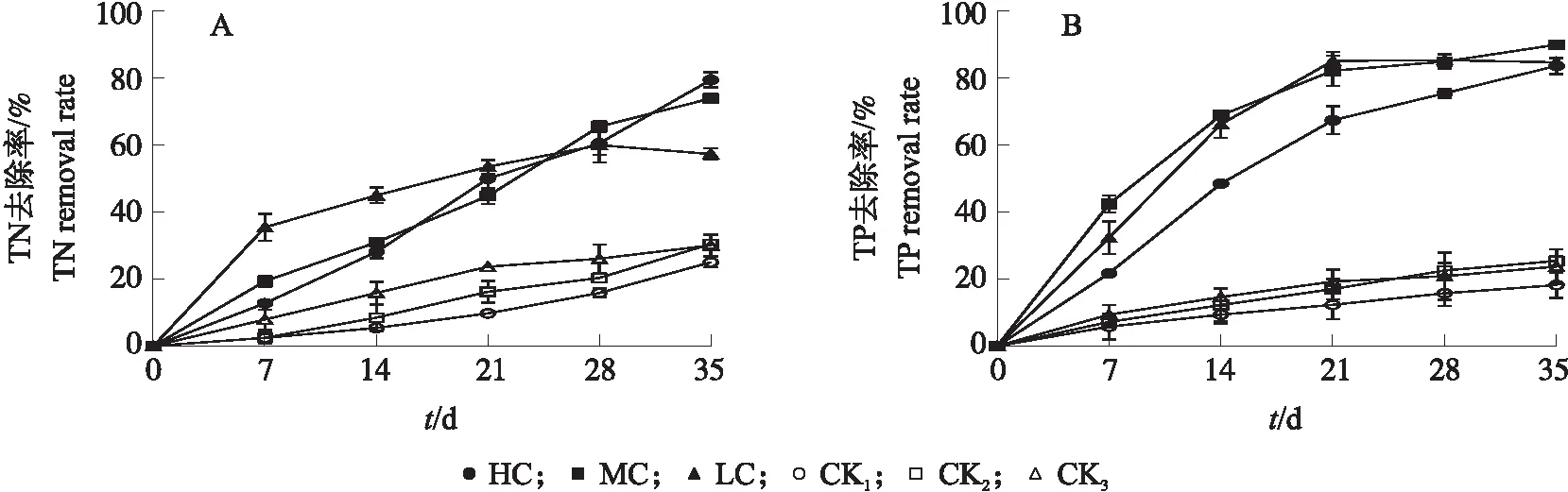
图3 不同氮、磷浓度下荷花对污染水体总氮(TN,A)和总磷(TP,B)的去除率Fig.3 The removal rate of total nitrogen(TN,A)and total phosphorus(TP,B)in polluted water of N. nucifera at different nitrogen and phosphorus concentrationsCK1、CK2、CK3分别为高、中、低浓度富营养化水体无荷花种植的对照。下同。CK1,CK2,CK3 are no lotus culture control from low,medium and high concentrations of eutrophic water bodies,respectively. The same as follows.
2.3 不同氮、磷浓度下荷花对底泥中TN、TP的净化能力
由图4可知:试验期间,高、中浓度处理组底泥TN含量不断下降。处理14 d后,3个浓度处理组底泥TN去除率明显高于对照组,说明试验14 d后荷花对底泥TN具有较好的吸收效果。处理21 d,低浓度处理组底泥TN去除率为40.97%,然后趋于平缓。处理35 d时,高、中和低浓度处理组底泥TN去除率分别达到33.51%、32.37%和41.36%。由此可见,荷花对富营养化处理组底泥中的TN具有一定的吸收效果。试验期间,不同浓度处理组底泥TP含量不断下降,处理35 d时高、中和低浓度处理组底泥TP去除率分别达到77.72%、80.01%和59.19%。处理14 d,高浓度处理组底泥TP去除率与对照组无明显差异,说明试验14 d内高浓度处理组荷花对底泥TP吸收效果较弱。处理21 d后,3个浓度处理组底泥TP去除率明显高于对照组,说明荷花对不同浓度富营养化处理组底泥中的TP具有较好的吸收效果。由此可见,荷花对富营养化处理组底泥中的TP具备较好的吸收效果。整体来看,处理21 d后,荷花对中、低浓度处理组底泥中TP的去除率趋于平缓。高浓度处理组荷花对底泥TP去除率试验期间持续上升。表明荷花对不同浓度富营养化处理组底泥中TN去除率较低,但对TP去除率较高,均大于56%。

图4 不同氮、磷浓度下荷花对底泥TN(A)和TP(B)的去除率Fig.4 TN(A)and TP(B)removal rate in sediment of N. nucifera at different nitrogen and phosphorus concentrations
2.4 不同氮、磷浓度下荷花叶片TN、TP含量的变化
由表2可见:试验期间,对照组荷花叶片中TN含量随时间呈不断下降趋势。处理7 d后,处理组荷花叶片TN含量显著高于对照组(P<0.05),说明荷花在富营养化水体中生长,其叶片的TN含量得到明显提升,此后维持在较高水平。处理14 d后,不同处理组荷花叶片TN含量无显著差异(P>0.05)。试验期间,对照组荷花叶片TP含量随时间呈不断下降趋势。处理0~21 d期间,不同处理组荷花叶片TP含量变化较大。处理14 d后,处理组荷花叶片TP含量显著高于对照组,说明荷花在富营养化水体中生长,其叶片的TP含量得到明显提高。处理21 d后,不同氮、磷浓度水体中荷花叶片TP含量间无显著差异。
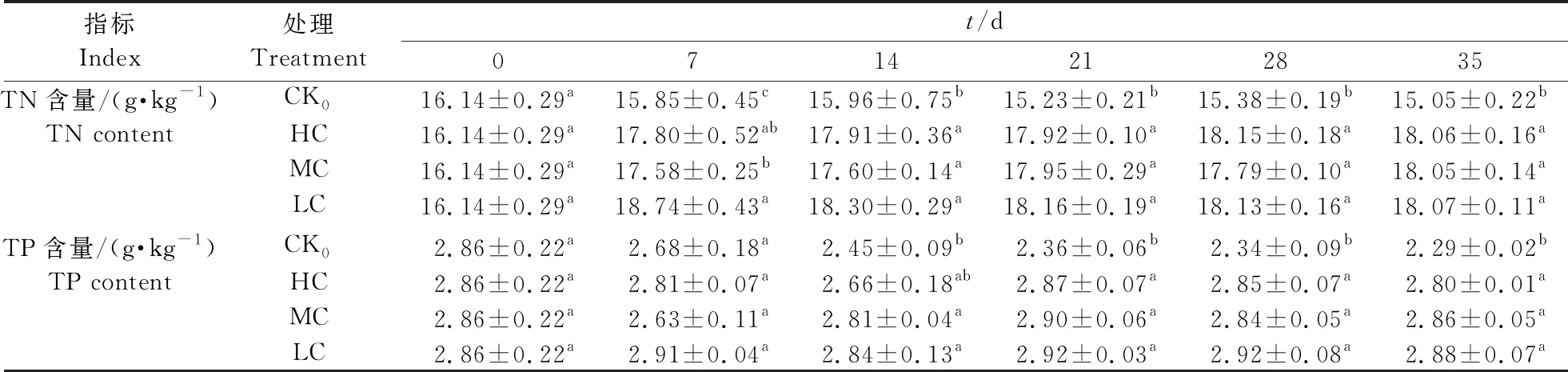
表2 不同氮、磷浓度下荷花叶片TN和TP含量的变化Table 2 Changes of TN and TP contents in N. nucifera leaves treated with different nitrogen and phosphorus concentrations
综上,不同氮、磷浓度水体中荷花叶片氮、磷含量与对照组相比均有明显提高,但不同氮、磷浓度处理组间差异不显著。3种氮、磷浓度水体中,低浓度处理组荷花叶片氮、磷含量较高,说明低浓度处理组对荷花叶片积累氮、磷起到了更为积极的促进作用。
2.5 荷花叶片丙二醛(MDA)含量及抗氧化酶活性变化
由图5可见:处理14 d后,高、中浓度处理组荷花叶片MDA含量显著高于低浓度处理组及对照组。中、高浓度处理组叶片MDA含量无显著差异。处理14 d后,对照组与低浓度处理组叶片MDA含量无显著差异,说明低浓度处理组的荷花叶片MDA含量没有明显变化,与对照较为一致,且显著低于中、高浓度处理组。
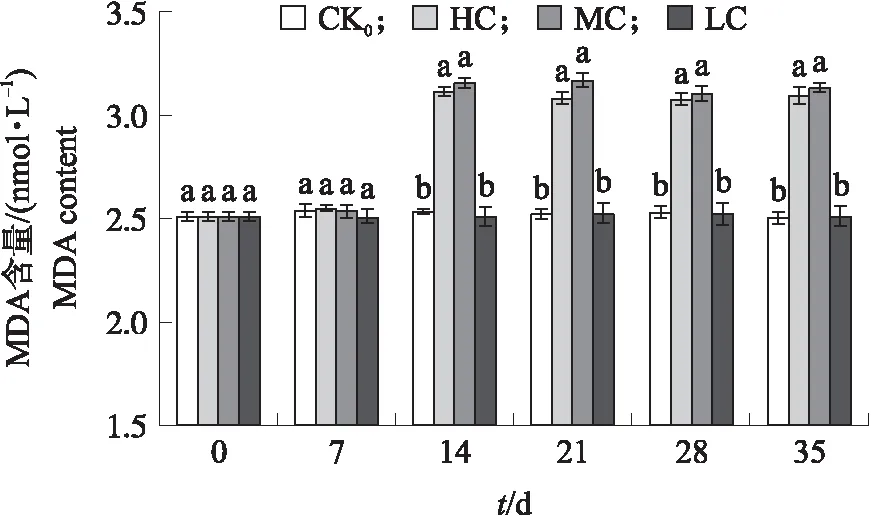
图5 不同氮、磷浓度下荷花叶片MDA含量的变化Fig.5 Changes of MDA content in N. nucifera leaves at different nitrogen and phosphorus concentrations
由图6可见:各处理组中荷花叶片SOD和POD活性由大到小依次表现为低浓度处理组、对照组、中浓度处理组、高浓度处理组。试验期间,低浓度处理荷花叶片SOD活性显著高于对照组,中浓度和高浓度富营养化水体中对荷花叶片SOD活性较低。处理21 d后,中浓度处理荷花叶片SOD活性与对照组相比无显著差异,表明中浓度处理初期抑制了荷花SOD活性,后期恢复至正常水平。高浓度处理组具有同样的趋势。低浓度处理组荷花叶片POD活性相较对照组有所升高,之后随着富营养化水平升高,荷花叶片SOD活性受到抑制的效果更加显著。随着处理时间的不断延长,低浓度处理组荷花叶片POD活性保持在较为稳定的水平,中、高浓度处理组荷花叶片POD活性随试验时间延长逐步升高。

图6 不同氮、磷浓度下荷花叶片SOD(A)和POD(B)活性的变化Fig.6 Changes of SOD(A)and POD(B)activities in N. nucifera leaves at different nitrogen and phosphorus concentrations
3 讨论
在一定范围内,氮、磷浓度的升高有利于水生植物的生长,但氮、磷浓度过高会产生抑制作用[19]。本试验中3种氮、磷浓度水体中荷花新生叶片数均高于对照组,说明荷花能够在3种富营养化条件下正常生长,但过高的富营养化水体前期同样对荷花叶片产生了抑制作用,高、中浓度处理组的新生荷花叶片会在一定时间内会出现失绿症状。随着时间的延长,荷花会逐渐适应过高的富营养化水体,从水体中吸收了大量的氮、磷,以促进植株生长[20]。低浓度处理组荷花叶片中的氮、磷含量增加最明显,这与李琳等[21]的试验结果相似。低浓度处理组荷花生长情况、叶片叶绿素含量也明显优于其他处理,与叶片氮、磷含量变化规律呈现出较好的一致性。这可能是因为低浓度污染水体的氮、磷浓度正符合荷花生长所需要的水体养分含量。本试验表明,荷花对富营养化水体中氮、磷污染物具有良好的去除效果,但由于对氮、磷的去除机制不同,荷花对TP的去除率高于TN,在底泥中尤为明显,说明荷花对于磷的去除存在优势,对减轻水体沉积物中磷的释放具有一定潜力。这可能是因为磷的去除受土壤、植物和微生物等多因素影响,通过沉淀吸附、植物吸收等作用使去除效率提高,荷花因其独特的根状茎而具有一定优势[12]。本试验中荷花对氮、磷的去除效果高于杜红霞等[22]的研究结果,这可能是由于底泥等试验环境的不同和荷花品种间的差异所致。
不同植物对不同营养因子的耐受程度各不相同[23],过高氮、磷浓度的水环境可能打破植物生理平衡[24-25]。一定浓度的氮、磷营养盐胁迫下,水生植物体内抗氧化酶活性呈升高状态[26-27]。本试验中低浓度处理组荷花叶片中抗氧化酶活性变化情况与之相一致。低浓度处理组荷花叶片MDA含量无明显变化,而抗氧化酶SOD和POD活性升高,可能是由于抗氧化酶活性的升高,清除了因逆境产生的活性氧,膜脂过氧化程度较低。而中、高浓度处理组荷花叶片中MDA含量较高、抗氧化酶活性较低,这与孙瑞莲等[28]的研究结果相似,由于高氮、磷营养盐胁迫超过植物正常调节范围,导致抗氧化酶活性下降,进而导致膜脂过氧化程度上升,影响植物正常生长。本试验发现,处理14 d后,中、高浓度处理组荷花抗氧化酶活性逐渐恢复,叶片叶绿素含量、氮含量、磷含量也呈现相同趋势,MDA含量保持稳定,膜脂过氧化程度不再加深,表明荷花可以逐步适应中、高浓度富营养化水体环境。
本研究中,荷花在不同氮、磷污染浓度水体中均表现出良好的净化效果,尤其在高氮、磷浓度水体中TN和TP去除率分别达到79.49%和83.69%。除此之外,荷花对不同氮、磷浓度污染水体底泥中TP去除效果明显,对TN去除效果相对较弱。不同氮、磷浓度污染水体对荷花生长总体呈现低促高抑的作用,但随着时间延长,荷花可以逐渐改善高浓度富营养化水体环境,进而适应生长。以上研究表明,荷花是具有在多种复杂氮、磷污染水体中进行生态修复和景观应用的水生植物。
