术前标识在胃小隆起性病变超声内镜检查中的应用*
2022-08-10兰永廷黄坤明孙胜楠
尚 华,王 涛,兰永廷,黄坤明,孙胜楠,李 敏
1.淄博市中心医院消化内科,山东 淄博 255036;2.淄博市中心医院普外科,山东 淄博 255036
临床工作中,内镜医生在进行常规胃镜检查时经常会发现直径<2 cm 的胃小隆起性病变,但常规胃镜检查中有时难以明确隆起性病变性质及来源等,此时就需要借助于具有胃镜和超声检查双功能的超声内镜进一步明确诊断。超声内镜检查不仅是诊断上消化道隆起性病变的首选方法[1],而且超声内镜检查对胃隆起性病变的随访诊断和临床决策有着重要价值[2]。
目前,微探头超声内镜在临床上的应用较为广泛,但在实际的临床操作过程中,由于受患者的胃蠕动及胃腔容积较大等因素的影响,在进行内镜翻转、胃腔注气注水后,有时会不容易发现胃内小隆起性病变,从而导致内镜检查操作时间的延长,增加了患者不适程度。对于这种在临床工作中经常碰到的问题,本研究采用事先进行黏膜负压吸引导致病变表面或周围黏膜发红出现单个或多个红印进行术前标识的方法来帮助定位,进一步探讨术前标识在胃小隆起性病变超声内镜检查中的应用。本研究回顾性分析2017年1月—2019年12月淄博市中心医院收治的236例接受超声内镜检查的胃小隆起性病变患者的临床资料。现将结果报告如下。
1 对象与方法
1.1 研究对象
以2017 年1 月—2019 年12 月就诊于淄博市中心医院的236 例接受超声内镜检查的胃小隆起性病变患者的临床资料作为研究对象。标准为常规胃镜检查诊断为单个、预估病变直径<2 cm胃小隆起性病变,操作医师仅限于同一名高年资医师。根据术前按是否进行标识分为标识组和未标识组。标识组115 例,男47 例,女68 例,平均年龄(55.9±10.1)岁;病变部位在贲门、胃底、胃体、胃窦和幽门管分别为11 例、26 例、31 例、40 例和7 例。未标识组121 例, 男54 例,女67 例,平均年龄(56.7±10.5)岁;病变部位在贲门、胃底、胃体、胃窦和幽门管分别为6例、32例、37例、35例和11例。
1.2 器械
日本Olympus Q-260J、HQ290 型胃镜;日本OlympusUM-25R 微型超声探头,扫描频率20 MHz;日本OlympusEU-ME2超声内镜主机。
1.3 方法
标识组常规进行胃镜检查,清洗胃腔,发现隆起性病变后,采用黏膜负压吸引方式导致病变表面或周围黏膜发红,必要时可多点进行术前标识,随后注水进行超声胃镜检查。具体步骤见图1~5。未标识组常规进行胃镜检查,清洗胃腔,发现病变后直接注水进行超声胃镜检查。

图1 胃窦大弯侧隆起性病变

图2 病变表面红印标识

图3 胃腔注水后红印明显

图4 探头寻找红色标识定位
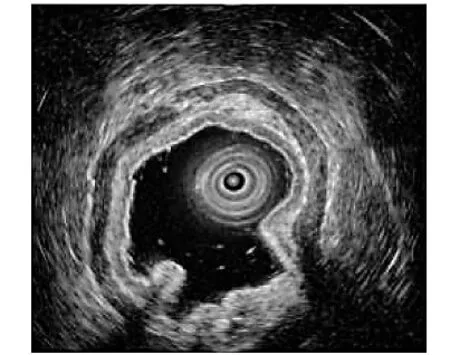
图5 超声内镜示隆起为脂肪瘤
1.4 评价指标
超声内镜检查操作时间:两组患者均以胃内注水完成后第1 次开启超声胃镜扫查至发现病变检查结束为止。在首次检查未能成功获得病变图像者,后续的操作时间不计入观察范围。病变检出率:两组患者均以第1 次使用超声胃镜检查并且获得病变图像看作检出;第1 次使用超声胃镜检查未获得病变图像看作未检出,再次或多次使用超声胃镜检查即使获得病变图像仍看作第1 次检查未检出。病变检出率= 检出病变例数/ 总例数×100%。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t 检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料情况
两组患者中性别、年龄、病变部位组间比较,差异无统计学意义(均P>0.05),见表1。
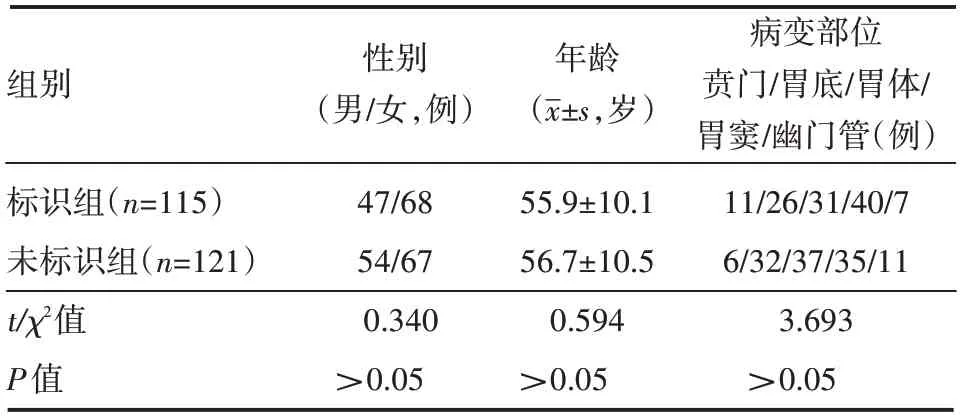
表1 两组患者一般临床资料情况
2.2 两组患者第一次超声胃镜检查病变检出率情况
第一次超声胃镜检查病变检出率:术前标识组97.39%(112/115),未标识组90.91%(110/121),两组间差异有统计学意义(χ2=4.440,P=0.035 <0.05)。
2.3 两组患者超声内镜检查操作时间情况
超声内镜检查操作时间:术前标识组(3.46±2.14)min,未标识组(4.71±3.45)min,两组间差异有统计学意义(t=10.669,P=0.001 <0.01)。
3 讨论
随着临床工作中胃镜检查的普及和内镜检查技术的不断提高,直径<2 cm的胃小隆起性病变在临床上得以更多地发现,但常规的内镜检查有时候难以明确病变的来源及组织学特点,因此无法明确隆起性病变的性质。超声内镜检查可以借助于高频率的超声波检查,从而获得清楚的超声图像。同时,超声探头可以直接接触隆起性病变表面,能够有效避免胃肠道气体以及腹壁组织引起的超声衰减。超声内镜能够清晰地显示消化道管壁的5 层结构[3],根据隆起性病变与消化道管壁的层次关系,可以较为准确地判断隆起性病变的起源层次,还可以根据病变内部的回声特点,对隆起性病变进行定性诊断。近年来,在临床上微探头超声内镜有着较为广泛的应用,其具有不需要更换胃镜、无辐射等特点。在消化道隆起性病变诊断中微探头超声内镜有着关键的作用,微探头超声内镜除了有胃镜的作用,还具有超声功能,通过活检孔道置入微探头,借助于胃镜,观察病灶部位及性质,一方面可以对隆起性病变进行近距离观察;另一方面,通过对隆起性病变进行超声扫描,可判断其来源、大小、层次、性质等,效果显著[4-6]。根据超声特征对病变进行诊断和鉴别诊断,评估内镜治疗的可行性及风险,具有操作简便、准确、安全等优点[7-9],以及对上消化道隆起性病变的诊断具有高准确率的特点[10],还可以为下一步病变治疗方案的选择提供指导意义,因此,超声内镜检查可以改善上消化道隆起性病变患者的预后[11-13]。隆起性病变的起源层次可以协助判断病变的性质,根据病变的层次和大小决定病变切除的手术方式。不同的上消化道隆起性病变在超声内镜下有着不同的回声特点。如平滑肌瘤的病灶发生部位为黏膜肌层或固有肌层,超声下特征为低回声病灶,边界规则。息肉的病灶发生部位为黏膜层多见,超声下特征为低回声或等回声改变,边界较清晰,无包膜,突向腔内。间质瘤病灶发生部位为黏膜肌层或固有肌层,良性病变超声下特征为均匀的低回声团块,恶性病变表现为内部回声不均匀,内部可见高回声或无回声改变,边界欠清晰。异位胰腺病灶发生部位为黏膜层、黏膜肌层、黏膜下层,超声下特征为混合回声团块,有的内部可见无回声管状结构。脂肪瘤病灶发生部位为黏膜下层,超声下特征为高回声改变。囊肿病灶发生部位为黏膜下层,超声下特征为无回声团块[14]。术前进行超声内镜检查评估隆起性病变的性质、来源、大小、层次等,并可以根据结果选择内镜下手术方式。
在临床实际的工作中,普通胃镜检查时较易发现的胃小隆起性病变,在行超声内镜检查时由于受患者的胃蠕动和胃腔容积较大等因素的影响,以及进行注气与注水后使胃腔充盈程度的不同,注水后胃小隆起性病变可能隐藏在胃皱褶里面,或者病变变得较为平坦,在内镜翻转、胃腔注水等操作后,小隆起性病变很难被发现和定位,从而使超声内镜检查操作时间延长,患者的不适程度就会增加。
本研究结果显示,术前标识组超声内镜检查操作时间明显比未标识组短,差异有统计学意义,术前标识组病变检出率明显高于未标识组,差异有统计学意义。据此,采用超声内镜诊断胃小隆起病变时,采用术前标识的方法可以明显缩短超声内镜的检查操作时间,并且可以提高病变检出率。
在常规内镜诊疗工作中,可以采用注射染料的方法进行定位,如注射亚甲蓝生理盐水定位贲门固有肌层肿瘤部位可以大幅度提高发现病灶的速度,有效地缩短手术时间,降低并发症的发生率[15]。但是对于超声内镜检查,注射染料会产生图像伪像,从而影响病变的正常超声图像的识别。利用钛夹进行标记的方法,会影响超声探头对病变的扫查,距离钛夹过近可能会损坏超声微探头,钛夹产生的超声图像也会影响病变及周围组织的正常回声征象。采用活检定位的方法对胃黏膜造成破损[16-17],会增加一次性活检钳的消耗,患者检查费用也会增加。
本研究中,超声内镜扫查前采用黏膜负压吸引导致病变表面或周围黏膜发红,采用出现单个或多个红印进行术前标识的方法来帮助定位,尽管引起黏膜充血,但不会对局部胃黏膜造成实质性影响,可以起到指引性效果,而且不影响超声扫描的图像质量,尤其适用于胃小隆起性病变的超声内镜检查,可以明显提高胃小隆起性病变的诊断效率。
本研究尚存在不足之处,虽然研究病例为直径<2 cm的胃小隆起性病变,但病变的大小可能会导致部分数据分析结果的统计偏倚,操作者在检查时可能因为病变的大小对病变的识别程度产生差异。
综上所述,在对胃小隆起性病变进行超声内镜检查时,采用黏膜负压吸引出现红印的术前标识方法来帮助定位,可以使患者受益,缩短超声内镜检查操作时间,提高病变检出率,值得进行推广。
