模拟水分胁迫对多年生黑麦草种子萌发和生理调控的影响
2022-08-10刘亚西刘金平
刘亚西,周 杨,李 杨,刘金平,王 丹
(西华师范大学生命科学学院 / 西南野生动植物资源保护省部共建教育部重点实验室, 四川 南充 637009)
多年生黑麦草(Lolium perenne)为禾本科黑麦草属草本植物,为典型的冷季型草坪草,兼具坪用和饲用价值,一直以来都是草坪建植和牧草栽培的优良草种之一[1-2]。种子萌发作为植物生活史的第一个阶段,种子的萌发易受到许多外界因素的影响,涝害、干旱、盐碱地等都影响种子的萌发[3]。在其他环境条件适宜的情况下,种子萌发最容易受到水分的影响,水分过多或过少都会对种子的萌发造成影响[4-5]。
种子萌发是有序的生理过程,当萌发环境中水分含量过少时,细胞膜系统被破坏,内含物外渗,渗透调节物质及酶活性都受到影响,进而影响种子的萌发[6]。当萌发环境中水分含量过多时,同样会抑制种子萌发过程中正常的代谢活动,种子淹水时间过长,缺少氧气时进行无氧呼吸影响正常生长发育[7]。在淹水胁迫下,种子因缺氧进行无氧呼吸,使得种子中积累了大量的有害物质(如乙醇),从而限制了种子的萌发[8]。种子的主要成分是淀粉,因此种子的萌发过程实际上主要是淀粉的分解过程。而淀粉的分解是由多种酶共同作用的结果[9],其中α-淀粉酶作为主要的酶类参与淀粉的水解[10]。有研究表明,淀粉含量与种子的发芽特性指标呈极显著负相关关系,而α-淀粉酶活性则刚好相反[11]。因此淀粉含量和α-淀粉酶活性能够很好地反映种子的萌发情况。淹水和干旱胁迫会影响植物体内的抗氧化防御系统,维持活性氧代谢平衡、保护膜结构的功能,超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase,CAT)的含量发生改变[12]。
本研究对黑麦草种子进行不同程度的水分胁迫处理,分析其种子萌发的吸水特性以及受到的影响,探讨淹水和干旱胁迫对黑麦草种子萌发、无氧呼吸、淀粉酶活性和抗氧化酶特性等方面的影响,对了解黑麦草种子萌发过程中水分代谢的规律以及水分合理利用和高效生产具有重要意义。
1 材料与方法
1.1 试验材料
供试多年生黑麦草品种为‘雅晴’(Yatsyn),种子购自百绿国际草业有限公司(种子于2019 年生产,发芽率为90%,千粒重为1.752 5 g)。聚乙二醇(polyethylene glycol, PEG-6000)为化学纯,生产厂家为国药集团化学试剂有限公司。
1.2 试验处理
选取健康饱满且大小一致的黑麦草种子,置于铺有双层滤纸的培养皿内[10]进行发芽试验,种子吸水试验设置对照(CK,蒸馏水)、10% PEG (T1)、15% PEG(T2)、20% PEG (T3)、淹水(T4)共5 个水分处理,种子萌发试验设置CK、T1、T2、T4共4 个水分处理(因预试验中T3处理下种子发芽率仅为8%),每个处理3 次重复,每个培养皿内放置50 粒种子。利用PEG-6000 溶液模拟干旱胁迫,溶液配制方法参考Michel和Kaufmann[13],3 种PEG 浓度(10%、15%、20%)对应水势分别为−0.2、−0.4 和−0.6 MPa[14]。淹水处理在每个培养皿内加入15 mL 蒸馏水使得种子刚好淹没在水中,其余处理的培养皿内加入5 mL 相应处理液,每天定时以称重法补充散失水分以维持培养皿内水势的恒定。种子吸水和萌发试验在恒温光照培养箱中进行,光照/黑暗时间为12 h/12 h,温度25 ℃,相对湿度为80%。每天在同一时间段统计发芽的种子数,以胚根伸长为种子长度的1/2 视为发芽。
1.3 测定指标与方法
1.3.1吸水指标测定
种子放入光照培养箱之前对每个培养皿内的种子称重,即为种子的初始重量。放入培养箱之后前期每隔3 h 取出种子用滤纸吸干表面水分后称重,12 h 后每隔6 h 取出种子称重,直到48 h。根据公式计算种子的吸水量、吸水率和吸水速率。
吸水量 =Wt−Wo;
吸水率 = (Wt−Wo) /Wo× 100%。
式中:Wt为种子吸水后的重量,Wo为种子初始重量。吸水速率 = (Wt−Wt−1) /H。
式中:Wt−1为前一个阶段种子质量,H为间隔时间。
1.3.2 种子萌发相关指标测定
于种子萌发吸水48 h 后测定乙醇脱氢酶(alcohol dehydrogenase, ADH)活性,种子萌发第3 天测定淀粉含量、α-淀粉酶活性。第5 天测定发芽势,第12天统计发芽率,发芽试验结束从每个培养皿中随机选取10 株幼苗用直尺测量株高、根长。种子的发芽势、发芽率、发芽指数具体计算方法如下:
发 芽 势 = (第5 天 发 芽 种 子 数/供 试 种 子 数) ×100%;
发芽率 = (第12 天发芽种子数/供试种子数) ×100%; ∑
发芽指数(germination index,GI) = (Gt/Dt)。式中:Gt为在时间t内的发芽个数,Dt为相应的发芽天数[15]。
发芽结束后测定SOD、POD、CAT 酶活性,淀粉含量、α-淀粉酶活性、ADH、SOD、POD、CAT 酶活性均采用苏州格锐思生物科技公司的试剂盒测定。
1.4 数据统计分析
采用Excel 2010 对数据进行处理和制图,应用SPSS 22.0 软件采用单因素方差分析方法(ANOVA)对各观测指标平均值进行分析,利用DUNCAN 方法对各指标平均值进行差异显著性分析(P< 0.05)。
2 结果与分析
2.1 黑麦草种子萌发吸水动态特性
不同水分胁迫下吸水量和吸水率变化趋势基本一致,大致可分为3 个阶段(图1)。第1 阶段是0~24 h;第2 阶段是24 ~ 36 h;第3 阶段是36 h 之后,种子吸水逐渐趋于饱和,48 h 时CK 处理部分种子开始萌发。对不同水分处理下黑麦草种子的最终吸水量和吸水率进行差异性分析显示(表1),T4和CK 处理下的吸水量和吸水率无显著差异(P> 0.05),但干旱与CK 处理间差异显著 (P< 0.05)。随着PEG浓度的增加,种子的吸水量和吸水率逐渐下降,20%PEG 胁迫处理时种子的吸水量和吸水率最低,与CK 相比降低了28.65%和29.34%,且与T1、T2处理间差异显著(P< 0.05)。在不同水分处理下黑麦草种子的吸水速率在前3 h 达到最大值,之后逐渐下降并慢慢趋于稳定。
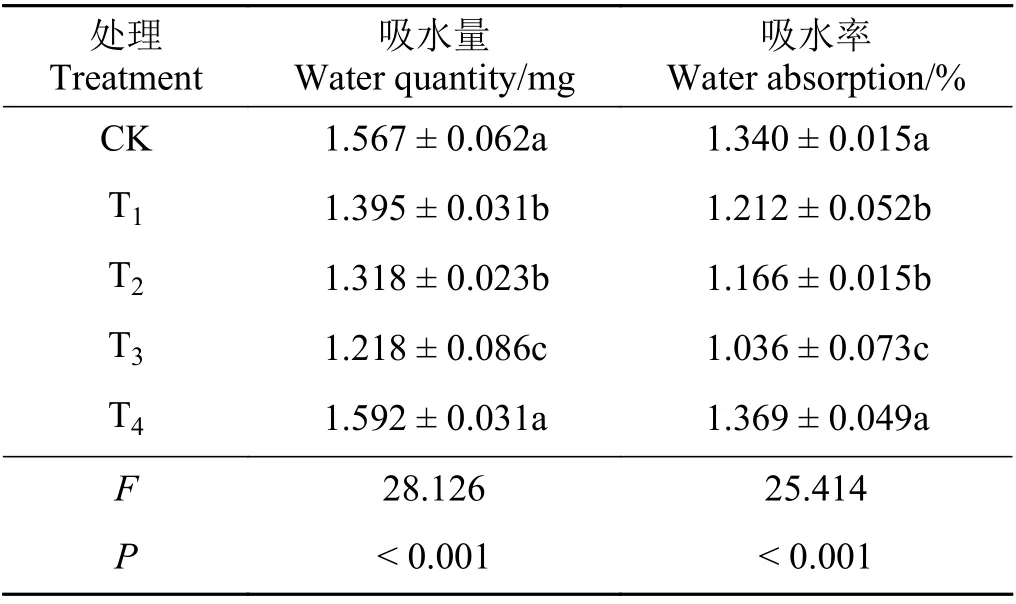
表1 不同水分胁迫对黑麦草种子最终吸水量和吸水率的影响Table 1 Effects of different water stress treatments on final water quantity and water absorption by ryegrass seeds

图1 不同水分胁迫对黑麦草种子萌发吸水特性的影响Figure 1 Effects of different water stress treatments on germination and water absorption characteristics of ryegrass seeds
2.2 不同水分胁迫处理对黑麦草种子萌发的影响
水分胁迫对种子的发芽势和发芽率有显著影响(P< 0.05) (表2)。发芽势和发芽率随着PEG 浓度的增加而降低,10% PEG 处理与CK 之间无显著差异(P> 0.05),15% PEG 处理的发芽势和发芽率比CK 分别降低了25.27%和24.21%。淹水处理下种子的发芽势和发芽率均与CK 存在显著差异(P< 0.05),但都与15% PEG 处理无显著差异(P> 0.05)。干旱和淹水都显著影响种子的发芽指数,随着干旱程度的增加发芽指数越小,但T2和T4处理间无显著差异(P> 0.05)。干旱抑制了黑麦草幼苗的生长,10%PEG、15% PEG 与CK 相比差异显著,分别降低了24.49%和37.75%;T4处理下株高与CK 相比显著降低(P< 0.05),但与T1处理间无显著差异(P> 0.05)。根长随着PEG 浓度的增加表现为先减小后上升的趋势,T1处理下的根长略低于对照且无显著差异(P> 0.05),T2处理比CK 提高了39.89%。

表2 不同水分胁迫对黑麦草种子萌发指标的影响Table 2 Effects of different water stress treatments on germination indexes of ryegrass seeds
2.3 不同水分胁迫处理对黑麦草种子萌发过程中乙醇脱氢酶活性的影响
种子吸水48 h 后,各胁迫处理间的乙醇脱氢酶(ADH)活性表现不同的变化趋势(图2)。T4处理显著提高了乙醇脱氢酶活性(P< 0.05),与对照相比增加了50.62%,而T1、T2和CK 处理之间无显著性差异(P> 0.05)。T4与T1、T2处理相比,ADH 活性显著提高了50.15%、43.03% (P< 0.05)。淹水胁迫(T4)处理,ADH 酶活性大于CK 处理,表明种子处于淹水中缺氧逆境条件下,为了维持短期的生活机能,将会进行无氧呼吸,使ADH 酶活性增强。
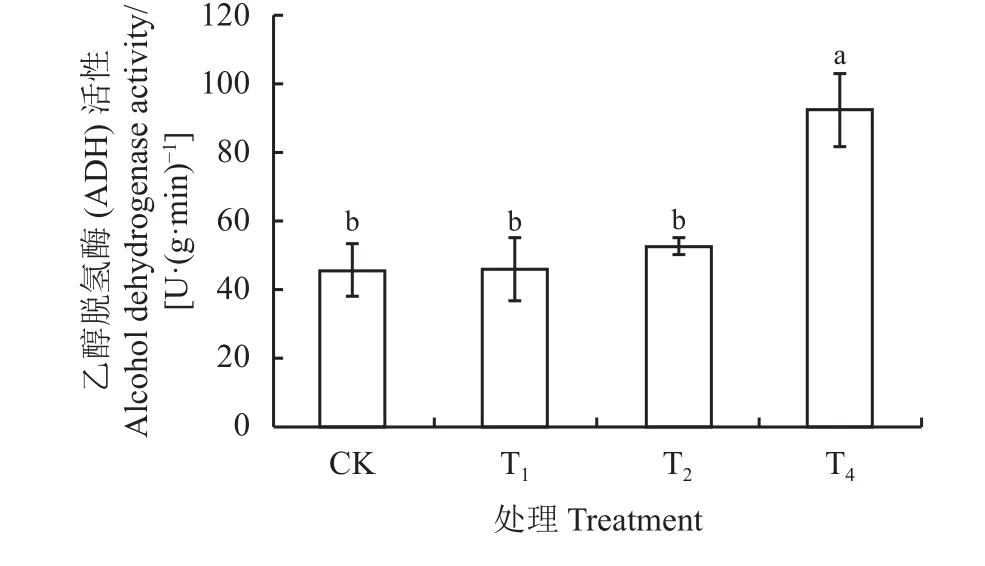
图2 不同水分胁迫对黑麦草种子乙醇脱氢酶活性的影响Figure 2 Effects of different water stress treatments on alcohol dehydrogenase activity in ryegrass seeds
2.4 不同水分胁迫处理对黑麦草种子萌发淀粉含量和α-淀粉酶活性的影响
CK 处理的黑麦草种子的α-淀粉酶活性最高,干旱和淹水处理下α-淀粉酶活性表现出下降的趋势(图3),T1处理下与CK 相比没有显著差异(P>0.05),T2和T4处理与CK 相比α-淀粉酶活性显著降低(P< 0.05),分别降低了73.19%和78.01%。与CK 相比,T1处理下淀粉含量增加,但二者无显著差异(P> 0.05),T2和T4处理下淀粉含量都显著高于CK (P< 0.05),分别高于对照38.77%和39.90%。表明15% PEG 干旱处理(T2)和淹水胁迫(T4)都抑制了种子萌发过程中淀粉酶的活性,进一步影响种子的萌发过程中淀粉的代谢。

图3 不同水分胁迫对黑麦草种子α-淀粉酶活性和淀粉含量的影响Figure 3 Effects of different water stress treatments on α-amylase activity and starch content in ryegrass seeds
2.5 不同水分胁迫处理对黑麦草种子萌发抗氧化酶活性的影响
与CK 相比不同水分胁迫处理下,3 种抗氧化酶活性均表现出显著增高的相同变化趋势(P< 0.05)(图4)。与CK 相比,T1、T2和T4处理均显著促进了SOD 酶活性(P< 0.05),分别增加了54.96%、57.24%和59.50%。与CK 相比,T1、T2和T4处理均显著促进了POD 酶活性(P< 0.05),分别增加了40.16%、41.54%和47.59%。与CK 相比,T1、T2和T4处理均显著促进 了CAT 酶 活 性(P< 0.05),分 别 增 加 了52.63%、54.58%和55.29%。在本研究处理的时间点内,T1、T2、T4处理之间3 种抗氧化酶活性均无显著差异(P>0.05)。表明PEG 干旱处理(T1、T2)和淹水胁迫(T4)均显著影响了种子萌发正常的生理代谢,植物通过抗氧化酶系统适应胁迫环境。

图4 不同水分胁迫对黑麦草种子抗氧化酶活性的影响Figure 4 Effects of different water stress treatments on antioxidant enzyme activities of ryegrass seeds
3 讨论与结论
在黑麦草种子萌发吸水动态试验中,不同水分胁迫下各组吸水量和吸水率动态变化趋势基本相同,吸水量和吸水率逐渐增加,36 h 后种子的吸水量和吸水率逐渐趋于稳定。PEG 能使植物处于类似于干旱的环境中,可用来模拟干旱胁迫[16]。本研究中随着PEG 浓度的增高和干旱胁迫程度的增加,吸水量和吸水率降低。在CK 处理下,48 h 黑麦草种子的吸水量占种子干重的66.72%,吸水率达到1.34%时种子开始萌发,而不同PEG 胁迫下的黑麦草种子萌发时间延迟。说明干旱是通过抑制黑麦草种子的吸水量和吸水率从而影响种子的萌发。有研究表明,对种子萌发吸水量的测定可为种子浸种时间的确定提供一定的依据[17]。短期的淹水胁迫对种子的发芽率和发芽势不会产生很大影响,但长期淹水胁迫会降低种子的发芽率和发芽势[18]。干旱在生产中可导致延迟或不均匀的种子萌发,本研究中干旱胁迫抑制黑麦草种子萌发,随着干旱胁迫的增加,黑麦草种子发芽势、发芽率和发芽指数都显著降低。
植物应对水分胁迫通过多种途径,包括调节其结构、能量代谢、光合作用、呼吸作用和内源激素的变化等[19]。种子萌发过程中,完成吸胀吸水后,代谢相关酶活化,呼吸作用为萌发过程的各种代谢活动提供能量。种子在环境缺氧条件下,进行无氧呼吸,ADH 酶活性增加。长期进行无氧呼吸,使细胞内乙醛、乙醇和乳酸含量大量积累,ATP 合成减少,养分吸收下降,会对植物细胞造成伤害,使植物生长受到抑制。 Brownstein 等[20]研究了淹水与厌氧代谢相关的酶的关系,结果表明在淹水处理下盐碱草甸物种都表现出显著增加的ADH 活性。这与本研究结果一致,在淹水处理下ADH 活性显著高于PEG和CK 处理,而PEG 和CK 处理间ADH 活性无显著差异。有些植物的种子在淹水环境中萌发效果较好,如水稻(Oryza sativa)、芦苇(Phragmites australis)等,在缺氧环境中,ADH 代谢在种子萌发和植物存活中起着至关重要的作用[21]。本研究中淹水处理下ADH 酶活性升高,表明淹水处理干扰了种子正常的呼吸代谢作用,诱导无氧呼吸的产生,影响正常的代谢,使植株生长显著低于CK 处理。
种子的萌发过程需要将种子贮藏物淀粉和蛋白质通过酶转化为生长发育所需要的糖类,例如淀粉的分解代谢[22]。本研究中淹水或干旱处理淀粉的含量都显著高于CK,α-淀粉酶活性显著低于CK。这与在干旱胁迫下,PEG 胁迫显著抑制了黄瓜(Cucumis sativus)种子[23]和苋菜(Amaranthus tricolor)种子[24]的α-淀粉酶活性,使得种子具有较高的淀粉含量的研究结果一致。稻谷可以在淹水条件下发芽,而大多数其他谷类则没有类似的表现,在淹水的情况下,由于α-淀粉酶的成功产生,稻谷降解淀粉的能力可能是使水稻在厌氧条件下发芽的因素之一[25]。本研究中淹水处理和干旱处理间α-淀粉酶活性无显著性差异,同时显著低于CK,说明黑麦草淹水和干旱胁迫处理都表现为显著抑制α-淀粉酶活性,降低淀粉的代谢速率,使得种子中具有较高的淀粉含量,影响种子的能量转化,进一步影响种子萌发。
水分胁迫使植物细胞内产生活性氧,干扰正常的生命代谢活动[26]。但植物对逆境的响应会产生自我保护的抗氧化酶,SOD、POD、CAT 分别通过催化超氧化物、过氧化氢或其他过氧化物,清除逆境胁迫产生的活性氧,维持活性氧的动态平衡,是生物体内清除活性氧的主要保护酶[27]。本研究通过测定种子萌发期3 种抗氧化酶活性指标,分析不同水分胁迫对抗氧化酶活性的影响,结果显示,不同水分胁迫处理下SOD、POD、CAT 酶的活性加强。这与Lotfi 等[28]研究干旱胁迫对不同基因型波斯核桃(Juglans regia)抗氧化酶活性的影响和秦立刚等[29]研究PEG 干旱胁迫下3 种葱属植物种子通过诱导SOD、POD、CAT 酶的活性,清除体内活性氧的研究结果相似。此外,薛静怡等[30]的研究表明在淹水处理下千金子(Leptochloa chinensis)种子的POD、SOD酶活性都随着水分胁迫的加重而有不同程度的增高。Gomathi 等[31]的研究也表明SOD 在短期淹水胁迫下,在控制活性氧和保护细胞免受引起的膜损伤方面起着重要作用。这说明,淹水或干旱胁迫都会使种子细胞组织中产生活性氧,抑制正常的生长代谢。在本研究中淹水处理与10% PEG、15% PEG 处理间的SOD、POD、CAT 酶的活性无显著差异,说明在本研究处理时间内,针对活性氧伤害方面,黑麦草淹水处理与干旱胁迫具有相似的应答机制,植物细胞组织中氧化防御系统诱导抗氧化酶SOD、POD、CAT 活性上升,清除活性氧对组织造成的伤害。
综上所述,0 - 24 h 为黑麦草种子萌发的快速吸水时期,种子持续吸水36 h 以后,种子吸水量表现出停止增长状态,因此对种子浸种处理时间建议选择24 - 36 h。PEG 抑制种子萌发的吸水量和吸水率,随着PEG 浓度升高,种子萌发吸水量和吸水率降低。10% PEG 浓度处理下,黑麦草种子的发芽率和发芽势与CK 无显著性差异,但发芽指数和株高已经受到显著影响,表明10% PEG 浓度显著影响种子的萌发。淹水处理下黑麦草种子萌发过程无氧呼吸代谢加强,淹水和15% PEG 干旱胁迫下α-淀粉酶活性降低,淀粉代谢量减少,淹水和10%、15% PEG干旱胁迫下种子发芽过程中抗氧化酶SOD、POD、CAT 活性加强。本研究结果为黑麦草种子萌发过程的水分管理提供理论参考依据。
