木贼镰刀菌拮抗菌株的筛选及特性
2022-08-10杨晓蕾李建宏赵桂琴窦嘉宁魏恺全
杨晓蕾,李建宏,姚 拓,赵桂琴,窦嘉宁,魏恺全
(甘肃农业大学草业学院 / 草业生态系统教育部重点实验室, 甘肃 兰州 730070)
镰刀菌(Fusariumspp.)属于丛梗孢目瘤痤孢科镰刀菌属的有性型真菌。镰刀菌对于农产品具有很强的破坏性,破坏植物体结构,分泌次生代谢物,使植株出现枯萎、穗腐和腐烂等现象[1],病害常发生于农田种植区,常见病害有棉花枯萎病、香蕉枯萎病等。木贼镰刀菌作为根腐病的重要病原菌之一,在植物全生育期均可引起植株发病,苜蓿(Medicago sativa)根腐病的发生率最高达92%,造成苜蓿植株死亡率约60%,进而缩短苜蓿利用年限,降低牧草品质,致使苜蓿丧失其加工价值,降低苜蓿有效利用率[2-4]。根腐病在燕麦(Avena sativa)种植过程中时有发生,是一种常见的土传病害,病害发生严重时,植株根部腐烂,从而导致植株吸收水分与养分的能力减弱,导致植株地上部分出现叶片发黄、萎蔫等症状,病害严重时可导致整株死亡[5]。
目前对于镰刀菌的防治,主要是采用化学农药的方法,化学农药虽能起到抑菌防病的作用,但其易造成农药残留,引起土壤退化,影响农产品安全,对人畜健康造成危害。利用生物防治已成为农业病害防治的一种重要方法[6],而生防菌更是一种重要的资源微生物。李巧玲等[7]以尖孢镰刀菌(Fusarium oxysporum)为指示菌,自健康木香(Radix aucklandiae)植株根际土壤分离得到了2 株拮抗效果好且具有较好稳定性的贝莱斯芽孢杆菌(Bacillus velezensis) at-21和枯草芽孢杆菌(Bacillus subtilis) at-97,抑菌率分别为66.8%和78.6%。在扬花期被禾谷镰刀菌侵染的麦穗上分离得到28 株芽孢杆菌,利用平板对峙法对其进行筛选发现,其中20 株菌对禾谷镰刀菌表现出明显的拮抗作用;菌株JS62N、JS15E 和JS29I 能够将赤霉病发病率降低80%多;所有菌株均能极显著增加小麦(Triticum aestivum)的百粒重,菌株JS12Q效果最好,增加了101.4%[8]。目前对于木贼镰刀菌生防菌资源的筛选及其特性研究报道较少,而燕麦根腐病近几年也常有发生,严重影响饲用作物品质及产量,基于此,本研究以燕麦植株为原材料,从其根际分离筛选出对木贼镰刀菌有较好抑制作用的生防菌资源,并对其促生特性进行研究,利用16S rRNA确定菌株分类学地位,以期为开发微生物制剂和生物农药提供理论依据。
1 材料与方法
1.1 材料
本研究样品为2020 年采集于甘肃省定西市临洮县(103°29′08″~104°19′34″E,35°03′42″~35°56′46″N)的一株燕麦植株,选取燕麦无病虫害以及长势良好的植株,将其连带根际土壤进行完整采挖,低温(4 ℃)保存运输,带回实验室后立即进行根际微生物的分离筛选。
供试病原菌:木贼镰刀菌(Fusarium equiseti)由甘肃农业大学草业学院草地微生物实验室提供。
1.2 培养基
LB 培养基:蛋白胨1%,酵母粉0.5%,氯化钠0.2%,蒸馏水 1 L,pH 7.0 [9] (固体培养基添加琼脂粉 2%)。
无机磷培养基:葡萄糖1%,磷酸三钙0.5%,六水氯化镁 0.5%,七水硫酸镁 0.025%,氯化钾 0.02%,硫酸铵 0.01%,蒸馏水1 L,pH 7.0[10]。
有机磷培养基:四水硫酸锰 0.003%,七水硫酸亚铁 0.003%,碳酸钙0.5%,葡萄糖1%, 硫酸铵0.05%,卵磷脂 0.02%,氯化钠 0.03%,氯化钾 0.03%,酵母粉0.4 g,蒸馏水 1 L,pH 7.0[11]。
固氮NFM 培养基:氯化钙0.002%,七水硫酸镁0.02%,磷酸氢二钾 0.05%,钼酸钠 0.0002%,氯化钠0.01%,苹果酸0.5%,氢氧化钾0.45%,0.5% 溴百里酚蓝5 mL,蒸馏水1 L,pH 7.0 [12] (半固体培养基添加琼脂粉0.2%)。
King 培养基:蛋白胨2%,磷酸氢二钾0.115%,七水硫酸镁0.15%,丙三醇15 mL,蒸馏水1 L,pH 7.0[13]。
1.3 拮抗细菌分离
将根际分为根表土壤、根系面和根内3 个区域进行菌株分离。称取5 g 样品,溶于45 mL 生理盐水的三角瓶中,在摇床上充分震荡30 min,制成悬浮液,静置后在无菌条件下取1 mL 上清液逐级稀释,依次获得各质量浓度梯度的菌悬液。分别取10−3、10−4、10−5浓度的土壤悬浮液50 μL 涂布于选择培养基(NFM 培养基)平板上,每个浓度梯度3 个重复,28 ℃倒置培养24 h。分离纯化细菌3~5 次,将纯化后的菌株用甘油保存法−80 ℃保存备用[14]。
1.4 拮抗细菌初筛
拮抗菌的初步筛选采用平板对峙法,将活化后的木贼镰刀菌和待测拮抗菌共同接种于培养基表面,设置3 个重复,置于25 ℃培养箱中恒温培养,测量对照病原菌菌落直径、抑菌圈直径等指标,并计算拮抗菌的抑菌率[15-16]。

式中:D为对照菌落直径,d为处理菌落直径。
1.5 拮抗细菌复筛
对初步筛选得到的菌株进一步复筛,挑选抑菌圈直径大、抑制效果持久的菌株进行促生特性研究。
1.5.1 菌株的溶磷特性研究
在无菌条件下,分别将菌株单菌落接种至盛有30 mL 溶磷液体培养基的50 mL 三角瓶中,28 ℃、180 r·min−1条件下振荡培养7 d,采用钼 蓝比色法(molybdenum blues colorimetry,MBC)测定溶磷量[10]。
1.5.2 菌株的固氮特性
采用乙炔还原法对菌株进行定量测定[17]。用100 μL 平口微量进样器从血清瓶中分别抽取混合气体100 μL 快速注入到气相色谱仪气体进样柱内,记录并观察乙烯出峰时间及峰面积百分比,计算菌株固氮酶活性。
1.5.3 菌株分泌吲哚乙酸特性
挑取菌株单菌落接种于盛有已灭菌的30 mL King 液体培养基的50 mL 三角瓶中,在 28 ℃、180 r·min−1条 件 下 振 荡 培 养7 d。采 用Salkowski 比 色法,测定菌株吲哚乙酸(indole-3-acetic acid, IAA)特性[18-19]。
1.6 菌株分类地位确定
采用细菌基因组提取试剂盒(OMEGA),参考试剂盒说明书提取菌株总DNA,通过琼脂糖凝胶电泳、核酸浓度测定仪确定样品条带的分布情况和DNA 纯度。选取27F-1492R 作为通用引物,进行PCR 扩增反应[20]。扩增产物委托兰州天启基因生物科技有限公司进行测序。将16S rDNA 序列在NCBI数据库进行BLAST 比对,并使用MEGA 7.0 软件进行系统进化分析。
1.7 数据处理
采用Excel 软件进行数据整理和作图,SPSS 25.0 进行单因素方差分析,用Duncan 进行多重比较(P< 0.05)。
2 结果与分析
2.1 优良拮抗菌筛选
通过平板对峙法从燕麦根际共分离出木贼镰刀菌拮抗菌株47 株,具有促生能力的菌株有26 株,其中有固氮酶活性的菌株15 株,溶无机磷菌株13 株,解有机磷菌株9 株。促生菌在木贼根际分布呈现根际效应。
通过对菌株拮抗特性进行复筛,本研究筛选的菌株中有6 株具有不同程度的拮抗木贼镰刀菌的能力,抑制率均大于40%。DRT-17 菌株和DRT-18 菌株与其他拮抗菌相比,抑菌能力突出,抑菌率为89.40%和91.16%,显著大于其他菌株(P< 0.05) (表1)。
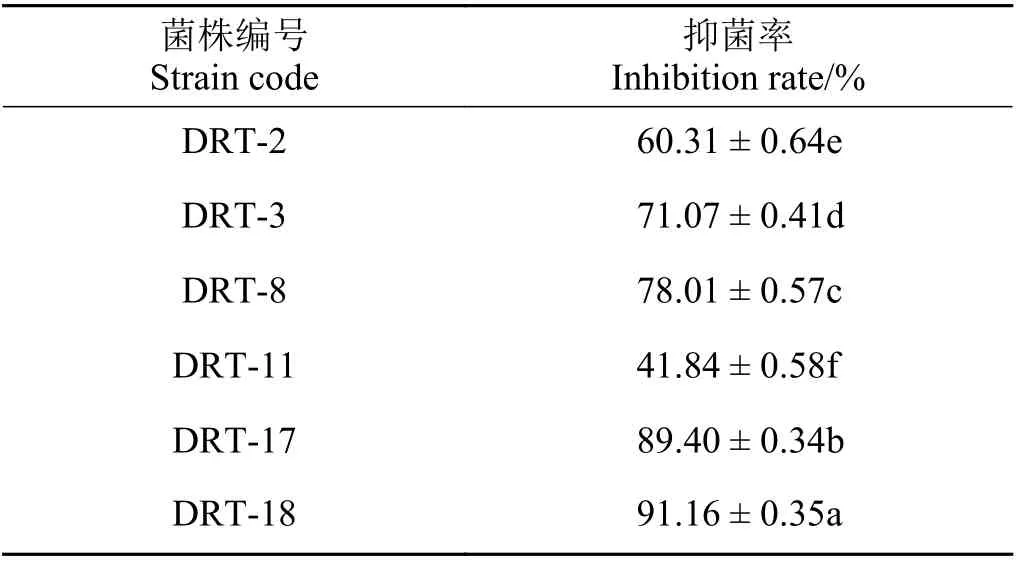
表1 拮抗菌对对木贼镰刀菌的拮抗作用Table 1 Inhibition rate of antagonistic strains against Fusarium oxysporum
2.2 菌株的促生特性
2.2.1 菌株溶磷特性
利用钼锑抗比色法对筛选出的6 株拮抗菌株的溶磷能力测定(图1)发现,菌株溶解无机磷的能力高于溶解有机磷的能力。各菌株均具有溶解无机磷的能力,溶磷量46.14~135.47 μg·mL−1,菌株中只有菌株DRT-3、菌株DRT-11、菌株DRT-17 具有溶解有机磷的能力,溶磷量分别为21.64 、31.65 和28.64 μg·mL−1。
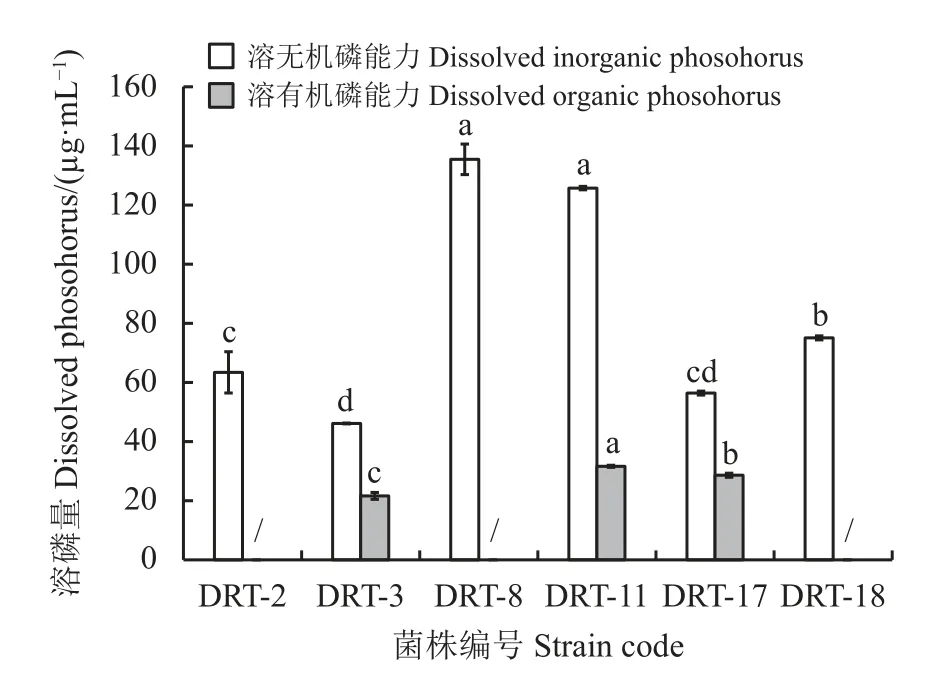
图1 生防菌株溶磷能力Figure 1 Capacity of biocontrol strains to dissolve phosphorus
2.2.2 菌株固氮能力
利用选择性培养基NFM 分离出固氮菌株,乳白色菌落为主,菌落形状呈规则圆形且菌落边缘光滑。进一步利用乙炔还原法对其固氮酶活性测定(图2)发现,除菌株DRT-17 无固氮酶活性,5 株菌株固氮酶活性在51.82~210.81 nmol·(h·mL)−1(C2H4),其中DRT-11 固氮酶活性最高。

图2 生防菌株固氮能力Figure 2 Nitrogenase activity of biocontrol strains
2.2.3 菌株分泌生长激素(IAA)的能力
测定菌株分泌IAA 的能力发现(表2),各菌株均有显色反应,分泌量41.74~157.28 μg·mL−1,其中以菌株DRT-17 分泌生长激素的能力最大,为157.28 μg·mL−1,菌株DRT-18 分泌植物生长激素的能力最小,为41.74 μg·mL−1。
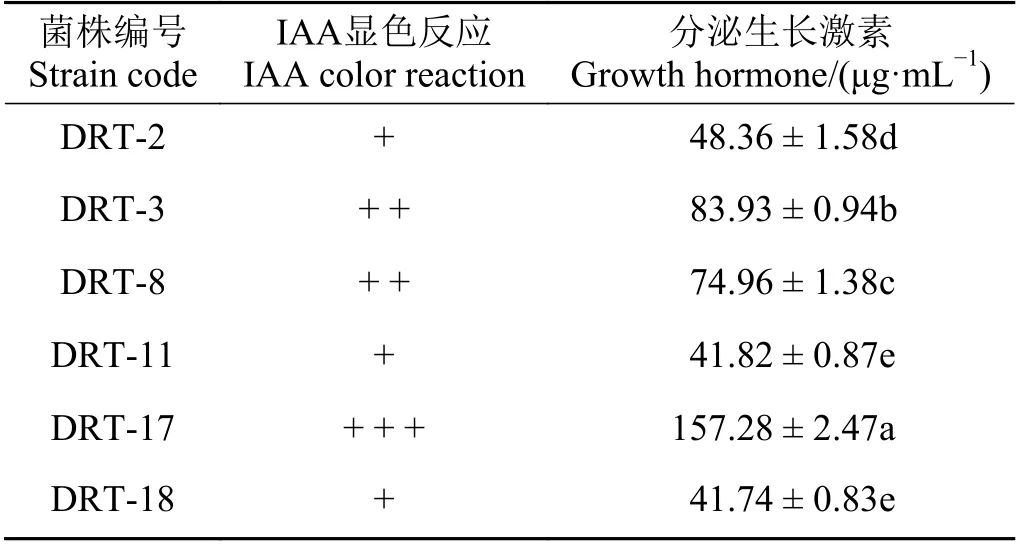
表2 生防菌株分泌IAA 的量Table 2 IAA secreting ability of biocontrol strains
2.3 菌株分类地位确定
综合评价各菌株促生特性,通过对供试菌株DNA 的提取及PCR 扩增检测,并测序获得的序列在NCBI 网站进行比对分析(图3),结果表明,6 株供试菌株中,菌株DRT-2、DRT-8 为枯草芽孢杆菌(Bacillus subtilis),DRT-3 为蕈状芽孢杆菌(Bacillus mycoides),DRT-11 为不动杆菌(Acinetobactersp.),菌株DRT-17、DRT-18 为荧光假单胞菌(Pseudomonas fluorescens),并构建菌株系统发育树。

图3 菌株 16SrDNA 基因序列同源性构建的系统发育树Figure 3 Phylogenetic tree constructed based on 16S rDNA gene sequence homology
3 讨论与结论
国内外有关生防细菌的研究报道较多。生防细菌繁殖速度快、周期短,环境适应能力强,且代谢产物多样、活动复杂,在生物防治中起着非常重要的作用[21-22]。生防细菌中研究较多的为芽孢杆菌属(Bacillus)与假单胞菌属(Pseudomonas),芽孢杆菌作为外源添加菌剂,易定殖于植物,同根部病害病原菌形成竞争关系,细菌分泌代谢物可以抑制病原菌生长,增强植物抗性,降低病害发生率[23-24]。姚凤琴等[25]发现枯草芽孢杆菌(Bacillus subtilis) Bv17 对可以防治非洲菊(Gerbera jamesonii)根腐病,且相对防效高达70%,当其浓度为5 × 107cfu·mL−1时防治效果可达97.32%。而本研究筛选出的枯草芽孢杆菌(Bacillus subtilis) DRT-8、蕈状芽孢杆菌(Bacillus mycoides) DRT-3,抑菌率均达到70%。而假单胞菌能有效抑制多种病原真菌孢子的萌发、游动孢子囊的产生以及病原菌的菌丝生长[26-27],抑制病害同时还可以促进植物生长,研究发现,荧光假单胞菌(Pseudomonas fluorescens)产生的藤黄酚等次级代谢产物能有效抑制烟草根黑腐病的发生[28]。从荧光假单胞菌 (Pseudomonas fluorescens)、铜绿假单胞菌(Pseudomonas aeruginosa) 等菌株中分离纯化的嗜铁素可以有效抑制黄曲霉 (Aspergillus flavus)、黑曲霉(Aspergillus niger)、尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rhizoctonia solani)等病原菌的生长[29-30],降低病害发生率。本研究筛选出的荧光假单胞菌(Pseudomonas fluorescens)与其他拮抗菌相比,抑菌能力突出,抑菌率达89.40%和91.16%,后期对其产铁载体能力,有待进一步研究。
生防菌防治对比化学药剂防治更加绿色、高效,对环境安全和人畜的健康更有保障。以前,学者们分离筛选生防菌资源主要利用具有拮抗作用的放线菌,近年来,更多的研究人员发现植物根际促生菌是一种更理想的生防菌来源,但由于生防菌筛选还未寻找到合适的选择性培养基,从而选择具有优良促生特性的菌株同时研究其生防效果,从而达到筛选优良菌株的目的。张梦琦等[31]分离筛选出一株多功能根际促生菌DD3,兼具溶磷、产铁载体等能力,对大蒜(Allium sativum)根腐病抗病能力有所提高,同时有效提升大蒜生长的农艺性状。撖冬荣等[14]研究发现醋酸钙不动杆菌(Acinetobacter calcoaceticus) MGBC3,具有溶磷、分泌激素的能力,对黄瓜枯萎病(Fusarium oxysporum)有较强抑制作用。本研究筛选出的菌株中,DRT-3、DRT-11、DRT-17兼具溶磷、固氮、分泌激素的能力,且抑菌能力较强,后期对其促生及生防机理有待进一步研究。
综上,本研究从燕麦根际分离筛选到了6 株抑菌能力较强的菌株,抑菌率最高为91.16%,筛选出具有固氮能力的菌株有5 株,固氮酶活性在51.82~210.81 nmol·(h·mL)−1(C2H4),具 有 溶 无 机 磷 能 力 的菌株有5 株,溶磷量在46.14~135.47 μg·mL−1,菌株中只有菌株DRT-3、DRT-11、DRT-17 具有溶解有机磷的能力,溶磷量为21.64、31.65 和28.64 μg·mL−1,具有分泌IAA 能力的菌株6 株,分泌量在41.74~157.28 μg·mL−1。其中DRT-17 分泌植物激素的量最强,且具有较强的抑菌效果,对菌株进行分子生物学鉴定,菌株DRT-2、DRT-8 为枯草芽孢杆菌(Bacillus subtilis),DRT-3 为蕈状芽孢杆菌(Bacillus mycoides),DRT-11为不动杆菌(Acinetobactersp.),菌株DRT-17、DRT-18为荧光假单胞菌(Pseudomonas fluorescens)。
