天然小分子化合物抗鼻咽癌活性及机制的研究进展
2022-08-08蒲缓缓屈赵林金榕陈四保中国医学科学院北京协和医学院药用植物研究所北京0093三峡大学湖北宜昌44300
蒲缓缓,屈赵,林金榕,陈四保*(. 中国医学科学院北京协和医学院药用植物研究所,北京 0093;. 三峡大学,湖北 宜昌 44300)
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种特殊的头颈部恶性肿瘤,发生于鼻咽顶部及双侧咽隐窝。流行病学研究表明,NPC 在我国的发病率居世界之首[1]。由于其发生部位隐蔽,早期症状不典型,且绝大多数鼻咽癌属于未分化鳞状细胞癌,容易发生转移,因此70%的患者确诊时已属于临床中晚期[2]。近年来,包括免疫治疗、基因治疗、单克隆抗体治疗在内的生物治疗成为抗肿瘤研究的热点,但目前未得到广泛的应用[3]。放疗是目前治疗癌症最常用的方法。在放疗的基础上加以铂类药物化疗是晚期鼻咽癌治疗的标准方法,这些患者的5年生存率可达90%以上[4]。目前化疗的方法主要有同步化疗、诱导化疗和辅助化疗,然而化疗药物易出现耐药性和不良反应等问题。如何减少化疗药物的耐药性并降低不良反应是鼻咽癌治疗的关键,因此寻找高效低毒的化合物尤为重要。
从1930年到2014年,被批准的小分子抗癌药物中约有60%是天然产物或其衍生物[5]。天然产物的化学结构丰富,不仅可以与化疗药物联用降低肿瘤细胞对化疗药物的耐药性,还可以单独用于某些体质较差且不能耐受大剂量抗癌药物的晚期癌症患者。因此天然产物在新型抗癌药物的开发中发挥着越来越重要的作用。本文对近十年治疗鼻咽癌的天然化合物的化学结构、抗癌活性、抗癌机制和耐药性进行综述,为发现治疗鼻咽癌的先导化合物提供了新的视角和可能性,也为天然化合物抗鼻咽癌的机制研究提供了思路。
1 抗鼻咽癌的天然化合物
在过去的十年里,发现了许多抗鼻咽癌的天然产物,主要分为萜类、黄酮类、多酚类、酚酸类、醌类、生物碱类和其他类化合物。
1.1 萜类化合物
近年来发现的具有抗鼻咽癌活性的天然萜类化合物有倍半萜类,如莪术醇(curcumol,1)、单端孢菌素(trichothecin,2)、neoalbaconol(3)、山金车内酯 D(arnicolide D,4),化合物见表1和图1。

图1 抑制鼻咽癌的倍半萜类化合物的结构Fig 1 Structure of sesquiterpenoids for nasopharyngeal carcinoma
莪术醇是从中草药莪术Curcumae Rhizoma 中分离而来的倍半萜醇类化合物,对多种实体瘤如肺癌、乳腺癌和胃癌等均具有抗癌作用,其潜在的作用机制主要与NF-κB、MAPK 和PI3K/AKT信号通路有关[6]。研究表明莪术醇可显著抑制CNE2 细胞的增殖并诱导其凋亡,这可能与其下调NF-κB 蛋白水平[7]和抑制IGF-1R/PI3K/AKT信号通路[8]有关。莪术醇通过降低细胞周期蛋白Cyclin 和细胞周期蛋白依赖性激酶CDK 的表达诱导细胞周期停滞在G0/G1期[8]。多功能蛋白核仁素(nucleolin,NCL)在鼻咽癌细胞中显著上调,进一步研究表明,通过敲除NCL 可以显著逆转莪术醇对CNE2 细胞生长的抑制作用,因此NCL 可能是莪术醇治疗鼻咽癌的靶标[9]。
单端孢菌素是从草本植物美登木Maytenus hookeriLoes.的内生真菌中分离出来的倍半萜类次级真菌代谢产物[10]。单端孢菌素能显著抑制鼻咽癌细胞(HK1 和C666-1 细胞)生长并上调脱氢酶/还原酶家族成员2(DHRS2)的mRNA 和蛋白水平,且敲除DHRS2 可逆转单端孢菌素的抗增殖作用[11]。体内研究发现,在HK1-CON 细胞和HK1-DHRS2 细胞构建的肿瘤异种移植模型中,相对于接种HK1 细胞的裸鼠,接种过表达DHRS2 的HK1 细胞的裸鼠肿瘤大小和肿瘤质量均显著减少且体质量没有明显变化[11]。因此单端孢菌素可通过靶向DHRS2 抗鼻咽癌。
Neoalbaconol 是一种从地花菌Albatrellus confluens(Alb. & Schw. : Fr.)Kotl. & Pouz.中分离的倍半萜类化合物,有抑制C666-1 和HK1 细胞增殖的作用,通过靶向PDK1 抑制其下游的PI3K/AKT/HK2 信号通路从而发挥抗鼻咽癌的作用[12]。在C666-1 细胞构建的肿瘤异种移植模型中,用100 mg·kg-1的neoalbaconol 处理的裸鼠肿瘤体积明显较小,且未显示出明显的毒性,通过免疫组化染色发现肿瘤中p-mTOR、p-AKT和HK2 表达均下调。体内数据与体外数据一致表明neoalbaconol 通过抑制AKT 信号通路抑制肿瘤生长[12]。
山金车内酯D 是从鹅不食草Centipeda minima(L.)A. Br. et Aschers.中分离得到的倍半萜内酯,对CNE2 细胞有显著的抑制作用[13]。山金车内酯D 可诱导细胞周期停滞在G2/M 期并诱导其凋亡,可能与其对PI3K/AKT/mTOR 信号传导途径和STAT3 信号通路的抑制以及线粒体凋亡途径的激活有关[13]。
二萜类化合物有疏展香茶菜宁E(effusanin E,5)、冬凌草素(lasiodin,6)和11α-羟基-15-氧-16-烯-对映贝壳杉烷-19 酸(5F)(7)。化合物见表1和图2。
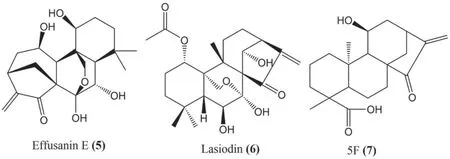
图2 抑制鼻咽癌的二萜类化合物的结构Fig 2 Structure of diterpenoids for nasopharyngeal carcinoma

表1 治疗鼻咽癌的天然萜类化合物Tab 1 Natural terpenoids for nasopharyngeal carcinoma
疏展香茶菜宁E 和冬凌草素是从溪黄草Isodon serra(Maxim.)Hara 中提取的二萜类化合物,均能激活CNE1 和CNE2 细胞中的Caspase凋亡信号通路[14-15]。在CNE2 细胞构建的肿瘤异种移植模型中,与对照组相比疏展香茶菜宁E[10.0 mg/(kg·d)和30.0 mg/(kg·d)]可显著抑制肿瘤体积和质量,且无明显毒性,此外疏展香茶菜宁E 处理的肿瘤中COX-2 和NF-κB p50蛋白的表达均下降[14]。冬凌草素通过调节Apaf-1/Caspase、AKT/MAPK 和COX-2/NF-κB 信号通路抑制人鼻咽癌细胞的增殖[15]。
化合物7 是从半边旗Pteris semipinnataL.中分离得到的一种二萜类化合物,可通过诱导细胞周期停滞在G2/M 期、激活线粒体介导的凋亡途径和抑制NF-κB 信号通路来抑制CNE-2Z 细胞增殖[16]。
综上,目前发现的二萜类化合物均可通过抑制NF-κB 和COX-2 信号通路治疗鼻咽癌,这两条通路可能是该类化合物抗鼻咽癌的作用通路。
抗鼻咽癌的三萜类化合物有葫芦素E(cucurbitacin E,8)、人参皂苷Rg3(ginsenoside Rg3,9)和pinicolol B(10)。化合物见表1和图3。
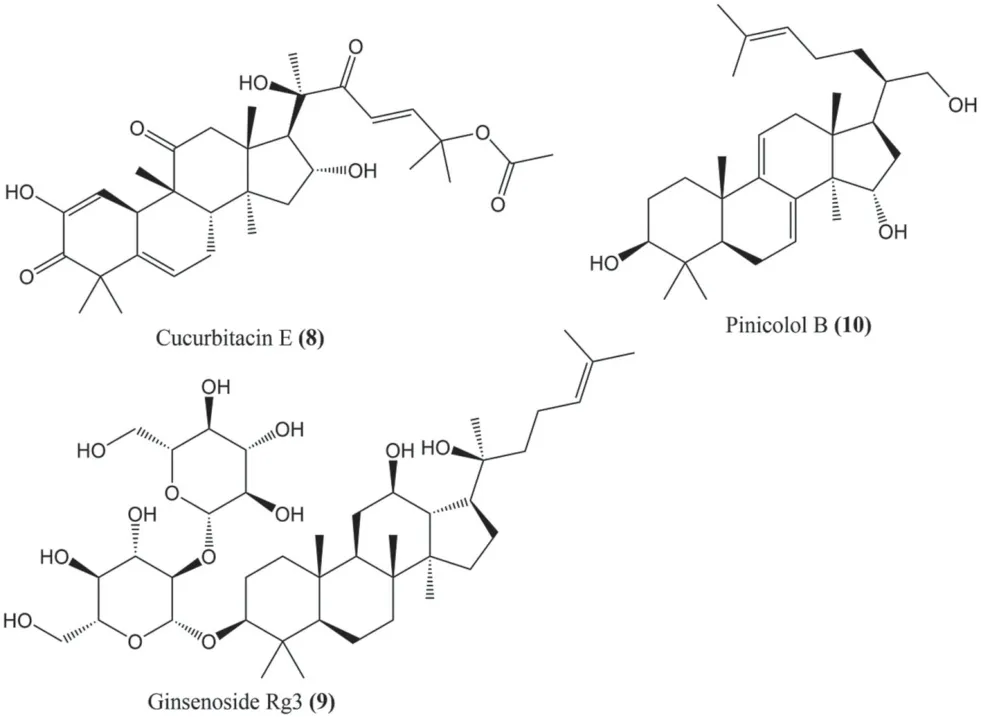
图3 抑制鼻咽癌的三萜类化合物的结构Fig 3 Structure of triterpenoids for nasopharyngeal carcinoma
葫芦素E 是一种从甜瓜Cucumis meloLinn.中提取的天然四环三萜类化合物,具有抗鼻咽癌的作用。用浓度为0.62525 μmol·L-1的葫芦素E 处理HONE1 细胞时,并没有发生明显的坏死、凋亡或Caspase-3 的激活,但其24 h 的IC50值小于2.5 μmol·L-1[17]。此外,葫芦素E 通过下调CDC2基因和细胞周期蛋白B1 的表达,上调GADD45γ基因的表达,在鼻咽癌细胞系中诱导GADD45γ/CDC2 复合物的形成和G2/M 细胞周期停滞而发挥有效的抗鼻咽癌作用[17]。
人参皂苷Rg3是从人参Panax ginsengC. A.Meyer 中提取的四环三萜皂苷,是广谱抗肿瘤化合物,其机制主要包括诱导细胞凋亡、抑制细胞增殖、转移和血管生成以及增强免疫[18]。用不同质量浓度的人参皂苷Rg3(25、50 和100 μg·mL-1)处理HNE1 和CNE2 细胞24 h 发现MMP-2、MMP-9 和EMT 的表达降低,因此人参皂苷Rg3通过调节MMP-2、MMP-9、EMT 的表达来抑制鼻咽癌细胞的迁移和侵袭[19]。
Pinicolol B 是从中国台湾特有的樟芝Antrodia cinnamomea中提取的四环三萜类化合物,可诱导鼻咽癌细胞的凋亡和坏死,对TW02 和TW04 细胞有微弱的抑制作用,IC50值分别约为63.3 μmol·L-1和115.0 μmol·L-1[20]。
1.2 黄酮类化合物
近年来发现的具有抗鼻咽癌活性的黄酮类化合物有柳穿鱼黄素(pectolinarigenin,11)、黄芩苷水合物(baicalin hydrate,12)、伽升沃(cbarcinone C,13)、槲皮素(quercetin,14)、异甘草素(isoliquiritigenin,15)和高良姜素(galangin,16)。化合物见图4及表2。

图4 抑制鼻咽癌的黄酮类化合物的结构Fig 4 Structure of flavonoids for nasopharyngeal carcinoma

表2 抗鼻咽癌的黄酮类化合物Tab 2 Flavonoids for nasopharyngeal carcinoma
柳穿鱼黄素是从药用植物飞机草Eupatorium odoratumL.中提取的黄酮类化合物。体外研究发现柳穿鱼黄素可以通过线粒体相关的凋亡途径和活性氧(ROS)诱导的凋亡途径诱导C666-1 细胞凋亡,通过Transwell 实验和伤口愈合实验发现其能抑制C666-1 细胞的迁移[21]。在C666-1 细胞构建的肿瘤异种移植模型中,柳穿鱼黄素(20.0、40.0 和80.0 mg·kg-1)可显著抑制肿瘤生长且对心肝肾等器官无明显毒性,此外在肿瘤组织中Bax 和Cleaved-caspase-3 表达上调而Bcl-XL/S 表达下调[21]。
黄芩苷水合物是从黄芩Scutellaria baicalensisGeorgi 中提取具有抗鼻咽癌活性的类黄酮,对CNE1、HNE3、5-8F、6-10B、C666-1 和HK1 细胞具有明显的抑制作用[22]。在C666-1 和HK1细胞中,黄芩苷水合物通过影响Cyclin 蛋白水平诱导细胞周期停滞在G2/M 期并以p53 依赖的方式诱导细胞早期凋亡[22]。体内研究发现在由C666-1 细胞构建的肿瘤异种移植模型中,每隔两日腹腔注射10 mg·kg-1黄芩苷水合物的裸鼠其肿瘤质量显著降低且体质量没有显著变化,表明黄芩苷水合物具有显著的抗鼻咽癌活性[22]。值得注意的是,黄芩苷水合物虽然提高了Suv39H1 和SON 的水平,通过激活m6ARNA 甲基化促进了Suv39H1 的剪接,但没有改变Suv39H1 DNA 的甲基化[22]。
伽升沃C 是从岭南山竹子Garcinia oblongifoliaChamp. ex Benth.中提取的天然黄酮类化合物,可显著抑制CNE1、CNE2、HK1 和HONE1 细胞的活力和集落形成能力[23]。此外,伽升沃C 能够通过激活ATR 下调Cyclin 和CDK7 诱导鼻咽癌细胞S 期停滞,大剂量的伽升沃C 还可诱导鼻咽癌细胞坏死[23]。
槲皮素是具有广谱抗肿瘤活性的黄酮醇类化合物,大量存在于蔬菜、水果和饮料中,比如羽衣甘蓝、洋葱、浆果、苹果、红葡萄、西蓝花、樱桃、茶和红酒等。槲皮素的抗肿瘤作用主要与诱导肿瘤细胞凋亡和选择性地抑制血管生成因子VEGF 表达及活性有关[24]。比如槲皮素可通过调节PI3K/AKT/mTOR 和STAT3 信号通路诱导肿瘤细胞凋亡和自噬。在NPC-039 细胞中,用10 mg·mL-1的槲皮素处理24 h 后细胞活力降低至36%[25]。槲皮素还可通过抑制NF-κB 的磷酸化从而抑制鼻咽癌细胞的增殖和血管生成[25]。
异甘草素可通过下调MMP-2 和MMP-9 的表达来抑制鼻咽癌细胞的迁移和侵袭[26]。在由CNE2细胞构建的肿瘤异种移植模型中,每日灌胃12.5、25、50 mg·kg-1的异甘草素的裸鼠其肿瘤体积显著降低且体质量没有明显变化。异甘草素可抑制体内肿瘤细胞增殖、诱导凋亡并降低β-catenin 和LATS2 蛋白的表达,并通过调节miR-32/LATS2/Wnt 抑制鼻咽癌细胞增殖和诱导其凋亡[26]。
高良姜素是从姜科植物红豆蔻Alpinia galanga(L.)Willd.根中提取的黄酮类化合物,对NPCTW039 和NPC-TW076 细胞有轻度的抑制作用,其作用机制与抑制PI3K/AKT 通路、诱导p53 依赖的S 期停滞和凋亡、抑制PARP 有关[27]。
1.3 多酚类化合物
多酚类化合物的共同特点是具有良好的抗氧化活性,能够清除游离自由基,对一些肿瘤细胞具有增殖抑制作用。抗鼻咽癌的多酚类化合物有奇果菌素(grifolin,17)、姜黄素(curcumin,18)和白藜芦醇(resveratrol,19)。化合物见图5及表3。

图5 抑制鼻咽癌的多酚类化合物的结构Fig 5 Structure of polyphenols for nasopharyngeal carcinoma

表3 治疗鼻咽癌的多酚类化合物Tab 3 Polyphenols for nasopharyngeal carcinoma
奇果菌素是从蕈Albatrellus confluens和假美柄牛肝菌Boletus pseudocalopus中提取的天然法尼基酚类化合物,可以通过靶向DNA 甲基转移酶1(DNMT1)阻碍肿瘤细胞代谢重编程,因此在高CpG 岛甲基化表型(CpG island methylator phenotype,CIMP)的鼻咽癌中,奇果菌素有希望作为抗鼻咽癌的先导化合物[28]。
姜黄素是一种从植物姜黄Curcuma longaLinn中分离出来的黄色多酚,对乳腺癌、肺癌和头颈部鳞状细胞癌等均有显著的抗癌作用,抗癌机制主要是通过抑制多种细胞信号通路诱导癌细胞凋亡并抑制其增殖和侵袭[29]。研究表明姜黄素可抑制人鼻咽癌细胞生长,用10 μmol·L-1姜黄素处理NPCTW076 细胞48 h 后,存活率下降50%以上。姜黄素通过线粒体凋亡途径诱导细胞凋亡和细胞周期停滞在G2/M 期并通过上调鼻咽癌细胞中miR-7 的活性来使Skp2 失活,从而发挥抗鼻咽癌作用[30]。
白藜芦醇是一种从红葡萄中提取的天然多酚类化合物,可抑制鼻咽癌细胞增殖并诱导其凋亡[31]。在鼻咽癌细胞中,白藜芦醇可破坏线粒体膜电位,从而引起线粒体中细胞色素C 的释放、FasL 和Bax 的表达上调以及GRP78 和Bcl-2 的表达下调[32],这可能与其激活AMPK 的活性并阻断p70S6K 和s6 的活性有关[31]。
1.4 酚酸类化合物
抗鼻咽癌的酚酸化合物有藤黄酸(gambogic acid,20)和没食子酸(gallic acid,21)。化合物见图6及表4。

图6 抑制鼻咽癌的天然酚酸类化合物的结构Fig 6 Structure of natural phenolic acids for nasopharyngeal carcinoma

表4 抗鼻咽癌的酚酸类化合物Tab 4 Phenolic acids for nasopharyngeal carcinoma
藤黄酸是藤黄Garcinia hanburyiHook. f.的主要活性成分,有显著的抗CNE1 和CNE2 细胞增殖的作用[33]。藤黄酸诱导细胞凋亡与在缺氧条件下Caspasase-3 和Bax/Bcl-2 的表达相关,此外还诱导细胞周期停滞在G2/M 期[33]。没食子酸抑制人鼻咽癌细胞中基质侵袭和AP-1/ETS-1 介导的MMP-1转录,可用于开发抗鼻咽癌转移的新化疗药物[34]。
1.5 醌类化合物
大多数醌类药物具有酚类羟基或羟基,这可能是其具有抗肿瘤作用的原因。抗鼻咽癌的醌类化合物有紫草素(shikonin,22),大黄素(emodin,23)和大黄素甲醚(physcion,24)。化合物见图7及表5。
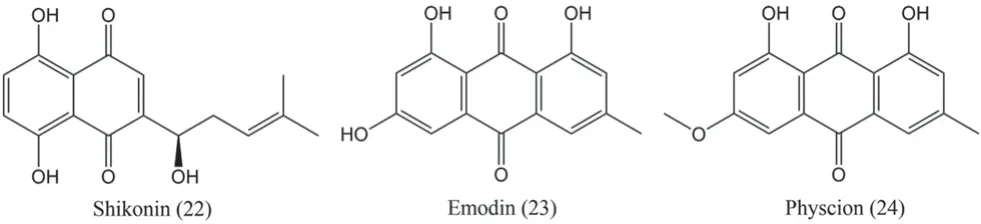
图7 抑制鼻咽癌的醌类化合物的结构Fig 7 Structure of quinones for nasopharyngeal carcinoma

表5 治疗鼻咽癌的醌类化合物Tab 5 Quinones for nasopharyngeal carcinoma
紫草素是一种从紫草Lithospermum erythrorhizonSieb. et Zucc.中提取的醌类化合物,在体内外均对CNE-2Z 细胞有良好的抑制作用[35]。紫草素可通过激活ROS 并上调RIP1 和RIP3 的表达导致CNE-2Z 细胞坏死[35]。
大黄素和大黄素甲醚是在中药大黄Rheum officinaleBaill.中发现的活性蒽醌类化合物,可分别诱导CNE-2Z 细胞周期停滞在S 期和G1期[36-37]。大黄素通过靶向氯通道来抑制鼻咽癌细胞生长,因此氯通道应可作为鼻咽癌治疗的新靶点[36]。每日腹腔注射10 mg·kg-1的大黄素甲醚可显著减少肿瘤体积且对体质量无明显影响,此外通过增加Cleaved-caspase-3 和LC3B-Ⅱ的表达诱导体内肿瘤细胞凋亡和自噬。大黄素甲醚对肿瘤生长的抑制作用与组织中Sp1 和miR-27a 表达的降低相关,可通过ROS/miR-27a/ZBTB10 信号靶向Sp1 从而诱导人鼻咽癌细胞的凋亡和自噬[37]。
1.6 生物碱化合物
抗鼻咽癌的生物碱有小檗碱(berberine,25),3,3'-二吲哚甲烷(3,3'-diindolylmethane,26)和(vetypyrroloids A,27)。化合物见图8及表6。

表6 抗鼻咽癌的生物碱Tab 6 Alkaloids for nasopharyngeal carcinoma

图8 抑制鼻咽癌的天然醌类化合物的结构Fig 8 Structure of natural alkaloids for nasopharyngeal carcinoma
小檗碱是一种异喹啉生物碱,存在于许多药用植物的根、根茎和茎皮中,比如黄连Coptis chinensisFranch.。小檗碱是一种广谱的抗癌化合物,主要通过诱导细胞周期停滞和增加凋亡因子的表达来抑制肿瘤细胞生长[38-39]。小檗碱可通过诱导STAT3 活化抑制肿瘤相关成纤维细胞从而对鼻咽癌细胞增殖有一定的抑制作用[39]。将C666-1 细胞皮下注射至裸鼠腋下,对照组在约14 d 出现较大肿瘤,而腹腔注射5 mg·kg-1和10 mg·kg-1的小檗碱分别在30 d 和45 d 均未出现可测量的肿瘤,表明小檗碱能有效地抑制体内肿瘤的形成[39]。
3,3'-二吲哚甲烷在十字花科植物中含量丰富,如西蓝花和甘蓝,能抑制5-8F 和CNE2 细胞在肿瘤异种移植模型动物中的生长。体外研究发现3,3'-二吲哚甲烷显著抑制5-8F 和CNE2 细胞的活力60%[40-41];其还可以同时调节与鼻咽癌相关的几种信号通路,如PI3K/AKT、MAPK 和NF-κB信号通路,从而有效地诱导鼻咽癌细胞凋亡并诱导细胞周期停滞在G2/M 期,在鼻咽癌的发生和发展中具有预防和治疗作用[42]。
Vetypyrroloids A(27)是一种从植物蔓荆Vitex trifoliaLinn.分离出的新型二萜类生物碱,含有氰基部分和吡咯环[42]。Vetypyrroloids A 对CNE1 细胞有显著的抑制作用,IC50值为8.7 μmol·L-1,但作用机制目前尚不清楚[42]。
1.7 其他类化合物
其他抗鼻咽癌的化合物还有三白脂素(manassantin B,28)、雷公藤甲素(triptolide,29)、化合物30、(cherimolacyclopeptide E,31)、化合物32 和化合物33(见图9及表7)。

表7 其他抗鼻咽癌的化合物Tab 7 Other compounds for nasopharyngeal carcinoma

图9 抑制鼻咽癌的其他化合物的结构Fig 9 Structure of other compounds for nasopharyngeal carcinoma
三白脂素是从三白草Saururus chinensis(Lour.)Baill.的根中提取的[43],对Akata-BX1细胞有较强的抑制作用。三白脂素可通过抑制AP-1 信号转导来抑制EB 病毒早期基因BZLF1的表达,从而抑制EBV 裂解复制;此外mTORC2是三白脂素抗EBV 感染的靶标[1]。
雷公藤甲素是从雷公藤Tripterygium wilfordiiHook. f.中提取的环氧二萜内酯,对C666-1、HONE1/Akata、HK1/Akata、CNE1/Akata 和CNE1 细胞等多种肿瘤细胞有显著的抑制作用。体内研究发现,每日腹腔注射0.4 mg·kg-1雷公藤甲素对HONE1/Akata 细胞构建的肿瘤异种移植模型有显著的治疗作用,且Cleaved-caspase-3 蛋白表达增加,但EBNA1 蛋白表达降低。雷公藤甲素可诱导细胞周期停滞在S 期,通过线粒体凋亡途径诱导EBV 核抗原1(EBNA1)降解并促进鼻咽癌细胞凋亡[44]。
化合物30 是从滇重楼Paris polyphyllavar.Yunnanensi中提取的甾体皂苷,其对CNE 细胞的抑制作用比顺铂强,其IC50值为1.50 μmol·L-1,作用机制与诱导凋亡和细胞周期停滞在G1/S 期有关[45]。
Cherimolacyclopeptide E(31)是一种从毛叶番荔枝Annona cherimolaMill.中获得的环六肽,对 KB 细胞具有显著的细胞毒性,IC50值为0.017 μmol·L-1[46]。将其2 位甘氨酸和6 位甘氨酸用Ala 取代得到衍生物32 和33,对KB 细胞表现出显著的细胞毒性,IC50值分别为6.3 μmol·L-1和7.8 μmol·L-1[47],但是作用机制目前尚未明确。
2 用于鼻咽癌联合化疗的天然化合物
常见治疗鼻咽癌的化疗药物是顺铂、卡铂、5-氟尿嘧啶、吉西他滨、紫杉醇、蒽环类药物、博来霉素、表柔比星和西妥昔单抗等。几十年来顺铂与5-氟尿嘧啶联用一直是鼻咽癌的一线治疗方案,其应答率为40%~65%,但单纯化疗容易产生耐药性,晚期鼻咽癌治疗的主要障碍之一是耐药性的发展[48]。
研究表明,化疗药物与天然产物联用比单独使用具有毒性低、疗效高或逆转多药耐药性等优点。比如槲皮素和顺铂联合使用比单独使用时疗效好,可协同抑制鼻咽癌细胞的增殖[49],且槲皮素可降低顺铂诱导的猪肾细胞LLC-PK1 的肾毒性[50]。
天然化合物影响化疗药物对鼻咽癌的耐药性主要涉及EBV 感染、癌症干细胞(cancer stem cells,CSCs)形成、miRNA、DNA 修复、EMT 和凋亡等[51]。本文将从诱导癌细胞凋亡、清除癌症干细胞、靶向EBV 和靶向miRNA 四个方面讨论天然化合物如何减少鼻咽癌对化疗药物的耐药性。
2.1 诱导癌细胞凋亡
在耐药的鼻咽癌细胞中,高水平的Survival和抑凋亡相关蛋白能够抑制细胞凋亡从而降低化疗药物的疗效。然而,一些天然化合物,如5F、槲皮素、积雪草酸(asiatic acid,34)、雷公藤红素(celastrol,35)和虫草素(cordycepin,36)(见图10)可通过诱导细鼻咽癌胞凋亡从而减少化疗药物的耐药性。

图10 抑制化疗药物耐药性的天然化合物的结构Fig 10 Structure of natural small compounds to reduce cancer resistance
顺铂可通过增加ROS 的产生来增加细胞毒性从而发挥抗癌活性[52]。有趣的是5F 与顺铂联合使用可减少ROS 产生却通过协同增加Caspase-3 的活性诱导鼻咽癌细胞凋亡从而提高顺铂的抗癌作用[16]。同时积雪草酸、雷公藤红素和虫草素均可通过增加p38 和ERK 蛋白的磷酸化来诱导对顺铂耐药的人鼻咽癌细胞凋亡[53-54]。小檗碱与人参皂苷Rg3联合使用可以通过靶向MAPK/ERK 信号通路来促进凋亡相关蛋白Bax 的表达,并抑制凋亡抑制蛋白Survivin 和Bcl-2 的表达,从而协同抑制CNE2 细胞增殖并诱导其凋亡[55]。
Wikstroflavone B(37)是从了哥王Wikstroemia indica(Linn.)C. A. Mey.中分离的双黄酮类化合物。Wikstroflavone B 和姜黄素通过阻断FAK/STAT3 信号通路抑制Survivin 表达并促进p53,MMP-2 和MMP-9 表达从而协同诱导NPC 细胞凋亡并抑制转移[56]。与单独使用相比,CNE1 细胞经10 μmol·L-1的姜黄素和40 μmol·L-1的wikstroflavone B 处理后,可显著抑制细胞伤口间隙闭合并减少侵袭细胞的数量[56]。而且姜黄素在联合方案中可增强放化疗的疗效[57]。
2.2 清除肿瘤干细胞
癌症干细胞是指负责维持肿瘤发生的肿瘤细胞亚群,具有自我更新、高致瘤性、侵袭性和对传统化疗和放疗的耐药性等特点[58]。肿瘤干细胞的存在是多发性恶性肿瘤进展、复发和转移的罪魁祸首,想要治愈肿瘤,首先要解决肿瘤干细胞问题。
洛伐他汀(lovastatin,38)在临床上广泛用于治疗高胆固醇血症,最新研究发现其可通过抑制5-8F 和6-10B 的鼻咽癌干细胞增殖和自我更新从而诱导其凋亡和细胞周期停滞在G2/M期[59]。此外,洛伐他汀还可以增强鼻咽癌干细胞对化学疗法和光动力疗法的敏感性[59]。莱菔硫烷(sulforaphane,39)可通过DNMT1/Wnt 抑制因子1(WIF1)轴抑制鼻咽癌细胞生长,此外通过抑制肿瘤干细胞而增强顺铂的抗肿瘤作用[60]。洛伐他汀和莱菔硫烷都可通过抑制鼻咽癌干细胞来增强化疗药物的敏感性(见图10),这证明消除肿瘤干细胞可以减少化疗药物的耐药性。
2.3 靶向EBV
EBV 病毒与NPC 的发生发展密切相关[61]。越来越多的证据表明EBV 蛋白和EBV miRNAs 参与了鼻咽癌化疗的耐药性。
三白脂素[1]和虫草素[62]可以抑制EBV 早期基因BZLF1的表达。虫草素和阿霉素通过激活PKC-p38 MAPK 信号通路诱导C/EBPβ蛋白磷酸化从而激活裂解性EBV 感染发挥抗鼻咽癌作用[62]。EBNA1 是唯一一个在所有EBV 阳性细胞中均表达的病毒蛋白,在EBV 基因组的维持、复制和转录中发挥了重要作用,可作为潜在的研究靶点。敲除EBNA1 可抑制EBV DNA 的载量从而使鼻咽癌细胞对顺铂和5-氟尿嘧啶敏感,初步提示EBNA1 在鼻咽癌化疗的耐药中发挥潜在作用[63]。VK-2019 是目前最先进的直接针对EBNA1的化合物[61]。雷公藤甲素的抗鼻咽癌作用与靶向EBNA1 有关[44]。然而,针对EBNA1 的研究仍处于早期阶段。
在NPC 中,EBV 编码了超44 种病毒的miRNA。miR-BARTs 是EBV 编码的miRNA,占NPC细胞中miRNA 的三分之一,能促进NPC 的发展[64]。越来越多的证据表明,miR-BARTs 通过参与EMT 和抗凋亡等信号通路促进鼻咽癌化疗耐药的发生[65]。
2.4 靶向miRNA
最近的研究表明,miRNA 不仅在维持细胞功能方面起着重要作用,还与肿瘤的发生和耐药性的产生有关,miRNA 既可以作为肿瘤诊断和预后的生物标志物,又可以作为治疗靶点[66]。天然化合物可以通过调节miRNA 的表达发挥抗肿瘤作用[60-61]。例如,由于miR-21 在细胞中的异位表达,槐果碱(sophocarpine)处理头颈部鳞状细胞癌的细胞后导致磷酸化的PTEN 和p38 蛋白表达增加并逆转EMT[67]。
研究发现miRNA 在鼻咽癌中的作用涉及到多个信号通路,比如NF-κB 信号通路[68]、PI3K/AKT 信号通路[69]、PTEN/AKT 信号通路[70]和Wnt/β-catenin 信号通路[71]。目前靶向miRNA 的天然化合物的研究较少,因此具有广泛研究前景。
3 小结
综上,目前关于天然化合物抗鼻咽癌的研究越来越多,但大多数都停留在活性的研究层面上,机制研究不够深入,主要围绕PI3K/AKT/mTOR和NF-κB 信号通路展开。其中天然化合物通过靶向EBV 和靶向miRNA 抗鼻咽癌的研究较少,但具有广泛的研究前景,进一步探讨其作用机制对天然化合物抗鼻咽癌的研究具有重要意义。此外治疗晚期鼻咽癌的主要障碍是耐药性的发展,因此降低耐药性仍是今后研究的重点。
