miR-145通过靶向ABCE1发挥抗乳腺癌作用
2022-08-08陈双华李荣周玉生南华大学药物药理研究所湖南衡阳421001湖南中医药高等专科学校湖南株洲412000南华大学附属第二医院湖南衡阳421001南华大学附属南华医院湖南衡阳421001
陈双华,李荣,周玉生(1. 南华大学药物药理研究所,湖南 衡阳 421001;2. 湖南中医药高等专科学校,湖南 株洲 412000;3. 南华大学附属第二医院,湖南 衡阳 421001;4. 南华大学附属南华医院,湖南 衡阳 421001)
乳腺癌是女性最常见的恶性肿瘤之一,病死率居女性肿瘤首位[1]。随着诊疗手段的不断发展,乳腺癌患者的病死率逐渐下降,但即便是在疾病早期进行治疗,也只能短时间内控制疾病的发展,大多数患者仍会复发、转移、恶化。因此,深入了解乳腺癌的发病机制和乳腺癌细胞的分子生物学特点,寻找乳腺癌新的治疗靶点,对乳腺癌的防治是非常必要的[2]。
ABCE1 属ATP 结合盒转运子基因亚家族成员之一,其编码的ABCE1 蛋白是一种核糖核酸酶L(ribonuclease L,RNase L)抑制因子[3]。RNase L 属于2-5 腺苷酸(2'-5'oligoadenylate,2-5A)系统,作用于水解磷酸二酯键,水解单链RNA 分子[4]。以往研究表明RNase L 主要与干扰素抗病毒作用有关,近期研究表明此酶有诱导细胞死亡的功能[5-6]。越来越多的研究发现,RNase不仅具有消化酶的功能,而且还可作为一种有选择性的细胞毒素,具有抗病毒和抗肿瘤等特殊的生物学功能[7]。研究发现,ABCE1 能特异性抑制2-5A/RNase L 信号通路,又名RNase L 抑制因子,从而增强肿瘤细胞蛋白质合成及细胞增殖,促进肿瘤的进展[3]。Huang 等[2]研究发现,在人小细胞肺癌细胞中转染ABCE1基因的siRNA 后能限制肿瘤细胞的增殖、侵袭与迁移,并促使其凋亡。使用ABCE1 特异性shRNA 的慢病毒载体感染人肺腺癌细胞后,细胞生长受到显著的抑制,凋亡率增加[8],上述研究均提示ABCE1基因与恶性肿瘤有着较为密切的关系。
微小RNA(micro RNA,miRNA)是真核细胞中一类参与基因转录后调控的非编码小分子RNA,是一类近年来新发现的非编码小RNA分子,通常成熟miRNA 通过与mRNA 完全或不完全配对,降解靶mRNA 或阻遏其转录后翻译[9]。研究表明,超过50%的miRNA 基因定位于与肿瘤相关的基因组区域或其脆性位点,认为miRNA 在肿瘤的发生机制中扮演着重要作用。多种miRNA 在乳腺癌中低表达并可作为肿瘤抑制基因,如miR-34、miR-125、miR-200、miR-205、miR-328、miR-30、miR-213和miR-203等[10-12]。Cosentino 等[12]首次对乳腺癌疾病患者的癌组织miRNA 表达谱进行了系统性分析,发现这些miRNA 表达异常可能诱发乳腺癌,并在肿瘤的分类及预后评估方面起着重要的作用,如miR-213及miR-203与乳腺癌的发展相关联。随着越来越多miRNA 与乳腺癌相关研究成果的积累,现在更多的关注于miRNA 的靶向调控作为乳腺癌治疗的一个新手段。因此本课题研究ABCE1在乳腺癌发生发展中的作用,并寻找调控其基因表达的miRNA,探讨干预ABCE1基因表达对乳腺癌肿瘤细胞的影响及作用机制。
1 材料
1.1 细胞与试药
乳腺癌细胞株(MCF-7,中南大学湘雅药学院馈赠,来源于中国科学院上海细胞库)。β-actin 抗体(sc-47778)、GAPDH 抗体(sc-47724)、tubulin抗体(sc-23950)(美国santa cruz 公司);山羊抗兔IgG(ZB-2301)、兔抗山羊IgG(ZF-0314)和DAB试剂盒(ZLI-9017)(北京中杉金桥生物技术有限公司);RNA 提取试剂盒、cDNA 反转录试剂盒、RIPA 裂解液(CW2333)和SDS-PAGE 制胶试剂盒(CW0022)(康为世纪);蛋白marker(26616)(Thermo scientific);clone1 试剂盒(CL001)(湖南莱拓福生物科技有限公司)。miR-145 mimic 和miR-145 inhibitor 由吉玛基因(中国)合成;本实验中所用到的引物均由生工生物工程(上海)股份有限公司合成。
1.2 仪器
生物倒置显微镜(日本Nikon 公司),高速冷冻离心机(德国Eppendorf 公司),酶标仪(美国BioTek 公司),凝胶成像分析系统(美国Alpha Innotech 公司),Q-PCR 仪(美国Bio Rad 公司)。
2 方法
2.1 细胞培养和组织样本来源
MCF-7 细胞培养于含体积分数为10%胎牛血清、100 U·mL-1青霉素和100 U·mL-1链霉素的DMEM 高糖培养基中,培养环境为37 ℃、5%CO2条件。
本研究中所用到的组织样本来自南华大学附属第一医院妇产科,选择2015年1月至2017年3月收住院行手术治疗的乳腺癌患者10 例,术前均无放疗、化疗及其他治疗史,患者中位年龄52 岁(31 ~69 岁),均经病理检查确诊。所有患者均为中国汉族人,无亲缘关系,并签署知情同意书,收集上述患者术后乳腺病变组织和癌旁组织,-86℃保存。本研究已获得本院伦理委员会的批准同意。纳入标准:① 乳腺癌患者经病理诊断确诊;② 认知功能正常;③ 知情同意本研究。排除标准:① 有乳腺整形病史患者;② 认知功能障碍患者;③ 伴有严重心肝肾功能不全患者;④ 伴有急性传染病患者。
2.2 Western blot 实验
提取乳腺癌组织和癌旁组织蛋白:将组织称重,分别取约100 mg 组织于研磨器内,加入500 μL 细胞裂解液RIPA 研磨。
提取乳腺癌细胞蛋白:将乳腺癌细胞MCF-7分为3 组,分别是对照组(转染miR-NC,序列为5'-UUCUCCGAACGUGUCACGUTT-3')、miR-145高表达组(转染miR-145 mimic,序列为5'-GUCCAGUUUUCCCAGGAAUCCCU-3')和miR-145抑制组(转染miR-145 inhibitor,序列为5'-AGGGAUUCCUGGGAAAACUGGAC-3')。用预冷的PBS 清洗细胞3 次,小心倾去PBS,并加入RIPA裂解液于冰上孵育30 min。使用RIPA 裂解液分别提取组织和细胞中的总蛋白后,采用BAD 试剂盒测定提取液中蛋白浓度,上样蛋白量为70 μg,蛋白样本与上样缓冲液以1∶4 体积混合均匀,置于100℃水中煮10 min,使蛋白充分变性。待蛋白样本混合物自然冷却后加至凝胶加样孔内,电泳直至溴酚兰到达凝胶底部。
利用转膜装置用湿转法将凝胶上的蛋白质转移到PVDF 上,转膜后用丽春红溶液染膜4 ~8 min,再用去离子水漂洗脱色,观察PVDF 膜上有无蛋白条带出现,以明确转膜效果。将已完成转膜的PVDF 膜浸泡于1%脱脂奶粉中室温封闭1 h。然后用TBST 漂洗PVDF 膜3 次,每次5 min,用相应一抗于37℃孵育1 h,然后将PVDF 膜用TBST 漂洗3 次,每次5 min,加入辣根过氧化酶标记的IgG二抗,于37℃孵育45 ~60 min,TBST 洗膜3 次,每次5 min,然后取出PVDF 膜,沥干残余液体,置于凝胶成像分析系统观察照相并进行灰度扫描。用β-actin 作标准,来表示目的蛋白的相对含量。
2.3 总RNA 提取与荧光定量PCR
采用Trizol 分别提取乳腺组织总RNA 提取和MCF-7 细胞总RNA 提取,核酸蛋白分析仪测量样本的A260和A280值。按逆转录试剂盒说明合成cDNA,置于-20℃保存备用。采用10 μL 反应体系进行目的基因表达分析,实验条件为:50 ℃ 2 min;95 ℃ 5 min;95 ℃ 30 s;60 ℃30 s,40 个循环;Melt Curve 55 ~95℃。实验结果由荧光定量PCR 分析软件自动进行统计和计算。实验中使用引物如下:ABCE1上游引物:5'-GCCCAGTTATGGCAGACAAG-3',下游引物:5'-GTGACAACTCCATAGGCGCT-3';β-actin 上游引物:5'-CTCCATCCTGGCCTCGCTGT-3',下游引物:5'-GCTGTCACCTTCACCGTTCC-3'。根据miRNA-145 成熟体序列5'-GUCCAGUUUUCCCAGGAAUCCCU-3'设计如下引物用于检测细胞内miRNA-145 的表达水平:上游引物:5'-ACACTCCAGCTGGGGTCCAGTTTTCCCAGGA-3';下游引物:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGGGATTC-3'。以U6 作为miR-145 检测的参照miRNA,U6 上游引物:5'-CTCGCTTCGGCAGCACA-3',下游引物:5'-AACGCTTCACGAATTTGCGT-3'。
2.4 MTT 实验
将乳腺癌细胞MCF-7 分为3 组,即对照组(转染miR-NC)、miR-145 高表达组(转染miR-145 mimic) 和miR-145 抑制组(转染miR-145 inhibitor)。收集各组MCF-7 细胞,用完全培养基调整细胞悬液浓度为5×104个·mL-1,在96 孔板中每孔加入100 μL 细胞悬液,每个样本设6 个复孔,边缘孔用无菌PBS 充填,细胞培养24 h 后,每孔加入20 μL MTT 工作液(5 mg·mL-1),培养3 ~4 h 后,弃去培养液,每孔加入150 μL DMSO,继续孵育15 min 后,酶标仪检测490 nm 处各孔的吸光度值(OD)。细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
2.5 psiCHECK-ABCE1-3'UTR 载体构建与鉴定
根据clone1 试剂盒设计ABCE1 mRNA 3'-UTR 插入片段引物,序列如下:上游引物:5'-AT TCTAGGCGATCGCTCGAGTAGACTGACTCTG AGAATAT-3'(Xhol);下游引物:5'-TTATTGC GGCCAGCGGCCGCAGCCATTATTTGCATATT AA-3'(Notl)。从MCF-7 细胞中提取总mRNA,利用上述引物进行PCR 扩增出ABCE1 从终止密码子到3500 位的UTR 序列及两侧Xhol 和Notl的酶切序列区。利用clone1 试剂盒将psiCHECK质粒与PCR 产物进行连接,培养感受态细胞,提取菌液,纯化质粒,-80℃保存备用。
2.6 miRNA 生物信息学分析
通过Target Scans 靶基因预测软件对miR-145的潜在靶基因进行预测,为了降低假阳性,选择至少6 种miRNA 靶标预测工具预测的交集。利用在线软件RNAhybrid 预测miR-145 与ABCE1 mRNA 靶序列的结合自由能。通过TAM 数据库查询miR-145 与疾病的相关性。
2.7 荧光素酶报告基因实验
采用重组质粒psiCHECK-ABCE1-3'UTR 转染HEK293T 细胞,转染前24 h 在500 μL 完全培养基重接种1×105个MCF-7 细胞,待细胞融合度达80%时进行转染。转染步骤分别取1 μg psiCHECKABCE1-3'UTR 质粒和psiCHECK 空质粒用50 μL 无血清培养基稀释。取2 μL 脂质体lipofectamne2000用50 μL 无血清培养基稀释,轻轻混匀,室温下静置5 min。将含有质粒的培养基和含有脂质体的培养基混合在一起,室温下静置20 min。将上述混合物按100 μL/孔分别加到24 孔培养板中,轻轻混匀。将24 孔培养板在CO2培养箱中孵育24 h,转染24 h 后收集细胞采用荧光素酶报告基因检测试剂盒检测荧光素酶活性。
2.8 统计学方法
所有数据采用SPSS 16.0 软件进行分析,t检验用于两个样本间的比较,方差分析用于多个样本均数差别的显著性检验。P<0.05 认为差异有统计学意义。
3 结果
3.1 乳腺癌组织中ABCE1 蛋白及mRNA 的表达
为了确定ABCE1 与乳腺癌的相关性,我们检测乳腺癌组织和癌旁组织中ABCE1 蛋白及mRNA 的表达情况。结果显示,10 例乳腺癌组织样本中ABCE1 蛋白含量明显高于其癌旁组织(P<0.05),但mRNA 的表达水平在乳腺癌组织和癌旁组织间并无明显差异(见图1,2)。

图1 乳腺癌组织和癌旁组织中ABCE1 蛋白的表达情况Fig 1 Expression of ABCE1 protein in the breast cancer and adjacent tissues

图2 乳腺癌组织和癌旁组织中ABCE1 mRNA 的表达情况Fig 2 Expression of ABCE1 mRNA in the breast cancer and adjacent tissues
3.2 生物信息学分析miR-145 对ABCE1 mRNA的靶向作用
乳腺癌组织中ABCE1 蛋白含量明显增加,但其mRNA 水平并未明显改变,提示在乳腺癌组织中可能存在对ABCE1 的转录后调节机制。笔者将ABCE1 mRNA 序列输入miR Base、miR anda、TargetScan 和PicTar 等miRNA 靶标预测网站,以预测靶向调节ABCE1 的miRNA,得到miR-135、miR-29、miR-145 等多个目标miRNA。同样,检索疾病数据库发现乳腺癌组织中miR-145 表达是明显降低的,并且TAM 疾病数据库也显示miR-145 与乳腺肿瘤和细胞增殖能力密切相关(见图3)。进一步分析miR-145 对ABCE1 mRNA 的3'-UTR 序列能较好吻合,且两者结合自由能较低,提示具有较高亲和力(见图4)。因此,上述相关查询结果提示miR-145 对ABCE1 的调控机制可能参与乳腺癌发生发展。

图3 TAM 数据库显示miR-145 与乳腺肿瘤和细胞增殖具有明确的相关性Fig 3 TAM database shows that miR-145 is clearly associated with breast tumors and cell proliferation

图4 ABCE1 mRNA 与miR-145 结合的自由能Fig 4 Free energy of ABCE1 mRNA binding with miR-145
3.3 miR-145 与ABCE1 的结合能力
为了验证ABCE1基因的3'UTR 是否是miR-145 的靶序列,我们将ABCE1基因的3'UTR 片段克隆到荧光素酶报告基因载体psiCHECK 中,构建miR-reporter 载体psiCHECK-ABCE1-3'UTR,将荧光素酶报告载体psiCHECK-ABCE1-3'UTR 分别和miR-145 mimic(miR-145 高表达组)、miR-NC(对照组)共转染HEK 293T 细胞,48 h 后检测荧光素酶活性。结果表明,共转染miR-145 mimic 和psiCHECK-ABCE1-3'UTR 后,荧光素酶活性受到明显抑制(见图5)。说明ABCE1是miR-145 的靶基因。

图5 荧光素酶报告基因实验检测miR-145 与ABCE1 的结合能力Fig 5 Binding ability of miR-145 with ABCE1 by luciferase reporter gene assay
3.4 miR-145 对ABCE1 的调节在乳腺癌细胞凋亡中的作用
为明确miR-145 对ABCE1 的靶向调节作用对乳腺癌细胞凋亡的影响,我们检测了乳腺癌组织和癌旁组织中的miR-145 的表达情况。结果显示,乳腺癌组织中miR-145 表达水平显著降低(见图6)。然后,在乳腺癌细胞MCF-7 中通过外源转染miR-145 mimic 和miR-145 inhibitor 分别上调或下调细胞内miR-145 水平。结果表明,与miR-145 抑制组相比,miR-145 高表达组能够显著抑制ABCE1 蛋白表达(见图7)。此外,MTT 实验结果表明转染miR-145 的MCF-7 细胞存活率显著低于miR-145 抑制组细胞(见图8)。
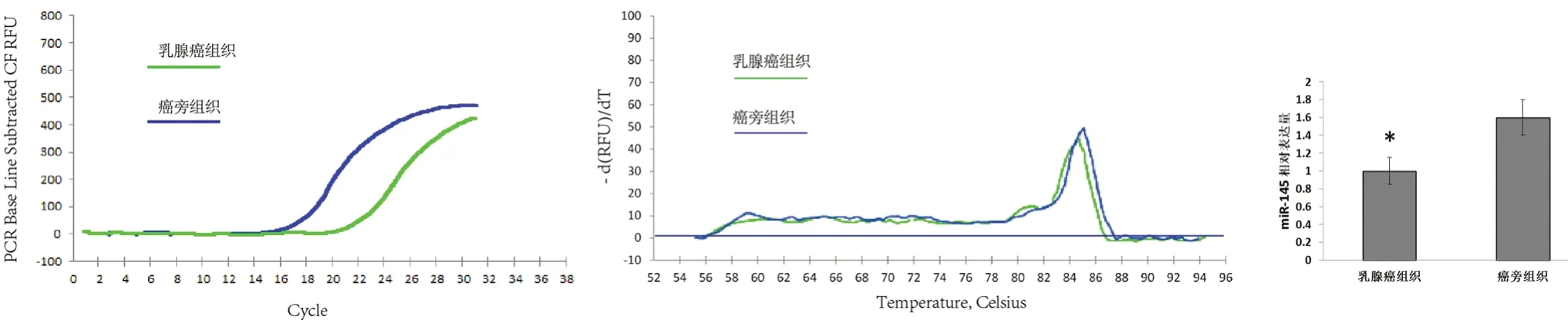
图6 乳腺癌组织与癌旁组织中miR-145 的表达差异Fig 6 Expression differences of miR-145 in the breast cancer tissues and adjacent tissues

图7 miR-145 对乳腺癌细胞MCF-7 中ABCE1 蛋白表达的影响(n =3)Fig 7 Effect of miR-145 on the expression of ABCE1 in MCF-7 cells(n =3)

图8 miR-145 对MCF-7 细胞增殖能力的影响(n =3)Fig 8 Effect of miR-145 on the proliferation of MCF-7 cells(n =3)
4 讨论
临床上乳腺癌的治疗主要通过手术、放化疗等[13],但不可避免地给患者带来了极大伤害,且后续治疗对身心均有不利影响,因此深入研究乳腺癌的发病机制,从中寻找可供应用的治疗靶点将有益于临床治疗。
肿瘤细胞的代谢过程如转录、翻译都异常亢进,RNase L 能通过切割RNA 抑制肿瘤细胞的转录,被认为是肿瘤治疗的重要分子靶点。ABCE1在多种肿瘤组织中高表达,是肿瘤发生的关键基因,其编码的ABCE1 蛋白是一种RNase L 抑制因子,通过抑制RNase L 发挥促肿瘤细胞增殖的作用。本研究发现,乳腺癌组织中ABCE1 蛋白含量明显高于癌旁组织,提示其与乳腺癌的发生密切相关。然而,ABCE1 mRNA 的表达水平在两组间并无明显差异,说明在乳腺癌组织中存在着对ABCE1 的转录后调节机制。我们通过多种miRNA 靶标预测软件发现ABCE1 的3'-UTR 含有多个miR-145 互补的序列,提示miRNA-145 与ABCE1 之间可能存在调控关系。应用miRNA 靶标预测显示miR-145 与ABCE1 mRNA 的3'-UTR序列能较好吻合,提示miR-145 与ABCE1 mRNA的结合特异性较高。采用RNAhybrid 和PicTar 在线网站发现miR-145 与ABCE1 mRNA 结合自由能较低,提示两者具有较高的亲和力。这些均说明miR-145 对ABCE1 靶向抑制是一种普遍存在的生理性调节。我们通过在乳腺癌细胞MCF-7 中外源转染miR-145 mimic 和miR-145 inhibitor 分别上调或下调细胞内miR-145 水平,证实了miR-145 mimic 能抑制MCF-7 细胞中ABCE1 的表达,同时促进细胞凋亡。此外,荧光素酶报告基因实验也显示miR-145 与ABCE1 mRNA 具有结合能力,这些结果进一步证实miR-145 对ABCE1 蛋白表达存在靶向调节作用。
综上所述,本研究筛选出乳腺癌组织内能够有效靶向ABCE1 mRNA 的miR-145。通过外源性增加miR-145 能够抑制ABCE1 的表达,进而取消ABCE1 对2-5A/RNase L 信号的阻滞,有利于RNase L 促进乳腺癌细胞的凋亡。因此,miR-145 及其调节的ABCE1基因可能作为新的突破口,为乳腺癌的诊治提供新的作用靶点。
