基于核心素养的高三化学深度复习课例研析
——以“离子反应”为例
2022-08-08郑文昌
郑文昌 曹 星
一、背景分析
传统的高三化学第一、二轮复习通常缺少基于学情、以提升学科核心素养为目标的、对知识进行整合的深度复习。学生的复习仅停留在对知识的简单回顾,这种浅层次的复习会形成碎片化的知识、肤浅的理解和僵化的思维。而基于核心素养的深度复习是以化学核心素养为复习目标,挖掘课程内容中知识间的逻辑关系,找出这些知识内容在培育学科素养中所蕴含的功能价值,将这些内容优化重组形成复习专题或主题,以真实的情境为载体,以化学知识为解决问题的工具,以提出的实际问题为任务,引导学生主动参与,融入即时性评价,在解决问题的过程中深化对知识的理解,提升核心素养,其教学流程如图1 所示。
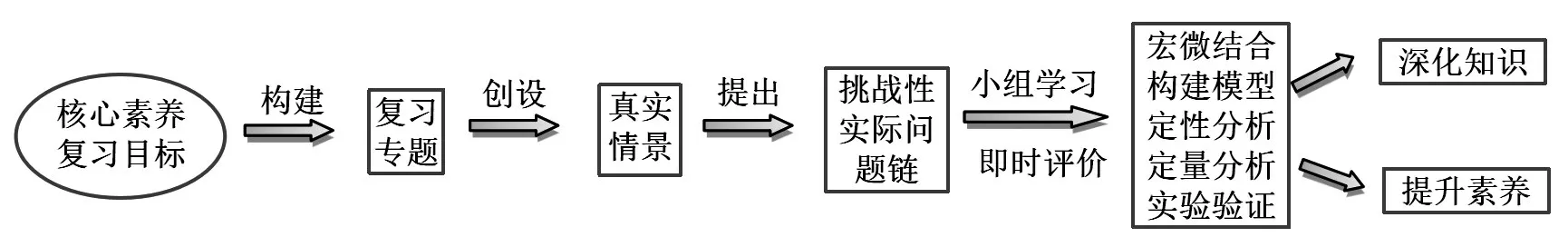
图1 基于核心素养的高三化学深度复习流程图
科学教育的主要目的是培养和发展学生的认识素养。当一个学生具备良好的化学认识素养,他就能从客观世界(复杂的社会现象和生活问题)抽取认识阀,对化学问题进行多角度分析,形成认识思路,养成学科能力。
“离子反应”是从微观视角认识化学反应本质的重要核心概念,是培养学生“宏观辨识与微观探析”“变化观念与平衡思想”的重要的知识内容。经过前期的学习与复习,学生基本掌握了“离子反应”相关知识,如电解质、非电解质等概念的辨析,离子方程式的书写,离子共存等问题,对于平衡(电离平衡、水解平衡、沉淀溶解平衡)问题也比较熟悉。然而在复习过程中发现,学生在解决实际化学反应问题时不能主动从“平衡观”“微粒观”“变化观”的视角来分析化学问题,不能基于新的问题情境定性和定量地分析化学反应的动态变化,存在化学认识素养的欠缺。“宏观辨识与微观探析”“变化观念与平衡思想”是化学学科认识世界的重要视角,对“离子反应”的深度复习,有利于提升学生的认识素养。
二、复习目标的制定
(一)复习目标制定依据
1.基于“离子反应”课程内容特点分析。从“离子反应”课程内容(见表1)来看,主要涉及平衡(电离平衡、水解平衡、沉淀溶解平衡)问题,其中蕴含着平衡观、微粒观、变化观、量变引起质变等学科观念,对该知识内容的深度复习可使离子反应核心观念结构化(见图2),有利于培养学生“宏观辨识与微观探析”“变化观念与平衡思想”核心素养,提升认识素养。

图2 离子反应核心观念结构图
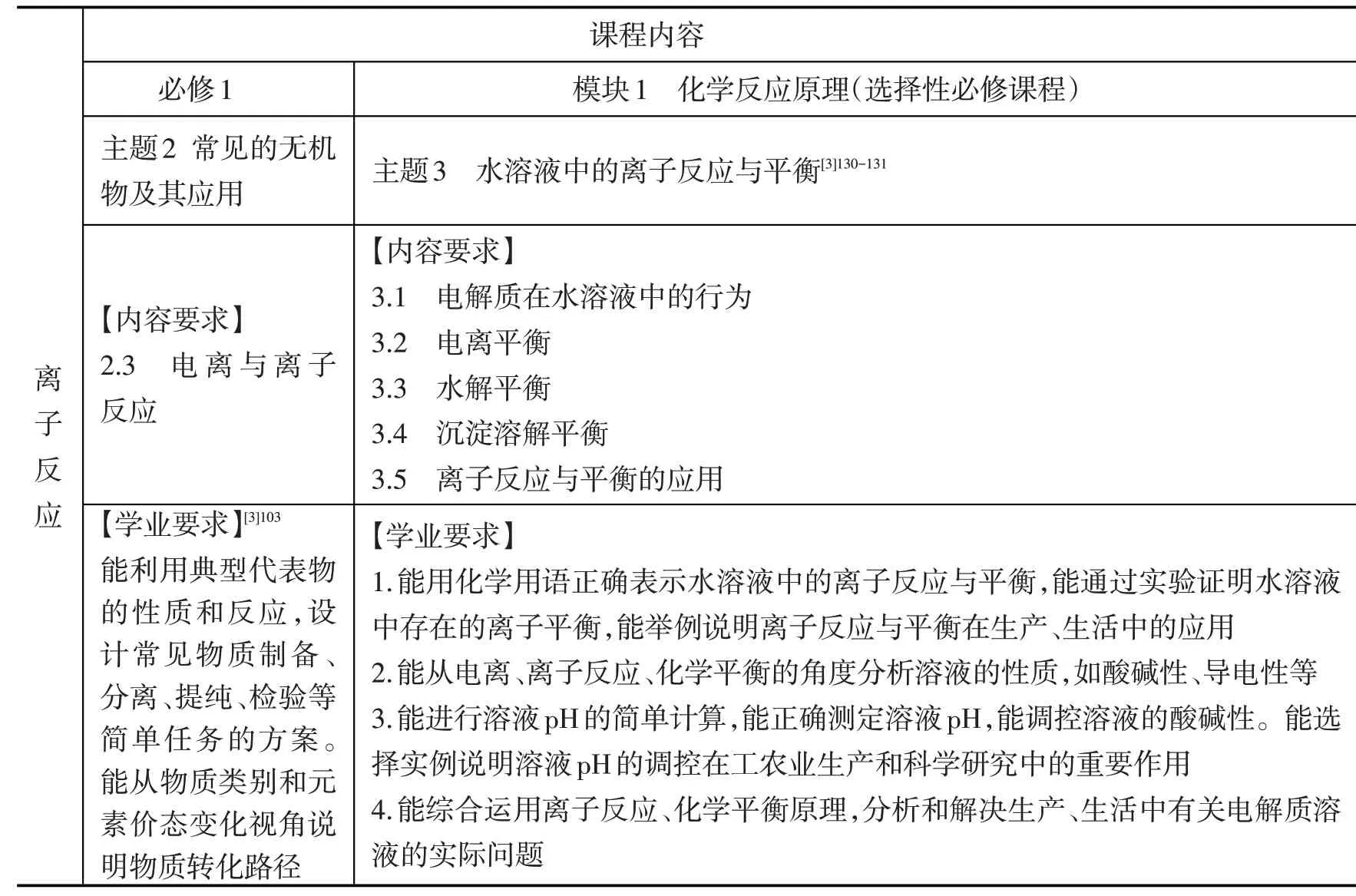
表1 《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课标》)“离子反应”课程内容及学业要求
2.基于“离子反应”与素养水平关联分析。根据《课标》(2017年版)附录1 对化学学科核心素养水平的划分,对“离子反应”与素养水平的关联进行了整理(见表2)。学业质量水平2是高中毕业生在本学科应该达到的合格要求,是化学学业水平合格性考试的命题依据,学业质量水平4 则是化学学业水平等级性考试的命题依据,本课复习目标的确定主要是以化学学业水平4 为依据。

表2 “离子反应”与素养水平的关联
3.基于学情进行分析。经过前期的复习,学生对离子反应及平衡知识比较熟悉,对“离子共存”“离子方程式的书写”及利用平衡知识解决简单的常规问题比较熟练,但是学生在解决化学实际反应问题时不能主动从“平衡观”“微粒观”“变化观”的视角来分析,不能从不同视角认识化学变化的多样性,不能运用对立统一思想和定性定量结合的方式来分析生产、生活实际中的化学变化。
(二)复习目标
1.通过典型的“离子共存”问题的讨论,诊断学生“离子反应”知识关联的程度,完善知识关联,使“离子反应”知识的关联结构化。
2.通过综合运用离子反应,从动态平衡、微粒、定性与定量等视角分析和解决生产、生活中有关电解质溶液的实际问题,建立“离子反应”结构化的认识思路,拓展认识视角。
3.通过检测练习的讨论,诊断和评价应用“离子反应”结构化认识思路来解决问题的情况,运用对立统一思想和定性定量相结合方式来分析实际化学反应问题,提升学生认识素养。
三、教学过程
(一)在解决典型习题的过程中促进“离子反应”知识关联结构化
设置任务情境1,通过任务1 的讨论,让学生自我发现知识储备的不足,主动完善知识结构,使“离子反应”知识关联结构化。
【任务情境1】下列离子组在溶液中都不能·大量共存,请同学们分析每组离子发生了哪类反应导致离子不能共存。
A.Fe、SCN、I、KB.K、Al、SO、MnO
C.H、NO、Fe、NaD.Cu、NH、Br、OH
【学生活动】分析每一选项中离子不能大量共存的原因,小结“离子反应”涉及的反应类型。
【教师活动】针对学生回答中存在的问题,用追问的方式引导学生发现自己储备知识的不足。
【学生活动】构建“离子反应”涉及的反应类型及常见的氧化剂、还原剂、弱电解质、难溶物、配合物等知识。
【教师活动】以追问的方式引导学生思考:为什么题目中强调“大量”?H与OH会反应生成弱电解质水,为什么水溶液中H与OH会“共存”?让学生深刻体会:“离子反应”的本质是离子的种类或数目发生了改变,它涉及到平衡移动等理论知识。
【学生活动】构建“离子反应”知识关联结构模型,如图3 所示。

图3 离子反应知识关联结构模型
【教师评价】对学生构建的知识关联模型给予点评、完善。
(二)在真实情境中设计问题链,在解决问题中促进认识思路结构化、核心观念结构化
抓住“强制弱”“弱制强”的典型案例,设置梯度任务情境3、4、5,并根据任务情境设计层层深入的问题链作为学习任务,引导学生从定性与定量两个方面来分析离子反应,让学生从变化观、平衡观、量变引起质变的视角来认识离子反应,构建离子反应的认知思路。
【任务情境2】在试管1 和试管2 中分别加入2 mL 蒸馏水,在试管1 中加入少量粉末后试管中出现浑浊。
【学习任务1】试管1 中有Ca吗?请设计实验来验证,并用沉淀溶解平衡的方程式来解释原因。
【学生活动】预测试管1 是否有Ca,设计实验验证,书写沉淀溶解平衡的方程式。

【任务情境3】在上述的试管1 中滴加盐酸,浑浊变澄清。
【学习任务2】请同学们从沉淀平衡移动的视角定性分析加入盐酸后CaCO浊液变澄清的原因。
【学生活动】宏观现象微观探析:从平衡移动的视角分析CaCO溶于盐酸的离子反应。
【教师评价】学生是否有宏观辨识与微观探析的自觉性,与学生一起构建碳酸钙溶于盐酸的微观探析模型,如图4 所示。

图4 碳酸钙溶于盐酸定性微观探析模型
【学习任务3】请大家从与角度定性分析碳酸钙溶解的原因。
【学生活动】定性讨论加入盐酸前后与的大小,确定碳酸钙沉淀溶解平衡移动的方向。
【教师活动】加入盐酸之前,=(Ca)×(CO)=,加入盐酸后,>,平衡向溶解的方向移动。
【学习任务4】已知:(CaCO)=2.8×10,HCO的=4.4×10、=4.7×10。请大家从平衡常数的角度定量分析碳酸钙溶解的原因。
【学生活动】思考、计算、讨论。
【教师活动】如果不考虑碳酸分解,可根据下面反应来计算平常数:

可见,在碳酸钙浊液中加入盐酸,生成了碳酸,此时平衡常数已经很大;若碳酸分解,反应生成二氧化碳和水,平衡常数会更大,所以碳酸钙可以溶解在盐酸中。
【学习任务5】碳酸钙可溶于强酸盐酸中,是否也能溶于醋酸等其他弱酸中?我们可以从哪些视角进行分析?
【学生活动】思考、讨论。
【教师活动】我们可以从与、平衡常数的视角定性和定量分析平衡移动的可能性,从而判断碳酸钙是否可溶解于其他弱酸中。当然,反应可能受到酸的浓度等其他条件的影响,有兴趣的同学可在课后进行讨论。
【教师活动】上面我们讨论的盐酸与碳酸钙反应生成碳酸、碳酸不稳定分解生成二氧化碳和水,其反应都属于“强制弱”中强酸制弱酸的范畴。那么,弱酸能否制强酸呢?溶解度小的物质能否转变成溶解度大的物质呢?
【任务情境4】演示实验:把硫化氢气体通入硫酸铜溶液中,有黑色固体生成。
【学习任务6】观察实验现象,分析反应产物,写出反应的化学方程式和离子方程式。
【学生活动】观察、思考,书写反应化学方程式和离子方程式。
【教师评价】评价学生书写的化学方程式和离子方程式,追问:硫化氢为弱酸,为什么可以用它制备强酸硫酸呢?
【学习任务7】请同学们从离子反应及平衡移动的视角定性分析HS 制备HSO的可能性。
【学生活动】思考、讨论。
【教师评价】从反应Cu+HS=CuS↓+2H可知,铜离子促进了HS 在水溶液中的电离,通过图5 的微观分析模型体会铜离子促进HS 可能电离彻底的微观过程。
【教师追问】从CuSO+ HS = CuS↓+ HSO可知,CuS 不溶于强酸硫酸中。图5 从定性的视角分析反应的可能性说服力不够,同学们能否从化学平衡常数的视角定量分析反应的可能性呢?

图5 硫酸铜与硫化氢反应的微观分析模型
【信息提示】298K 时,(CuS)=1.27×10,HS 的=9.1×10,=1.1×10。
【学生活动】思考、讨论、计算。
【教师评价】根据Cu+HS=CuS↓+2H,可以计算其平衡常数如下:
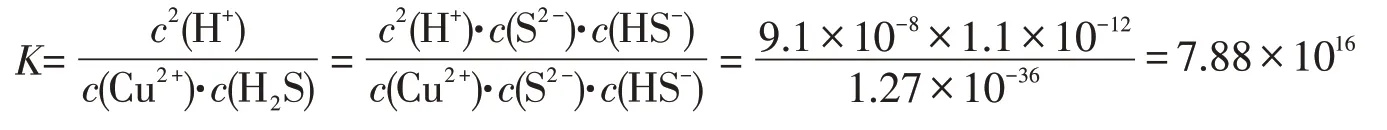
平衡常数=7.88×10,很大,所以硫酸铜溶液与硫化氢气体反应可以制得硫酸。
【学习任务8】HS 通入CuSO溶液中可制得硫酸,那么,HS 通入FeSO溶液中能否制硫酸呢?SO通入BaCl溶液中能否制盐酸?我们可以从哪些视角进行分析和思考?
【学生活动】思考、交流讨论、分享讨论结果。
【教师评价】我们可从平衡移动、平衡常数的视角分析反应的可能性,再进行实验验证。
【学习任务9】CuS 不溶于强酸硫酸中,请分析其溶解于强酸硝酸的可能性,并设计实验验证。
【学生活动】思考、交流讨论,实验验证。
【教师评价】同学们讨论很深入,说明你们逐渐学会了从微观及平衡移动的视角来分析离子反应。在CuS 中加入硝酸,硝酸把硫离子氧化成硫单质,促进平衡向溶解的方向移动,其微观探析模型如图6 所示。
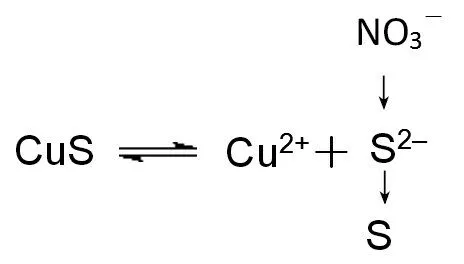
图6 CuS溶于硝酸微观探析模型
【任务情境5】重晶石(主要成分是BaSO)是制备钡盐的重要原料,但是BaSO不溶于酸,可用饱和NaCO溶液将其转化为可溶于酸的BaCO。在298K 时,(BaSO)=1.07×10,(BaCO)=2.58×10。
【学习任务10】请用离子方程式来表征沉淀转化的过程,分析(BaSO) = 1.07 × 10<(BaCO)=2.58×10,为什么BaSO可以转为BaCO的原因。
【学生活动1】书写离子方程式,定性分析生成BaCO沉淀的原因。
【学生活动2】计算比较BaCO的与的关系,定量分析BaSO转化成BaCO的原因。
【教师评价】从图7 可知,虽然BaSO的浊液中Ba浓度很小(通过计算可知),但是加入的饱和碳酸钠溶液中CO浓度较大,可能会导致BaCO的>,所以会有BaCO沉淀的生成,促进BaSO的溶解。

图7 BaSO4转化成BaCO3微观探析模型
【教师追问】为什么碳酸钠溶液要用饱和的?如果用稀的碳酸钠溶液行不行,其中隐含着什么样的辩证关系?
【师生小结提升】离子反应是从微观的视角表征化学反应,更容易反映化学反应的本质。离子反应在水溶液中进行,往往存在动态平衡,我们应从变化观、平衡观的视角来分析离子反应,可以构建如图8 所示的认知模型。
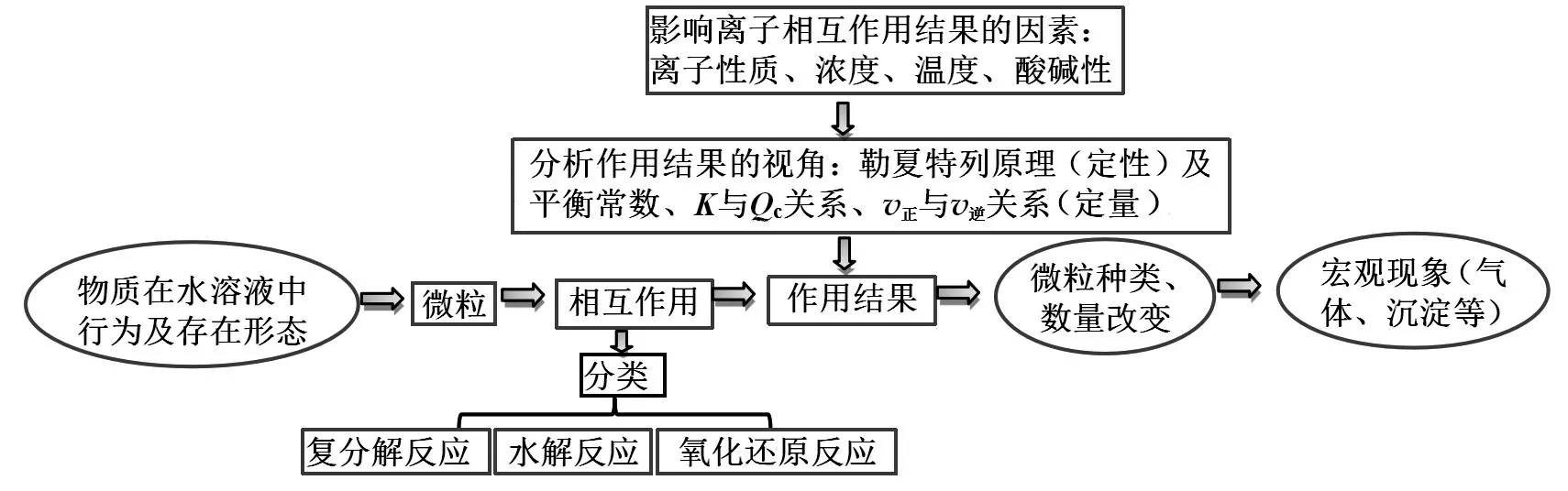
图8 离子反应认识思路结构化模型
(三)设计课堂教学评价问题,检测学生相关素养的形成
1.设计的“教学评价问题1”使用了教材中“弱制强”的案例,通过讨论、分析、计算,让学生思维外显,评价学生能否从变化观、平衡观的视角定性、定量来分析离子反应。
【教学评价问题1】《化学1》(2014年苏教版第6 版)第44 页有这样的一个描述:在空气中,漂白粉中的次氯酸钙与水蒸气、二氧化碳发生反应,生成次氯酸与碳酸钙,其化学方程式为CO+ HO + Ca(ClO)= CaCO↓+ 2HClO。有同学查文献发现,在298K 时(HClO) = 3× 10,(HCO) = 4.3 × 10,(HCO) = 5.6 × 10。该同学认为,(HClO) = 3 × 10>(HCO)=5.6×10,生成物应该是Ca(HCO)才对。请同学们讨论教材是不是弄错了,为什么?(提示:(CaCO)=4.96×10)
2.设计的“教学评价问题2——在Co的作用下促进了HCO自偶电离”,可了解学生有没有分析思路,考查学生认识离子反应的视角,评价学生“宏观辨识与微观探析”的素养。
【教学评价问题2】高考题(节选2013年全国新课标I 卷27 题第4 小题)回放:沉钴工艺流程如图9 所示,请写出沉钴的离子方程式,并从离子反应层面微观探析产物产生的过程。
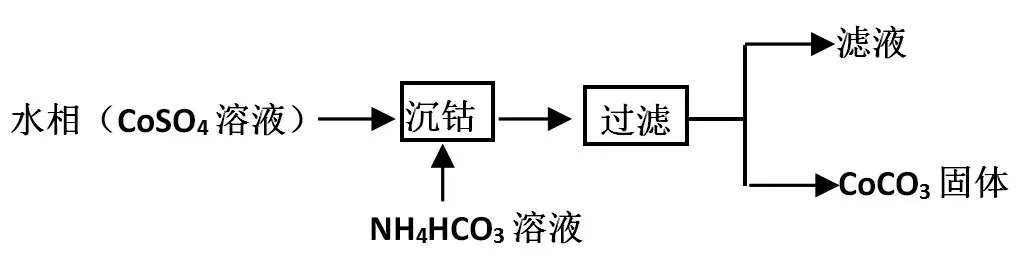
图9 沉钴工艺流程图
虽然有些同学能正确写出该化学方程式:Co+2HCO=CoCO↓+CO↑+2HO,实际上却是根据质量守恒和电荷守恒来写的。此题要求学生应能根据微观探析模型来书写离子方程式,如图10 所示。

图10 微观探析模型与离子方程式
3.设计的“教学评价问题3”涉及水溶液反应体系中多离子的相互竞争平行反应问题,要求学生能从微观视角构建反应历程,检测学生在认识离子反应时能否形成“变化观”“平衡观”“微粒观”及“对立统一”的辩证认识思路,评价学生“宏观辨识与微观探析”的核心素养。
【教学评价问题3】高考题(2019年全国I 卷26 题节选)回放:硼酸(HBO)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含MgBO·HO、SiO及少量FeO、AlO)为原料生产硼酸及轻质氧化镁的工艺流程如图11 所示,请写出在“沉镁”中生成Mg(OH)·MgCO沉淀的离子方程式并从微观视角构建反应过程。

图11 沉镁的工艺流程图
四、教学反思
(一)深度复习,促进复习内容结构化
教学内容结构化,有利于促进学生从化学学科知识向化学学科核心素养的转化,而内容的结构化则是实现这种转化的关键。
1.促进知识关联结构化。本节课在教学过程(一)中以常见的离子共存问题为引子,引导学生讨论“离子共存问题与哪些知识关联”,追问“离子共存问题为什么强调‘大量’,为什么H与OH会反应生成水而不能共存,但是在水溶液中却又同时存在H和OH”等问题,让学生深刻体会离子反应是个动态反应,离子反应与平衡知识紧密关联,建构离子反应知识关联结构模型,促进知识关联结构化。
2.促进认识思路结构化。在教学过程中,以碳酸钙与盐酸反应、漂白粉与漂白液暴露在空气中变质等常见的真实情境为载体,创设实际问题链,引导学生从“宏微结合”“平衡移动”“定性与定量”相结合的视角再认识常见的化学反应问题,让学生深刻领悟离子反应其实就是平衡移动的结果。拓展认识视角,建构离子反应结构化的认识模型,提升学生认识素养。
(二)“教、学、评”一体化,促进认识素养提升
在复习过程中,教师不是自导自演的“满堂灌”,而是以学生在学习过程中遇到的实际问题为真实情境,“旧事重提”,设计新的问题链,引导学生从不同的视角分析解决“旧情境”中的新问题。采用追问与点评的教学方式,一环扣一环,把即时性评价嵌入“教”与“学”的过程中。特别是学生构建离子反应认识思路后,设置了教学评价问题环节,边练边评,以获得复习目标达成的实证,实现“教、学、评”一体化。在整个教学过程中,引导学生构建离子反应知识关联,构建微观探析认知模型,促进学生认识思路结构化,提升学生认识素养。
