新型甜味剂阿洛酮糖绿色生物制造工艺研究进展
2022-08-06王琪彭超周卫强唐堂何太波裴成利梁颖超武丽达李凡李义佟毅
王琪,彭超,周卫强,唐堂,何太波,裴成利,梁颖超,武丽达,李凡,李义,佟毅*
(1.中粮营养健康研究院有限公司,北京 102209;2.营养健康与食品安全北京市重点实验室,北京 102209;3.老年营养食品研究北京市工程实验室,北京 102209;4.中粮生物科技股份有限公司,安徽蚌埠 233010;5.玉米深加工国家工程研究中心,吉林长春 130033)
随着经济的快速发展,我国居民生活水平不断提升,膳食结构方面也出现了较大的变化,导致糖尿病、肥胖和心脑血管等疾病的发病率不断攀升。国际糖尿病联盟2017年统计数据显示,中国拥有高达1.14亿成人糖尿病患者,占世界成人糖尿病患者总数的25%以上,位居世界第一[1]。此外,近年来我国肥胖率和超重率逐年增长且均处于较高水平,张兴华等[2]通过对2002—2019年采集的115个族群中6万多名成人体质指标进行质量指数分析发现,男性和女性超重比分别高达29.6%和30.0%,肥胖率高达11.8%和14.0%。日益升高的疾病发生率引起了人们对于饮食健康的密切关注,同时随着人们生活品质的提高,人们对于食物口感也有了较高的标准,寻求口感好热量低的甜味剂逐渐成为人们的重要需求点。稀有糖是自然界存在的稀少单糖及其衍生物,有益于人体健康,且具备独特功能。其中,稀有糖中的阿洛酮糖是一种低热量甜味剂,在自然界中的含量极少,一般存在于小麦、水果和各种其他食物中。阿洛酮糖拥有70%的蔗糖甜度,热量却只有蔗糖的0.3%[3-4]。D-阿洛酮糖不仅甜度适中、热量极低,还具有降血糖、抗炎、神经保护和免疫抑制等多种药理功效。微生物法合成D-阿洛酮糖是指在微生物菌株内表达酮糖3-差向异构酶,包括D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPE)或D-塔格糖3-差向异构酶(D-tagatose 3-epimerase,DTE),它们以果糖作为底物进行催化,进而产生D-阿洛酮糖(图1),因此酮糖3-差向异构酶是微生物法合成D-阿洛酮糖的关键酶。本文综述了微生物法生产阿洛酮糖的绿色制造工艺的研究进展,主要包括阿洛酮糖特性及功能,生产阿洛酮糖关键酶的特性,菌株构建、发酵生产工艺及分离纯化和结晶工艺,以期为阿洛酮糖的后续研究和工业生产提供技术支持。
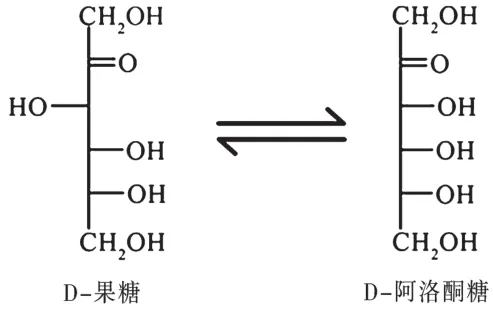
图1 果糖与阿洛酮糖异构关系图
1 阿洛酮糖生理功能及机制研究进展
阿洛酮糖在缓解改善糖尿病、降血脂、保护心脑功能等方面都有重要的生理作用。PRATCHAYASAKUL等[5]研究发现D-阿洛酮糖可以减轻脑氧化应激,降低脑线粒体活性氧的产生及海马细胞凋亡,改善脑胰岛素不敏感性和海马细胞突触功能障碍,从而改善糖尿病前期大鼠的学习过程。PONGKAN等[6]开展了D-阿洛酮糖对肥胖诱导的胰岛素抵抗大鼠的心脏和心脏线粒体功能影响的研究,发现3%D-阿洛酮糖降低了大鼠体重、内脏脂肪、血浆胆固醇,在心率变异性和减轻心脏线粒体功能障碍方面具有一定的疗效,最终能够使心脏功能得到改善。IWASAKI等[7]的研究表明D-阿洛酮糖会诱导胰高血糖素样肽1受体激动剂GLP-1释放,进而激活迷走神经的传入信号,减少食物摄入并提高葡萄糖耐量,因此阿洛酮糖可通过迷走神经传入来控制进食和高血糖,从而改善暴饮暴食所致的肥胖和糖尿病。GOU等[8]研究发现,D-阿洛酮糖可以通过减少促炎细胞因子的产生来调控脂联素分泌,增强肌肉中的胰岛素信号和Glut-4表达进而减轻Wistar大鼠HFD诱导的胰岛素抵抗。在改善肥胖方面,WEI等[9]研究发现,D-阿洛酮糖还可以通过在特定条件下促进肌细胞的凋亡来改善肥胖,D-阿洛酮糖对C2C12(小鼠生肌细胞)没有直接毒性,然而在低剂量H2O2诱导的细胞内活性氧(ROS)存在下,D-阿洛酮糖诱导C2C12细胞损伤并以剂量依赖性方式显著降低C2C12细胞活力,进而使细胞凋亡水平和ROS的产生增加,而线粒体膜电位(MMP)降低,最终对肌肉细胞产生毒性作用。在控制脂代谢方面,HAN等[10]的研究表明5%的阿洛酮糖可以通过降低小鼠小肠中CD36、ApoB48、FATP4的mRNA表达来降低血浆和肝脏脂质,同时升高粪便脂质,还能够通过脂质调节酶活性使肝脏脂肪酸合成酶和β-氧化活性下降,使得饮食性肥胖的代谢状态正常化。LEE等[11]研究阿洛酮糖对C57BL/KsJ db/db小鼠的高血糖、高胰岛素血症、糖尿病和炎症反应的影响时发现,阿洛酮糖可以显著增加肝葡萄糖激酶的活性,降低肝磷酸烯醇丙酮酸羧化激酶和葡萄糖-6-磷酸酶的活性。此外,D-阿洛酮糖还能有效降低血浆和肝内的甘油三酸酯和游离脂肪酸水平,降低肝脂肪酸氧化和肉碱棕榈酰转移酶活性,降低血浆中促炎性脂肪因子和细胞因子的水平等方式来综合改善脂质和糖代谢。综上,阿洛酮糖主要是作为激活剂等引发细胞内进行一系列的信号转导,从而对脂代谢和血糖代谢通路等起到一定的调控作用。
2 阿洛酮糖的生产工艺简述
D-阿洛酮糖的制备方法主要包括了生物转化法和化学法等。其中,化学法是通过环转换合成法、催化加氢法和加成反应法等化学手段来制备阿洛酮糖的方法,此类方法成本高且立体选择性较差,具有一定的化学污染,因此应用受限。利用一种或多种酶催化底物生成目标产物的生物转化法由于具有反应条件温和、低毒环保、环境相容性好等优势已经成为目前阿洛酮糖合成的主流方式。生物法生产阿洛酮糖的工艺主要涵盖了D-阿洛酮糖差向异构酶基因挖掘与筛选、用于生产D-阿洛酮糖差向异构酶的工程菌株构建、菌株的发酵优化及扩大培养、所得菌株中酶的提取分离、酶促反应将果糖转化成D-阿洛酮糖、D-阿洛酮糖的分离纯化以及产物结晶,最终得到高纯度的阿洛酮糖晶体。其中,菌株构建与酶的表达、产物分离纯化及结晶等是关键环节,阿洛酮糖的具体生产工艺流程如图2所示。
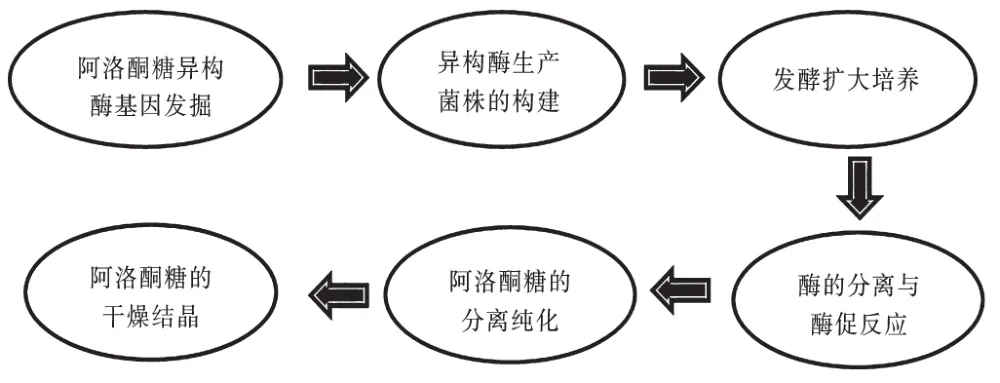
图2 生物法合成阿洛酮糖的工艺流程
2.1 阿洛酮糖生产相关酶的来源与性质
酮糖3-差向异构酶(KE)可逆催化酮糖之间的差向异构化,将酮糖转化为阿洛酮糖,因此是生物法生产阿洛酮糖的有效工具。目前不同微生物来源常用酶根据底物的不同主要分为D-阿洛酮糖3-差向异构酶和D-塔格糖3-差向异构酶,国内外学者陆续发现了来自不同菌株的D-阿洛酮糖3-差向异构酶和D-塔格糖3-差向异构酶(如表1所示)[12-18]。
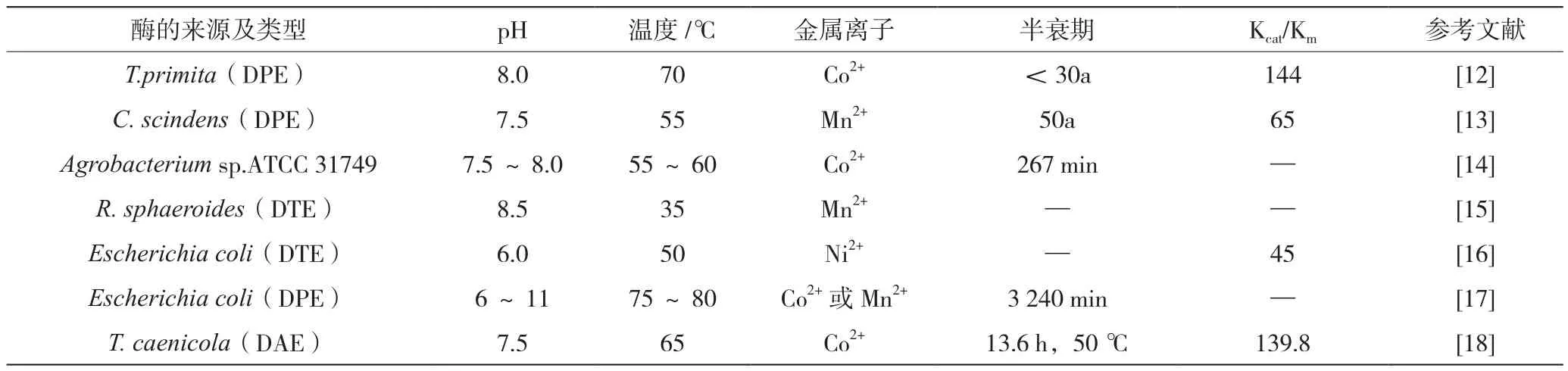
表1 不同来源的阿洛酮糖差向异构酶性质的比较
由表1可以看出,两种酮糖3-差向异构酶大多依赖于金属离子Co2+和Mn2+,Co2+离子适宜pH一般在7.5~8.0,适宜温度在50~70℃,Mn2+离子适宜pH一般在7.5~8.5,适宜温度在35~55℃,且对D-果糖具有良好的催化活性。WANG等[16]开发的Escherichia coli来源的金属依赖性酶是为数不多的对Ni2+显示出最高活性的酶,较低浓度的Ni2+能够使酶提高耐热性。该酶表现出较为宽泛的pH和温度范围,在pH值为6.0、温度为50 ℃条件下活性最大,达到30%的转化率。QI等[15]发现的R. sphaeroide来源阿洛酮糖差向异构酶在低温下催化反应效果最好,最佳温度为35 ℃,而当温度>40 ℃时活性开始下降。而PATEL等[17]开发的差向异构酶在高温(75~80 ℃)时表现出最佳的催化效果,在最佳条件下,700 mg/mL D-果糖的酶促处理能产生约217 mg/L的D-阿洛酮糖。工业生产中阿洛酮糖高产需要高酶活的阿洛酮糖差向异构酶,因此开发高催化活性的酶仍然是现阶段的难点。
2.2 阿洛酮糖差向异构酶生产工程菌株的表达体系
目标酶的表达离不开宿主菌体,将所发掘的不同来源的阿洛酮糖异构酶基因序列片段连接到载体上,再将载体导入到宿主菌株中进行发酵培养,才能实现阿洛酮糖差向异构酶的表达,因此发酵菌株的构建及酶表达是生物法生产阿洛酮糖工艺中的关键环节。阿洛酮糖差向异构酶生产中常见的表达体系主要包括枯草芽孢杆菌、大肠杆菌和酵母菌。
2.2.1 枯草芽孢杆菌表达体系
枯草芽孢杆菌是自然界中广泛存在的一种产芽孢革兰氏阳性菌,其安全性好,既不含内毒素也不分泌外毒素,被美国食品药品监督管理局(Food and Drug Administration,FDA)认定为生物安全菌株。枯草芽孢杆菌由于具备一定的蛋白分泌能力,在发酵工业生产中常被用来生产异源蛋白,且在α-淀粉酶、β-甘露聚糖酶、人类白介素-3和脂肪酶等产品生产上已经获得突破[18-19]。目前,枯草芽孢杆菌也常被用于表达阿洛酮糖差向异构酶的菌株载体,且已有诸多枯草芽孢杆菌表达阿洛酮糖差向异构酶的相关研究。贾敏等[20]将利用聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增后的阿洛酮糖3-差向异构酶基因与枯草芽孢杆菌载体pMA5连接,构建出重组质粒,在质粒转入枯草芽孢杆菌(Bacillus subtilis,WB800)感受态细胞中经筛选鉴定得到了D-阿洛酮糖差向异构酶重组菌株。研究表明,该菌株产生阿洛酮糖差向异构酶最适pH为7.0,其中最适温度为55 ℃,18 h时酶活可达6.8 U/mL。温宇威等[21]以枯草芽孢杆菌为宿主,在克隆了D-阿洛酮糖3-差向异构酶基因后,将基因的上游加入了P43启动子,再将形成的特定基因序列连接到pMA5载体上构建出双启动子表达DPE家族酶的表达系统,结果发现重组高效表达的DPE的最适温度为55 ℃,最适pH为7.0,在温度30~40 ℃和pH 6.5~7.5范围内稳定性好,以D-阿洛酮糖为底物对应的Km为26.68 mmol/L,催化效率 Kcat/Km为 95.8 L/(mmol·min)。CHEN 等[22]将瘤胃球菌属的阿洛酮糖差向异构酶在枯草芽孢杆菌中成功表达,在比较3种糖诱导型启动子后,发现了木糖诱导型启动子PxylA生产阿洛酮糖差向异构酶是最有效的启动子。基于诱导物浓度和阿洛酮糖差向异构酶表达的分析,推测细胞内阿洛酮糖差向异构酶表达与木糖积累水平间的相关性,在经过分析优化后将最佳木糖诱导浓度从4.0%降低到0.5%,此时阿洛酮糖差向异构酶在7.5 L发酵罐中补料分批发酵的表达水平达到了95 U/mL和2.6 g/L。孙帆等[23]对来源于解纤维素梭菌的阿洛酮糖差向异构酶基因在枯草芽孢杆菌中进行产酶活性研究,发现在3 L发酵体系中高密度发酵的终点酶活可高达495 U/mL,得到高表达量阿洛酮糖差向异构酶的发酵液,以硅藻土-海藻酸钠为材料对发酵液的重组细胞进行固定化研究,发现连续反应多批次后转化率仍然为28%,且可保持残余酶活为81%。FU等[24]从瘤胃球菌中克隆了D阿洛酮糖3-差向异构酶,并在枯草芽孢杆菌A311中表达。发酵调控方法采用两步pH分段调节方法,即发酵前24 h维持发酵液pH值为7.0,后24 h维持pH值为7.5,该方法显著提高了阿洛酮糖差向异构酶产量并降低了发酵成本,结果表明阿洛酮糖差向异构酶产量为74 U/mL,是对照组的2.5倍。综上,枯草芽孢杆菌-阿洛酮糖差向异构酶构建及表达体系日趋成熟,菌株的构建方法及发酵的调控方式呈现多样化,表达的阿洛酮糖差向异构酶均维持在较高水平。
2.2.2 大肠杆菌表达体系
大肠杆菌不但成本低廉、繁殖较快,而且外源蛋白的表达量较高,同时也具备了利于同位素标记技术应用以及适用范围广等诸多优势,因此常被应用于外源蛋白表达研究。目前,大肠杆菌被用于阿洛酮糖差向异构酶的载体表达的研究已取得一定的进展,周卫强等[25]对异源表达D-阿洛酮糖3-差向异构酶工程大肠杆菌在5 L罐进行发酵培养,并系统探究了该菌株表达D-阿洛酮糖差向异构酶的诱导工艺,结果表明诱导后温度25 ℃、pH 7.0、IPTG诱导剂浓度0.5 mmol/L为发酵工艺的最优条件,发酵所得阿洛酮糖差向异构酶在酶促反应30 min平衡转化率可达28%左右。PARK等[26]研究发现,在Terrific Broth(TB)培养基中培养重组大肠杆菌细胞24 h时,表达来自根癌农杆菌的双位点变体(I33LS213C)D-阿洛酮糖3-差向异构酶的比活性较高,24 h后重组大肠菌株中粗蛋白和阿洛酮糖差向异构酶的表达含量分别为37.0%和8.6%。通过研究发现重组大肠菌株在60 ℃、pH 8.5、细胞浓度为4 g/L和果糖700 g/L条件下最有利于用D-果糖生产D-阿洛酮糖,大肠菌株酶促反应40 min可产生230 g/L D-阿洛酮糖,转化率为33%,容积生产率为345 g/(L·h),比生产率为86.2 g/(g·h)。袁堂国等[27]构建了异源表达Flavonifractor plautiiD-阿洛酮糖3-差向异构酶的重组大肠杆菌用于转化果糖,以实现D-阿洛酮糖的全细胞生物合成。结果表明,pH 7.5、65 ℃为重组菌株酶解反应最优条件,且在不添加金属离子时,半衰期达到2.7 h;D-果糖水溶液中加入浓度为2.4 g/L菌液反应,所得D-阿洛酮糖的浓度为231 g/L,转化率可达33%,在体系额外加入硼酸根离子后,D-阿洛酮糖终浓度可提升至378 g/L,转化率高达63%。温俊婷等[28]尝试在大肠杆菌Rosetta(DE3)体系中分别过表达D-阿洛酮糖3-差向异构酶、L-鼠李树胶糖激酶(RhaB)和多聚磷酸盐激酶(PPK),并将3种酶偶联生产阿洛酮糖并计算产率。结果显示,将DPE和RhaB双酶偶联反应,在pH 8.5、温度35 ℃,DPE和RhaB酶量比为1∶2,且加入微量Mg2+条件下反应最优,此条件下的阿洛酮糖得率可高达70%;将DPE、RhaB和PPK 3酶偶联进行反应,ATP浓度降低80%,反应成本得到进一步降低,但D-阿洛酮糖得率仅为50%。综上,大肠杆菌易遗传改造且便于发酵培养,是目前生产阿洛酮糖差向异构酶等的重要宿主菌株,通过代谢工程策略的不断研究会更加理性地改造大肠杆菌菌株,这将为生物法高效生产阿洛酮糖提供更新的工艺。
2.2.3 酵母菌表达及催化体系
酵母表达系统有众多品质优良的宿主菌株,其不仅经济节约、耐热性优异,且能利用多种能源物质,还能快速提高密度并产生蛋白。随着研究的不断深入,酵母菌株也逐渐被应用于阿洛酮糖差向异构酶的表达场所或是提供D-阿洛酮糖差向异构酶催化的场所。朱星星等[29]采用基因工程手段将连有D-阿洛酮糖3-差向异构酶基因的载体在马克斯克鲁维酵母工程菌株中高效表达,并进行全细胞反应条件优化及酶学特性研究,研究表明浓度为10 g/L的马克斯克鲁维酵母菌株最优催化条件为温度55 ℃、pH 8.0,此条件下可将750 g/L的D-果糖催化产生190 g/L的D-阿洛酮糖。LI等[30]利用酿酒酵母孢子固定了来源于嗜热细菌和根癌农杆菌的木糖异构酶和D-阿洛酮糖差向异构酶,接着在孢子固定化酶的催化作用下完成从底物D-葡萄糖到D-阿洛酮糖的转化,最高转化率达到12.0%。综上,酵母菌不仅在表达阿洛酮糖异构酶上具有一定优势,作为进行下游酶促反应的场所来固定酶也可以实现阿洛酮糖的高产。
2.3 阿洛酮糖的分离纯化
通过菌株发酵培养表达得到的阿洛酮糖差向异构酶,以果糖作为底物,在一定的反应条件下通过对果糖异构化的催化反应从而得到D-阿洛酮糖。但由于阿洛酮糖3-差向异构酶催化果糖的异构化反应属于可逆反应,化学反应平衡时仍混有果糖,因此需要进一步进行阿洛酮糖的分离纯化。但阿洛酮糖和果糖这两种糖互为差向异构体,其物理性质、化学性质十分相近,因此分离难度很大,目前常采用色谱分离法进行分离,其中主要包括离子交换树脂和模拟移动床色谱等。
(1)模拟移动床分离具有自动化程度高、分离效率高、操作费用小等优势,常用于糖工业的分离。如任世阔等[31]通过移动床色谱对混有葡萄糖、果糖及低聚糖的糖混合液进行分离,获得质量分数大于80%的阿洛酮糖溶液。冉淦侨等[32]利用D-果糖与固定化D-阿洛酮糖差向异构酶纳米微球反应,制备D-阿洛酮糖与果糖的混合液,在脱色预处理后将混合液按照顺序式模拟移动床的特定分离参数进行分离,得到的D-阿洛酮糖溶液的纯度超过99%,回收率超过95%。由此可见模拟移动床分离效率高,有助于阿洛酮糖的连续化生产。
(2)离子交换树脂操作简便、分离速度快,不使用有毒有害的有机萃取剂及溶剂,性能稳定、可反复使用,因此也被应用于阿洛酮糖的分离。LI等[33]使用葡萄糖异构酶和葡萄糖氧化酶以果糖作为底物进行分步酶催化反应,在阿洛酮糖和果糖的混合糖液中的果糖转化为葡萄糖酸后,利用离子交换树脂将葡萄糖酸分离出去,最终得到纯度为91.2%的阿洛酮糖。邢庆超等[34]采用阴(阳)离子交换树脂将生物法得到的D-阿洛酮糖进行脱色脱盐,接着采用DTF-Ca2+型离子交换树脂进行后续分离纯化,研究发现柱温为60 ℃、进样量为10 mL、流速为1 mL/min时分离效果最佳,经液相色谱检测,发现分离产物中D-阿洛酮糖纯度可达98.3%。
(3)还可以利用生物发酵法纯化阿洛酮糖。酿酒酵母在有氧环境下能够以混合糖液中的D-葡萄糖或D-果糖为能量来源生成二氧化碳,同时对D-阿洛酮糖含量没有明显影响,汪俊卿等[35]依据此原理开发出一种提高混合糖液中阿洛酮糖含量的方法,该方法既能够除去D-葡萄糖和D-果糖,又能除掉阿洛酮糖加热浓缩中产生的色素,大幅提高了阿洛酮糖的纯度。
2.4 阿洛酮糖结晶工艺
经分离纯化后的阿洛酮糖经过干燥结晶工艺才能得到易于贮藏的阿洛酮糖晶体,受热的阿洛酮糖易发生玻璃化转变,因此结晶难度较大,难以通过加热干燥等方式制得干品,是目前制约阿洛酮糖在贮存运输方面的关键问题。郭元亨等[36]尝试在乙醇体系中优化阿洛酮糖的结晶,研究发现在D-阿洛酮糖溶液密度为1.35 g/mL、D-阿洛酮糖溶液与乙醇比例为1.0∶3.8、结晶时间325 min、结晶温度25 ℃的结晶条件下对阿洛酮糖进行初次结晶,收率可达71.58%。在常规的结晶工艺中,阿洛酮糖溶液饱和浓度高、黏度大,导致结晶困难、晶型细小、晶体分布不集中以及阿洛酮糖收率较低等问题。杜倩等[37]采用蒸发结晶法和降温结晶法相结合的阿洛酮糖结晶方法,依次经过蒸发结晶、整晶与降温结晶过程最终制备得到了阿洛酮糖晶体,其晶体目数分布集中,且80%以上的晶体尺寸均在40~60目。目前,阿洛酮糖结晶工艺较为烦琐,如何将工艺化繁为简,减少有机试剂添加量,进一步提高阿洛酮糖结晶度,获得大小形状合适的晶体,将是提高阿洛酮糖晶体纯度的关键,因此结晶工艺仍有很大的瓶颈需要突破。
3 结语
随着生活品质的提高,人们对于健康饮食的关注度日益增大,我国人口基数庞大,对于功能糖产品的需求量很高,因此阿洛酮糖具有很大的市场开发潜力。但目前阿洛酮糖的生产技术仍存在一些技术壁垒,较难实现工业化生产,其主要原因有以下几点:(1)差向异构酶活较低,要加大菌株研发力度,构建出稳定产出高酶活值的菌株,阿洛酮糖结晶难度大,目前结晶相关的研究,突破难度大;(2)阿洛酮糖的生产大多以果糖为底物,果糖成本较高,开发低廉的菌株发酵配方将有助于降低阿洛酮糖的工业生产成本;(3)我国阿洛酮糖法规申报工作滞后,市场拓展方面有欠缺。相信随着国家对阿洛酮糖生理功能研究和临床试验探索的逐步深入以及法规申报制度的日益完善,阿洛酮糖生产工艺会得到进一步的提升,它将逐渐走入人们的生活,走上百姓的餐桌。
