噬菌体展示技术开发兔源抗体的工艺优化
2022-08-06孔星
孔星
(上海拓兴生物科技有限公司,上海 200000)
20世纪80年代,Smith在丝状噬菌体的pⅢ基因中插入了外源基因,使之可以与pⅢ基因融合,并展示在噬菌体表面,该系统最大的特点即把外源基因和噬菌体scFv联系在一起,淘选到scFv也就等于淘选到了表达scFv的基因,因此可以利用此技术制备特异性抗体[1]。本文中应用的是丝状噬菌体展示系统中的pⅢ展示系统,噬菌体scFv在M13KO7辅助下感染大肠杆菌,经过多轮“结合—洗脱—扩增”筛选,可富集到大量特异性的噬菌体抗体,经过免疫学试验检测,基因工程方法构建至真核表达载体中,表达出完整的抗体IgG[2]。本文选取CDT1蛋白为研究靶点,CDT1蛋白为DNA复制过程中复制复合体,与其他蛋白一起调节DNA的再复制,因前期采用杂交瘤等技术没有开发成功,此次选用噬菌体展示技术尝试开发并对工艺流程进行了优化,具有优化方案有以下两点[3]。(1)优化了兔源抗体基因序列的扩增引物,通过优化个别碱基以及加入保护碱基,保证了抗体基因库的完整性和多样性,以保障足够的库容量去淘选特异性抗体。(2)在最后一轮淘选后,噬菌体scFv分样于96孔板中,并通过增加免疫印迹试验检测,对scFv的特异性和亲和性进行深入筛选,以提高获取完整抗体IgG的产率和准确率。
1 材料与方法
1.1 材料与试剂
多肽,吉尔生化(上海)有限公司合成;引物,铂尚生物技术(上海)有限公司合成;mRNA提取试剂盒,KR107,天根生化科技(北京)有限公司;Taq酶,KT201,日本Takara公司;pCANTAB5E质粒,上海拓兴生物科技有限公司保存,来源于瑞典Amersham公司;2×YT培养基,北京索莱宝科技有限公司;M13KO7辅助噬菌体,美国Thermo Fisher公司;氨苄青霉素和卡那霉素,生工生物工程(上海)股份有限公司;小鼠抗M13-g8p抗体,英国Abcam公司;FreeStyle™293表达系统,美国Thermo Fisher公司;MabSelect SuRe蛋白A层析填料,美国GE Healthcare公司。
1.2 仪器与设备
EDC-810型PCR仪,北京东胜创新生物科技有限公司;Multiskan FC型酶标仪,美国Thermo Fisher公司;X1R型离心机,美国Thermo Fisher公司。
1.3 制备scFv基因库
以CDT1蛋白(蛋白号:Q9H211)设计抗原序列(CHITARLAHQTRAEEGL)免疫兔子。5次免疫,确定抗体有效价后,血液及脾脏里的B淋巴细胞均作为模板提取mRNA。分子生物学操作技术均参照《医学分子生物学实验技术》[4]。
本文对所使用的引物分两次设计。首先根据已有的兔源抗体基因以及上传至NCBI上的序列作序列比对,在恒定区域内找出完全一致的序列区域,在区域内随机截取了10段序列作引物作首次扩增引物测试,满足引物的设计标准,在PCR结果中选取最干净最亮的作为备选引物,在这对引物的基础之上,删减或增加碱基以及添加保护碱基来增加引物扩增效率。根据所设计的引物,重链引物名称为HCF1、HCR1,轻链引物名称为LCF1、LCR1,进行首次扩增,以上述DNA片段为模板再次设计引物。用100种已知序列的DNA序列作为模板,用第1次设计的引物扩增,PCR结果送去测序,以此来验证引物扩增效率。第2次分别扩增出VH和VL(重链和轻链的可变区域),重链引物名称为HCF2、HCR2;轻链引物名称为LCF2、LCR2。PCR扩增程序:95 ℃,30 s;60 ℃,30 s;72 ℃,60 s;40个循环,分别回收DNA片段。第3次PCR扩增无需引物,以第2次扩增获得的VH和VL基因为模板,PCR扩增程序与上述一致,扩增出带有SfiI和NotI酶切位点的VH-VL片段(中间含linker),随后插入到准备好的pCANTAB 5E载体中,成为scFv文库。引物序列见表1。

表1 引物序列
1.4 噬菌体表面展示文库的构建
为了最大化地扩充库容量,将上述构建的scFv基因库多次转化TG1感受态细胞,次日用细胞刮刀刮下LB(Luria-Bertani Broth)固体琼脂板上所有的菌落,接入含有氨苄青霉素的50 mL 2×YT培养基中,37 ℃培养3 h至对数期,此时可以表达F性鞭毛。加入M13KO7(1×1011pfu/mL),37 ℃培养 1 h,14 000 r/min离心10 min,重悬沉淀于200 mL 2×YT培养基中(含有氨苄青霉素和卡那霉素),37 ℃过夜培养。将过夜的培养液14 000 r/min离心15 min,200 mL的上清加入 50 mL PEG/NaCl(20%PEG-8 000,2.5 mol/L NaCl)溶液并放置于冰上1 h。14 000 r/min离心30 min,倒掉上清。用5 mL PBS悬浮沉淀,即得噬菌体scFv文库。将所得文库做梯度稀释 1×10-4、1×10-6、1×10-8、1×10-10和1×10-12,测定噬菌体scFv文库的滴度。
1.5 特异性scFv的筛选
将CDT1蛋白的抗原溶于PBS溶液里,包被在高亲和力细胞培养皿中,为淘选到亲和力高的scFv,后两轮的包被抗原量逐渐降低。次日加牛血清蛋白(Bovine Serum Albumin,BSA)封闭,洗去封闭液后加入上述步骤的噬菌体scFv文库,室温孵育2 h,用含吐温的PBS溶液洗掉未结合的噬菌体(每一轮漂洗20次),用100 mmol/L TAE(Tris-Acetic-EDTA)缓冲液洗脱结合在抗原上的噬菌体,溶于Tris-HCl缓冲液后再次感染处于对数生长期的TG1细胞,取小样稀释一定的梯度测定被洗脱出来噬菌体侵染的细菌个数(测定滴度)。对数生长期的TG1细胞培养3 h后,经M13KO7超感染,次日离心回收上清,通过沉淀、吸附以及洗脱得到重组噬菌体抗体次级库并测定其滴度(具体步骤同噬菌体表面展示文库的构建)。重复吸附-洗脱-扩增过程3次,得到富含对CDT1蛋白有亲和性的噬菌体scFv抗体四级库。对每一轮筛选均测定文库滴度以及富集率,作为特异性噬菌体scFv富集的指标,富集率的计算公式如下:

1.6 特异性scFv的检测
上述噬菌体scFv抗体四级库,取50%低温保存于甘油中,剩余的在M13KO7辅助感染下,产生五级库。上清液稀释在96孔高亲和力酶标板中,取少量上清液做酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)检测,上清加入到包被多肽的酶标板中反应1 h,PBST(PBS-Tween-20)洗涤3次,加入小鼠抗M13-g8p抗体和HRP标记羊抗小鼠二抗,室温孵育1 h,经底物TMB(四甲基联苯胺)显色后,于波长450 nm测定OD值,高于阴性值5倍的视为阳性。选择293细胞作免疫印迹试验样本,随机挑选上述OD值最高的10孔检测,加入小鼠抗M13-g8p抗体和HRP标记羊抗小鼠二抗,室温孵育2 h,经ECL发光底物曝光,有主带的视为阳性,记下阳性孔的编号。免疫学操作均参照《免疫学技术及其应用》[5]。
1.7 完整抗体的表达和检测
上述步骤的阳性孔的噬菌体感染处于对数生长期的TG1细胞,铺于琼脂板上过夜,第二天挑取10个菌落,接种于2×TY培养基中,37 ℃培养3 h,取2 μL作为模板,分别扩增重链和轻链,回收DNA片段后插入到准备好的真核表达载体中(包含抗体恒定区),酶切鉴定质粒正确后转入生产。抗体生产体系使用FreeStyle™系统。细胞上清液用Protein A亲和纯化抗体。抗体保存于PBS缓冲液中,浓度定在1 mg/mL。选择HeLa细胞作为免疫荧光试验样本,使用带有FITC的二抗,二抗稀释比例参照使用说明书。
2 结果与分析
2.1 scFv基因库的构建
用已知的100种DNA序列作模板,通过PCR第一次扩增,测序结果显示,扩增准确率为100%。两次PCR扩增出抗体的VH和VL,VH长度在370 bp,VL长度在380 bp,连接后的VH-linker-VL长度在750 bp,连入载体后,经过酶切鉴定,条带位置正确。
2.2 噬菌体表面展示文库滴度测定
为了便于试验操作和计算,把每一轮的投入克隆数都调成8×1012。表2显示每一轮的富集率是逐渐提高的,为了提高淘选的亲和力,后两轮的包被抗原量逐渐减少,洗脱下来的噬菌体scFv滴度明显增加,第4轮富集率为第1轮富集率的80倍,表明在淘选过程中噬菌体scFv得到很大程度富集。

表2 滴度测定和富集率
2.3 特异性噬菌体scFv的鉴定
经ELISA检测后,有10孔以上的阳性孔,表明噬菌体scFv具有特异性和亲和力。挑选OD值高的孔做免疫印迹试验。图1为选取其中一孔的试验结果,箭头处即为蛋白位置,与生物信息学预测相一致。图中总体稀释比偏低,且有杂带,与单链抗体只有一个识别区域有关系,与完整抗体相比,scFv的特异性相差无几,但是亲和力不足,如果将此scFv转换成完整抗体后,特异性不变,亲和力增加,就可以证明scFv转换成完整抗体是成功的。
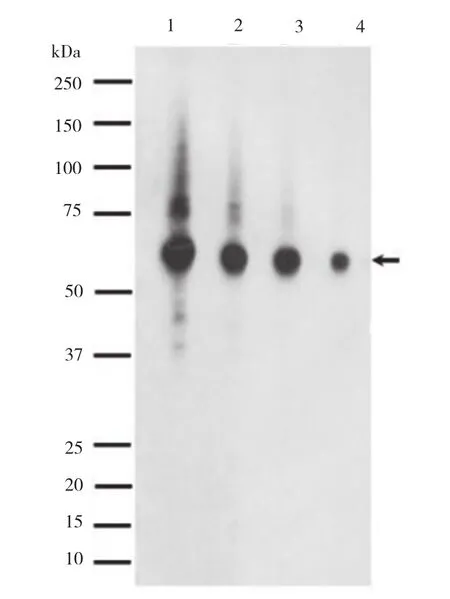
图1 scFv免疫印迹试验结果
2.4 完整抗体免疫学试验
将上述scFv用PCR方法转换成完整抗体后,经酶切鉴定,插入片段大小正确。通过真核表达系统生产,亲和纯化后,ELISA检测后确定有特异性完整抗体。用HeLa细胞作样本,进行免疫荧光试验,图2显示蛋白定位于细胞核中,与生物信息学预测相一致;每个细胞均与抗体结合上,颜色较亮(DAPI染色HeLa细胞核显蓝色,FITC标记的二抗显绿色),表明亲和力较高,证明了此scFv转换成完整抗体是成功的。
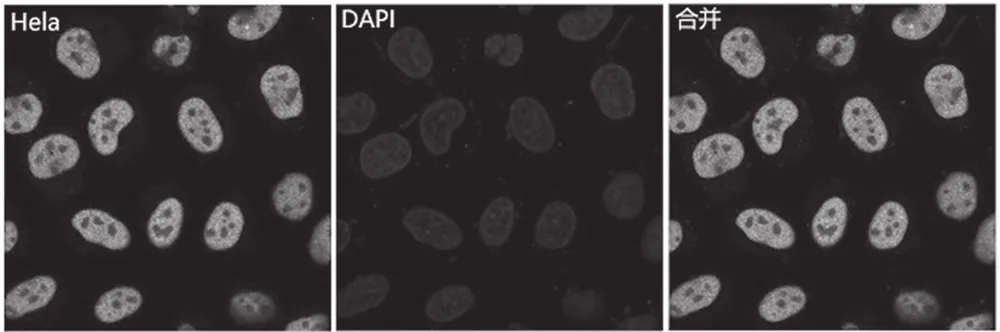
图2 完整抗体免疫荧光试验
3 结论
本文概述了噬菌体展示技术筛选兔源抗体的工艺流程,其中包括两方面优化方案。优化后的方案,首先在建文库阶段就最大化地囊括了抗体基因,让筛选到特异性抗体的概率大大提高;其次在检测阶段加入了免疫印迹试验,相当于进一步地去筛选特异性抗体,让scFv转换成完整抗体后,抗体检测时成功率更高。此方案绕过了杂交瘤等传统方法,直接获得抗体基因,但是想要扩增出所有的抗体基因,还需要对引物持续优化改造。
该方案成功运用噬菌体展示技术筛选到了具有特异性和亲和力的兔源单克隆抗体,但同时存在不足不处,科研工作者可以从生物体内淘选到特异性的scFv,因为工作需求还需将此scFv转换成完整抗体IgG,但是从结构和功能上来看,scFv与完整抗体IgG是有差异的,scFv不能等同于完整抗体。这就造成了淘选到的scFv最后转换成完整抗体时,检测结果与scFv阶段不一样,甚至特异性都发生了变化,造成转换后的完整抗体IgG不能使用。出现这种情况,只能再次筛选保存起来的scFv文库或者宣告试验失败,增加了时间和试验成本。因此就目前来看,此方案暂时还不能做为单克隆抗体筛选的主要方式,可以作为备选方案。当传统方法没有筛选到特异性的抗体,可以用备份的脾脏或血液尝试噬菌体展示技术,筛选特异性抗体。
