滇黄精的组织培养研究
2022-08-06伍灿明刘春凉
伍灿明,刘春凉
(玉林师范学院,广西玉林 537000)
滇黄精(Polygonatum kingianumColl. et Hemsl.)系百合科(Liliaceae)黄精属(Polygonatum)多年生草本植物,主要分布在云南省、广西壮族自治区等地,生长在海拔2 000~3 900 m的阴湿林地和灌木丛中[1],其根状茎、种子等器官均可作为外植体。前人对丛生芽诱导增殖和生根培养的研究较少,且增殖系数和生根系数均不理想。本文以种子诱导萌发的幼苗为材料,并不断优化丛生芽诱导增殖培养基和生根培养基,以提高丛生芽增殖及和生根系数,为滇黄精种苗快速繁育提供依据[2-5]。
1 材料与方法
1.1 试验材料
滇黄精果实采自九万大山(东经108°35'32''~108° 48'49'',北纬 25° 01'55''~ 25° 19'54'')的野生材料,滇黄精的果实呈绿色,果实椭圆形、圆形、豆粒大小,大小均匀,色泽光亮。滇黄精种子比较小,被3个心皮包裹在果实内。
1.2 试剂与仪器
6-苄基氨基嘌呤,纯度≥99%,上海泽叶生物科技有限公司;萘乙酸,纯度95%,安阳全丰生物科技有限公司;赤霉素,纯度≥90%,酷尔化学科技(北京)有限公司;所有试剂均为化学纯。
YXQ-LS-75II型高压灭菌锅,上海博讯实业有限公司医疗设备厂;JZ-Ⅱ接种器械灭菌器,济南普朗特生物科技有限公司;SW-CJ-JC型超净工作台,苏州安泰空气技术有限公司。
1.3 试验方法
1.3.1 滇黄精种子的预处理和消毒试验
将滇黄精果实置于流动自来水下冲洗5 h后,先用0.3 g/L高锰酸钾进行表面初步消毒,接着用0.1%赤霉素浸泡8 h打破休眠状态。将预处理的滇黄精果实用75%的酒精浸泡并不停地摇晃30 s,然后用无菌水清洗3~4次;再用0.1%的升汞深度消毒15 min,摇晃,弃去升汞后用无菌水清洗3~4次,再用解剖刀去掉外皮(注意不能伤及种子),接种到初步萌发培养基:MS+NAA 0.2 mg/L+6-BA 0.2 mg/L+活性炭0.2 g/L,培养基中含蔗糖25 g/L、琼脂粉5 g/L,pH=7.0(下同)。每瓶接种6颗种子,处理5瓶,3次重复,40 d后统计污染率和萌发率。
1.3.2 不同光照强度对滇黄精种子萌发的影响
消毒后的滇黄精种子接到不同光照处理和不同浓度NAA外源激素处理的MS培养基中,12 d后观察种子萌发情况。
1.3.3 不同基础培养基对丛生芽诱导的影响
将长势良好的滇黄精幼苗分别接种于不同浓度的6-BA、NAA不同配比外源激素进的MS培养基上,各处理的培养基均加活性炭粉0.5 g/L。每瓶接入4棵幼苗,每个处理8瓶、3次重复,45 d左右统计丛生芽增殖情况。丛生芽的诱导率计算公式如下:

1.3.4 不同NAA浓度对丛生芽诱导的影响
配制6-BA浓度均为0.4 mg/L,以0.2 mg/L为一个梯度设置NAA的浓度梯度的MS培养基,选取长势良好、长有2~3片叶子的滇黄精幼苗,每瓶接入4棵幼苗,每个处理8瓶、3次重复,每10 d记录1次每个培养基中滇黄精幼苗的高度、叶片颜色和丛生芽生长情况。
1.3.5 滇黄精丛生芽生根的初步探究
选取大小相似,生长程度相近的丛生芽接种于加入不同浓度的6-BA、NAA这2种外源激素进行配比的MS培养基,各处理的培养基均加入活性炭粉0.5 g/L。每瓶接种4个根状茎,每个处理接种8瓶,30 d后统计生根情况。
1.4 培养条件
培养室温度调节在23~27 ℃,光照强度在2 000~3 000 Lx,光照时间为14 h/d。
2 结果与分析
2.1 无菌接种与启动培养
滇黄精种子接种到启动培养基后逐渐萌发,培养30 d后,滇黄精种子萌发率可达90%以上,且长势良好。实验证明,以MS+NAA 0.2 mg/L+6-BA 0.2 mg/L+活性炭粉0.2 g/L,pH=7.0为滇黄精种子萌发的启动培养基,有较好的萌发率,能作为滇黄精种子无菌萌发的启动培养基。
2.2 不同光照强度对滇黄精种子萌发的影响
由表1可知,NAA浓度和添加活性炭粉的培养基对种子的萌发具有明显的促进作用,实验表明NAA浓度在0.6~1.0 mg/L,且进行遮光处理的种子萌发率高,萌发速度快。
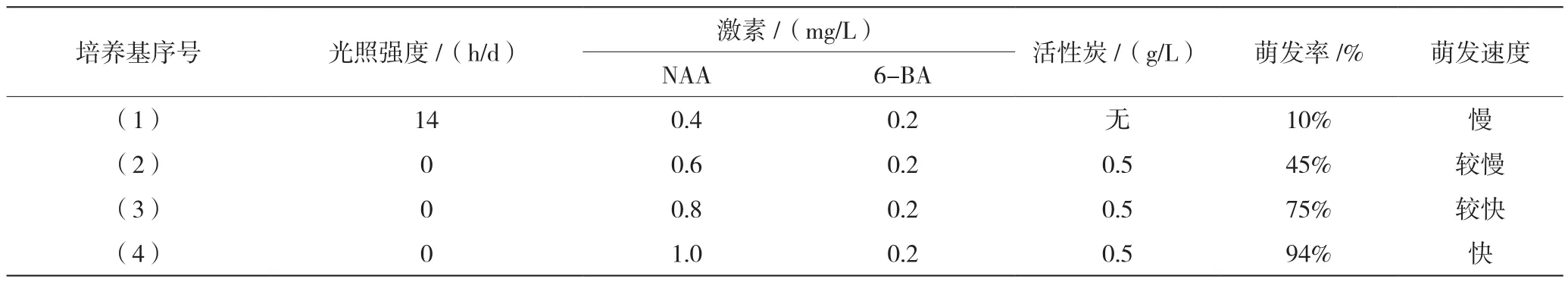
表1 不同光照强度对滇黄精种子萌发的影响
2.3 不同基础培养基对丛生芽诱导的影响
由表2知,3种培养基中丛生芽的诱导率都比较低,而生长速度也缓慢。(1)号和(2)号培养基有部分小苗出现黄叶并逐渐死亡的现象,可能是培养基营养成分已经消耗完全,(3)号培养基中的幼苗均生长良好,但是丛生芽生长速度慢。
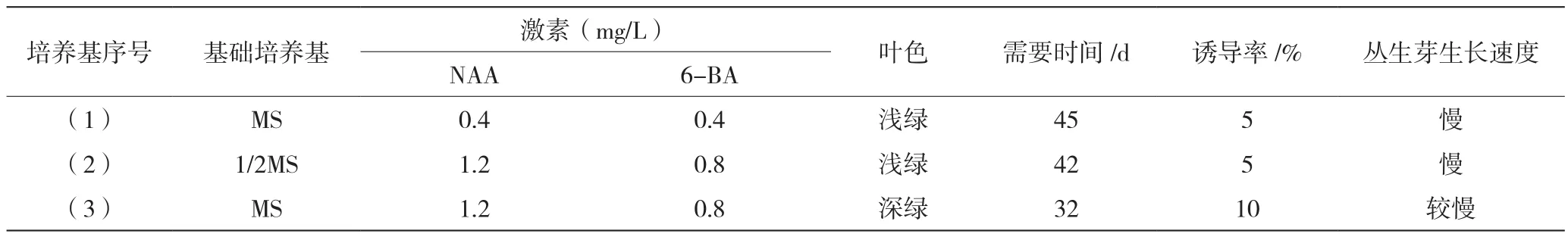
表2 不同基础培养基对丛生芽诱导的影响
2.4 不同NAA浓度对丛生芽诱导的影响
由表3可知,当NAA浓度在0.6~1.2 mg/L时,丛生芽诱导率提高,叶色较好。诱导过程较易出现褐化现象,但除培养基(1)外,本次实验没有出现褐化现象,只有几棵幼苗最后慢慢枯死。从总体来看,丛生芽诱导率还是比较低。后期还需要继续调整NAA和6-BA浓度,进一步探究滇黄精组培苗丛生芽诱导率高的最佳配方。

表3 不同NAA浓度对丛生芽诱导的影响
2.5 滇黄精丛生芽生根的初步探究
从表4实验结果可知,培养基(7)(8)(9)的平均根数最多,而且根的平均长度也较长。滇黄精的根长和根数随着NAA浓度和6-BA浓度的增加而增加,当6-BA为0.8 mg/L,NAA为0.5 mg/L时,滇黄精丛生芽的平均根树最多,平均根长最长。
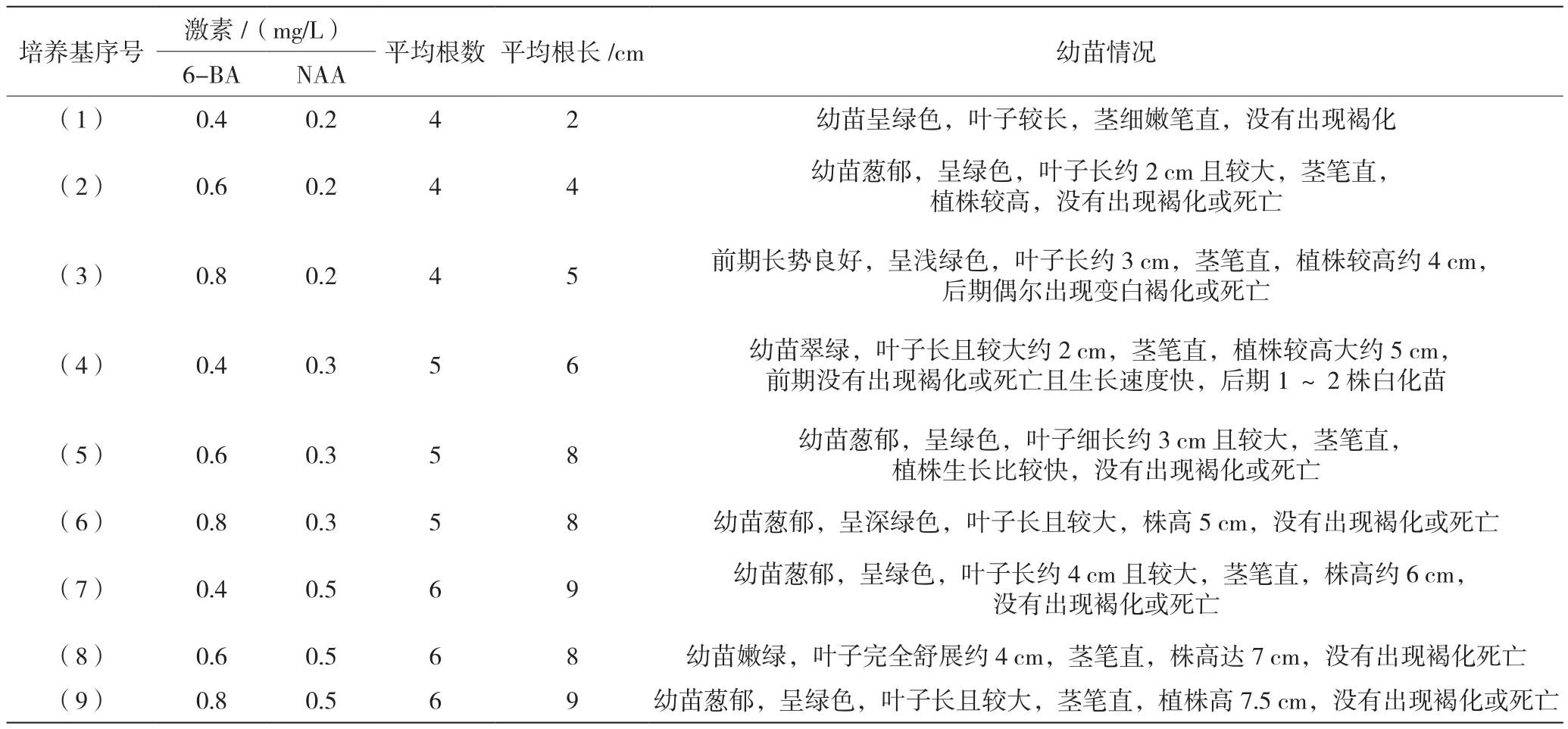
表4 滇黄精丛生芽生根的探究结果
3 结论
先使用75%酒精浸泡消毒30 s,再用0.1% HgCl2浸泡15 min,达到种子污染率为零的效果。在无菌处理前使用赤霉素浸泡8 h可打破种子休眠,促进种子萌发。通过实验证实,MS+6-BA 0.2 mg/L+NAA 0.2 mg/L+蔗糖25 g/L+琼脂5 g/L+活性炭粉0.5 g/L,可作为滇黄精种子启动培养基,添加适量的活性炭粉和遮光处理模拟黑暗环境,可提高种子萌发速度。为避免滇黄精幼苗出现褐化或者死亡,应该及时更换培养基。
当6-BA浓度为0.4 mg/L时,探讨不同NAA浓度对丛生芽诱导的影响发现,各培养基幼苗长势均良好,只有几棵演变为白化苗最终死亡。查阅文献推测,MS培养基大量元素含量高,可能是总盐分、渗透压过高,使得滇黄精出现渗透失水,逐渐死亡。
在6-BA和NAA浓度逐步增加的培养基中,滇黄精的生根率达100%,根的生长更快更自然,幼苗也葱郁健壮。在滇黄精生根诱导中,NAA在0.2~0.5 mg/L,6-BA在0.4~0.8 mg/L有利于根的产生,后期还会进行增加其浓度观察是否会抑制根的生长。
