Fe3O4负载纳米零价铁类Fenton法去除水中2,4-二氯苯酚
2022-08-05钟金魁王新昊包想乐王正新谢欣卓
钟金魁,王新昊,包想乐,王正新,谢欣卓
(1.兰州交通大学 环境与市政工程学院,甘肃 兰州 730070; 2.甘肃省黄河水环境重点实验室,甘肃 兰州 730070)
2,4-二氯苯酚(2,4-DCP)作为重要的化工原料[1],广泛用于农药、医药、化工等领域[2],在生产、运输、使用及处理和处置过程中,都有可能进入环境,进而随地表径流及渗滤作用污染水体和土壤[3].在黄河、淮河、海河等河流中都有检出[4-5].2,4-DCP化学性质稳定,其富集在水体和土壤中的半衰期可达几十年[6].土壤和水体中的2,4-DCP可使农作物减产,对水生生物和人类产生毒害作用,甚至致死[7-9].因此,处理水体和土壤中的2,4-DCP已成为环境科学工作者的紧迫任务[10].
纳米零价铁(nZVI)作为一种新型的环境功能材料[11],因其比表面积大、反应活性高、还原能力强等特点[12],被广泛用于氯酚(CPs)类有机污染物的处理[13].但nZVI也存在对CPs的处理不彻底[14-15],产生中间副产物等其他问题[16].Fenton法是利用Fe2+催化H2O2产生强氧化性羟基自由基(HO·的氧化还原电位为2.8 V),以使难去除的有机污染物彻底矿化为CO2,H2O等小分子物质[18].但传统Fenton法存在诸多弊端[19],如Fe2+的利用率低,反应体系偏酸性[20],且在处理过程中会产生大量铁泥[21-22].因此,研究者们将nZVI与Fenton法结合,充分发挥二者的各自优势,以期达到彻底去除氯酚类污染物的目的[17].
为此,文中首先用共沉淀法和液相还原法制成Fe3O4负载nZVI复合材料(Fe3O4@nZVI),然后将其与Fenton法耦合,构建Fe3O4@nZVI 纳米类Fenton体系,既克服了nZVI易团聚和氧化的困难,也很好地解决了传统Fenton技术铁泥量大,材料无法回收利用的难题,以期为废水中2,4-DCP的去除提供参考和依据[23].
1 材料与方法
1.1 实验试剂
六水合三氯化铁(山东双双化学试剂有限公司);七水合硫酸亚铁(天津凯信化学工业有限公司);硼氢化钠(国药集团化学试剂有限公司);高纯氮气(兰州裕隆气体股份有限公司);甲醇(色谱纯,山东蜀王实验有限公司);2,4-DCP(上海晶纯生化科技股份有限公司).以上试剂均为分析纯.
1.2 Fe3O4@nZVI的制备
根据文献[24,25]采用共沉淀法和液相还原法制备纳米Fe3O4@nZVI.准确称取一定量的FeCl3·6H2O和FeSO4·7H2O溶于去离子水,然后将溶液加入500 mL三口烧瓶中,搅拌混合液20 min,并缓慢滴加过量氨水,反应体系逐渐出现黑色颗粒,得到纳米Fe3O4.待反应结束后,用强磁铁将纳米Fe3O4分离,用去离子水洗涤5次,重新将其放入烧瓶,并加入FeSO4溶液,用超声和快速搅拌的方法使纳米Fe3O4颗粒分散均匀.然后用恒压漏斗向悬浮液中滴加过量NaBH4溶液(FeSO4·7H2O和NaBH4摩尔比为1∶2.5),反应体系产生大量气泡.待NaBH4滴加完毕,继续搅拌30 min,即得Fe3O4负载的nZVI复合材料,记为Fe3O4@nZVI.以上整个制备和反应过程均在N2保护下进行.
1.3 2,4-DCP的去除实验
2,4-DCP去除实验在250 mL具塞锥形瓶中进行.主要研究了Fe3O4负载量(nFe0∶nFe3O4为1∶0.5,1∶1,0.5∶1)、溶液初始pH值(2,3,6,7,11)、H2O2浓度(5,10,15,20 mmol·L-1)、Fe3O4@nZVI投加量(0.2,0.4,0.6,0.8 g·L-1)、2,4-DCP浓度(20,40,60,80 mg·L-1)和温度(25,35,45 ℃)对2,4-DCP去除的影响,同时还考察了 Fe3O4@nZVI的回收利用性能(1~10次).具体步骤为:先用0.1 mol·L-1HCl和0.1 mol·L-1NaOH将一定浓度的2,4-DCP溶液调至一定pH值,等体积移取一定量的Fe3O4@nZVI悬浮液和2,4-DCP溶液至锥形瓶中,保持瓶内为氮气气氛,密封后置于气浴恒温振荡箱,在25 ℃,180 r·min-1条件下反应一定时间, 待反应至10,20,40,60,90 min时,从锥形瓶中取样5 mL,过0.22 μm滤膜,用高效液相色谱仪(HPLC)测定滤液中2,4-DCP浓度.每个实验设3个平行样.2,4-DCP的去除率(η)按(1)式计算:

(1)
其中,C0为2,4-DCP的初始浓度(mg·L-1);Ct为t时刻(min)滤液中2,4-DCP的剩余浓度(mg·L-1).
1.4 分析方法
用LC981型高效液相色谱仪(北京温分分析仪器技术开发有限公司)测定2,4-DCP浓度,利用C18反相色谱柱(Thermo, 4.6 mm×150 mm, 5 μm).测定参数为:流动相VCH3OH∶VH2O=7∶3,流速1 mL·min-1,柱温40 ℃,进样量20 μL,检测波长275 nm.
2 结果与讨论
2.1 Fe3O4负载量对2,4-DCP去除的影响
在25 ℃,溶液pH=3,H2O2浓度15 mmol·L-1,2,4-DCP浓度40 mg·L-1,Fe3O4@nZVI投加量0.6 g·L-1实验条件下,Fe3O4负载量对2,4-DCP去除率的影响见图1.由图可知,当nFe0∶nFe3O4为1∶1,反应90 min时,2,4-DCP的去除率达到91.37%,这可能是由于反应体系中引入了纳米Fe3O4,导致纳米复合材料比表面积增大[27],提高了其对2,4-DCP的吸附作用.同时,纳米Fe3O4也可与H2O2反应,使羟基自由基的产率比单纯的nZVI高[28],导致2,4-DCP去除率进一步提高.当nFe0∶nFe3O4为1∶0.5时,2,4-DCP的去除率也呈现初期快速增长的趋势,90 min时的去除率为87.56%,较摩尔比为1∶1低.这可能是由于当Fe3O4负载量减少时,其表面吸附2,4-DCP的量相应减少.当nFe0∶nFe3O4为0.5∶1,反应90 min时,2,4-DCP去除率仅有78.62%,低于1∶1和1∶0.5的去除率,这可能是因为随着nZVI的减少,反应体系中没有足够的Fe2+用于Fenton反应,致使2,4-DCP去除率降低.综上所述,当nFe0∶nFe3O4=1∶1时,Fe3O4@nZVI类Fenton体系对2,4-DCP的去除效果最佳,故后续实验选择nFe0∶nFe3O4=1∶1.

图1 Fe3O4负载量对2,4-DCP去除的影响
2.2 pH对2,4-DCP去除的影响
在25 ℃,Fe3O4负载量为1∶1,H2O2浓度15 mmol·L-1,2,4-DCP浓度40 mg·L-1, Fe3O4@nZVI投加量0.6 g·L-1条件下,pH对2,4-DCP去除的影响见图2.由图可以看出,溶液pH对2,4-DCP去除的影响非常明显,在pH=2和pH=3的酸性条件下,Fe3O4@nZVI纳米类Fenton体系对2,4-DCP有较好的去除效果,90 min时去除率在90.00%以上;而在pH=7的中性和pH=11的碱性条件下,同样时间内对2,4-DCP的去除率分别为63.12%和37.27%.这是因为在强酸性条件下,nZVI表面的氧化层发生溶解[29],nZVI暴露更多,可提供较多活性反应位点,并且更易因酸蚀作用产生较多的Fe2+,从而催化H2O2生成更多·OH,加速2,4-DCP的氧化降解.在中性和碱性条件下,由于nZVI与2,4-DCP发生还原脱氯作用[30],生成Fe2+和Fe3+,这2种离子与溶液中的OH-反应生成Fe(OH)2和Fe(OH)3沉淀,吸附在nZVI表面,阻碍反应的继续进行,所以导致Fe3O4@nZVI类Fenton体系在中性和碱性条件下对2,4-DCP的去除率下降[31].

图2 溶液初始pH对2,4-DCP去除的影响
2.3 H2O2浓度对2,4-DCP去除的影响
在25 ℃,Fe3O4负载量为1∶1,pH为3,2,4-DCP浓度为40 mg·L-1,Fe3O4@nZVI投加量为0.6 g·L-1条件下,H2O2浓度对Fe3O4@nZVI类Fenton体系去除2,4-DCP的影响见图3.由图可以看出,当H2O2浓度由5 mmol·L-1增加至15 mmol·L-1时,90 min内2,4-DCP的去除率由65.37%增加至91.87%.但当H2O2浓度为20 mmol·L-1时,2,4-DCP的去除率反而比15 mmol·L-1的低6.11%,故H2O2浓度过高和过低都不利于2,4-DCP的去除.因此,本研究中H2O2的最佳浓度为15 mmol·L-1.

图3 H2O2浓度对2,4-DCP去除的影响
有学者认为,类Fenton体系的机理为nZVI腐蚀溶解产生Fe2+,Fe2+再催化H2O2产生·OH活性自由基, 高氧化电位·OH进而氧化去除氯代有机污染物[32-34].据此,可以解释H2O2浓度较低时,Fe2+对其催化产生的·OH量较少, 导致类Fenton体系对2,4-DCP去除率较低;而当H2O2为20 mmol·L-1时,去除率反而低于15 mmol·L-1.这是因为H2O2的浓度较高时,其本身也会与·OH活性自由基发生反应, 从而消耗·OH, 导致Fe3O4@nZVI纳米类Fenton体系对2,4-DCP的去除率下降[35].具体反应见(2)式和(3)式.
2.4 Fe3O4@nZVI投加量对2,4-DCP去除的影响
在25 ℃,Fe3O4负载量为1∶1,pH=3,H2O2浓度15 mmol·L-1,2,4-DCP浓度40 mg·L-1条件下,Fe3O4@nZVI投加量对2,4-DCP去除的影响见图4.由图看出,随Fe3O4@nZVI投加量的增加,体系对2,4-DCP的去除率不断升高,当Fe3O4@nZVI的投加量分别为0.2,0.4,0.6和0.8 mg·L-1,反应90 min时,相应的2,4-DCP的去除率分别为54.87%,85.60%,91.87%和94.17%.
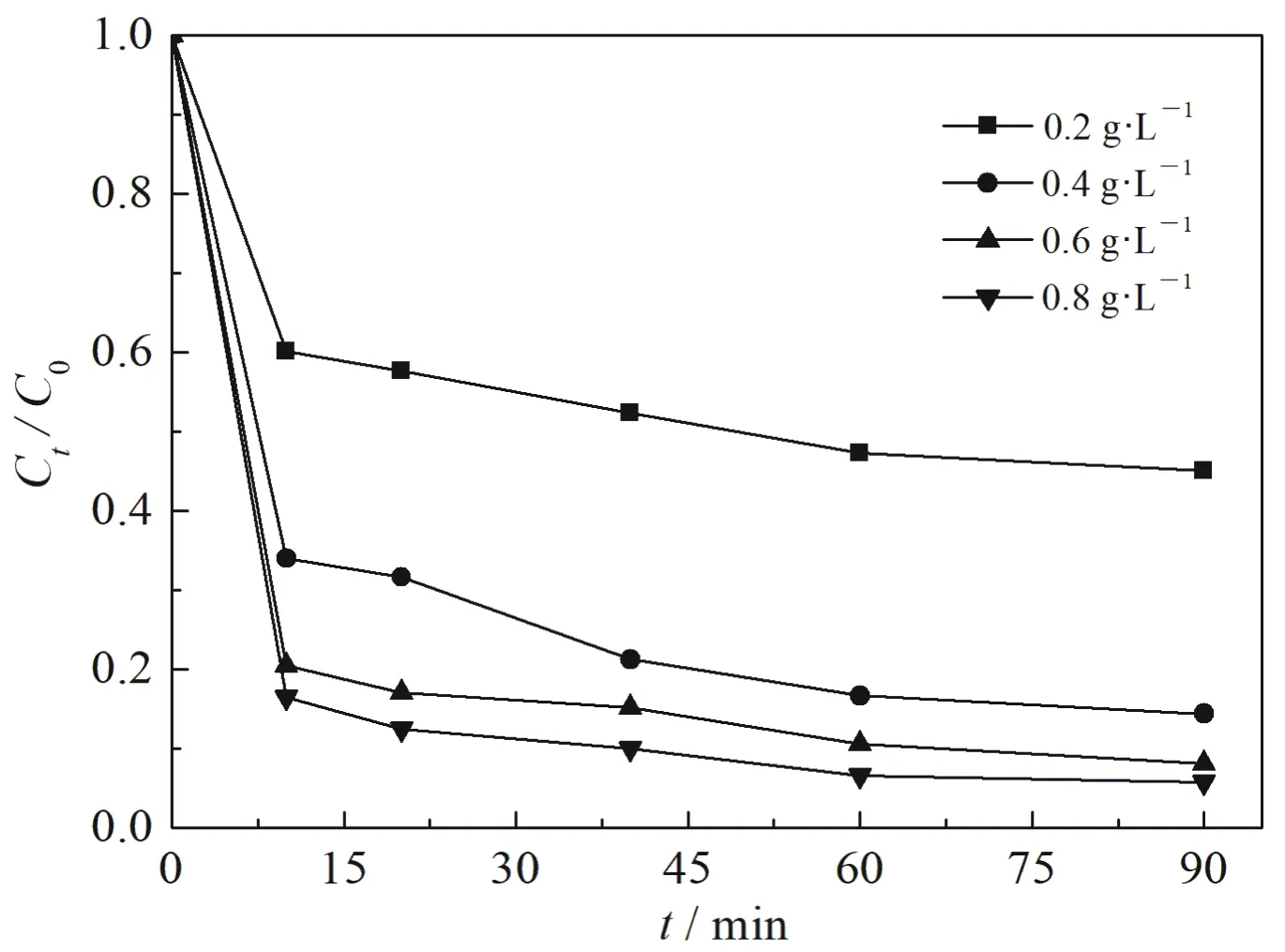
图4 Fe3O4@nZVI投加量对2,4-DCP去除的影响
当Fe3O4@nZVI的投加量为0.8 mg·L-1和0.6 mg·L-1时, 去除率略有提升.这是因为Fe3O4@nZVI纳米类Fenton反应主要是依赖体系溶出的Fe2+来催化H2O2产生·OH,进而氧化去除2,4-DCP[29],当Fe3O4@nZVI投加量增多时,反应体系中的nZVI表面活性位点相应增多[36],可以吸附还原更多的2,4-DCP,从而导致溶液中Fe2+增多,催化H2O2氧化去除2,4-DCP的·OH增多. 然而,随着Fe3O4@nZVI投加量增多,溶液中产生大量Fe2+,协同负载材料Fe3O4催化H2O2产生大量的·OH, 使得nZVI表面被氧化[37],不能进一步支撑反应继续进行,所以投加量增至0.8 mg·L-1时, 2,4-DCP的去除率与0.6 mg·L-1的投加量相比略有增大.
2.5 污染物浓度对2,4-DCP去除的影响
在25 ℃,Fe3O4负载量为1∶1,pH=3,H2O2浓度15 mmol·L-1,Fe3O4@nZVI投加量0.8 g·L-1条件下,2,4-DCP本身浓度对其去除的影响见图5.由图看出,随着2,4-DCP初始浓度的增加,Fe3O4@nZVI类Fenton体系对2,4-DCP的去除率逐渐降低.当2,4-DCP初始浓度为20,40,60,80 mg·L-1,反应至90 min时,其对应的去除率分别为98.31%,94.21%,76.78%和61.70%.显然,去除率随2,4-DCP浓度增大而不断降低.这是因为在Fe3O4@nZVI和H2O2量不变的前提下,随着2,4-DCP浓度的增大,反应体系中没有足够的反应位点和·OH将2,4-DCP氧化去除,所以导致去除率随2,4-DCP浓度增加而较低.
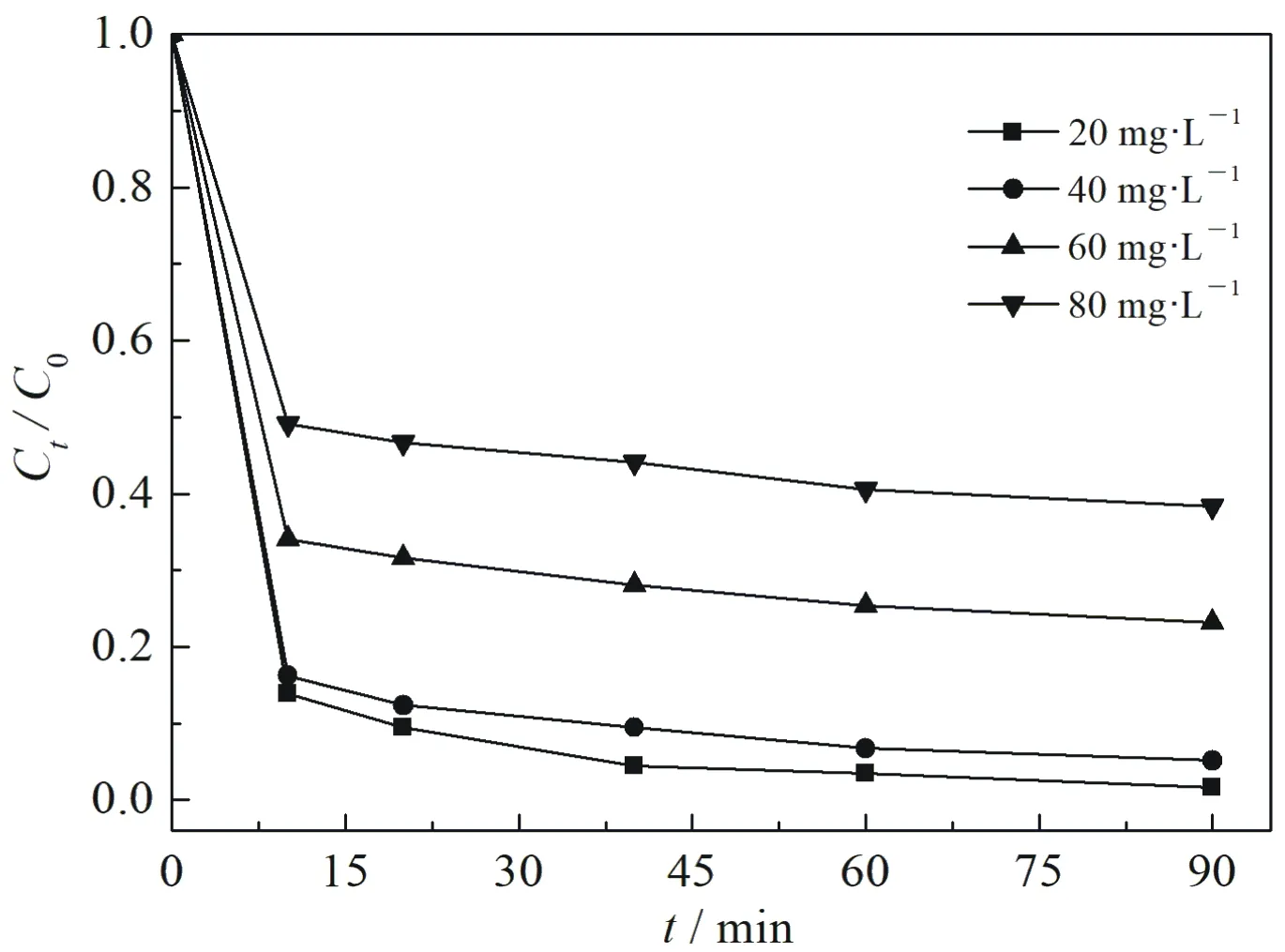
图5 污染物浓度对2,4-DCP去除的影响
2.6 温度对2,4-DCP去除的影响
在Fe3O4负载量为1∶1,pH=3,H2O2浓度15 mmol·L-1,2,4-DCP浓度40 mg·L-1,Fe3O4@nZVI投加量0.8 g·L-1条件下,温度对2,4-DCP去除的影响见图6.由图看出,当温度分别为25,35,45 ℃,反应进行90 min时,Fe3O4@nZVI类Fenton体系对2,4-DCP的去除率分别为94.42%,94.89%,95.57%.由此可知,当反应体系温度升高时,去除率变化不大.这是因为温度升高会加快·OH的生成速度, 有助于·OH与有机物反应, 提高Fenton体系对2,4-DCP的氧化去除效果;同时,对于Fenton反应体系,温度升高也会加速H2O2分解成O2和H2O,不利于·OH的生成[38].因此,Fe3O4@nZVI类Fenton体系中升高温度对2,4-DCP去除率的影响较小.

图6 温度对2,4-DCP去除的影响
2.7 2,4-DCP的去除动力学分析
用拟一级动力学方程(见式(4))对Fe3O4@nZVI类Fenton体系与2,4-DCP的反应动力学数据进行拟合.
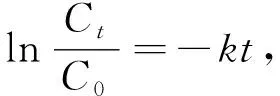
(4)
其中,C0为2,4-DCP的初始浓度(mg·L-1);Ct为t时刻(min)滤液中2,4-DCP的剩余浓度(mg·L-1);k为拟一级反应速率常数(min-1);t为反应时间(min).
不同影响因素对2,4-DCP去除的拟一级动力学拟合参数见表1.表中除nZVI与Fe3O4的摩尔比为0.5∶1,pH=2个别因素外,H2O2浓度,Fe3O4@nZVI投加量,2,4-DCP浓度,温度拟合后的R2均大于0.9,说明Fe3O4@nZVI与2,4-DCP的反应符合拟一级动力学方程.当pH从3增大到11时,k下降至原来的1/7,这是因为酸性条件下,产生较多的Fe2+,从而催化H2O2生成更多·OH, 加速2,4-DCP氧化.中性和碱性条件下,nZVI与2,4-DCP发生还原脱氯作用生成Fe(OH)2和Fe(OH)3沉淀,吸附在nZVI表面,阻碍反应的继续进行.Fe3O4@nZVI投加量从0.2增大至0.8 g·L-1时,k也从0.0038增大至0.0130 min-1,表明随Fe3O4@nZVI投加量增大,2,4-DCP去除率变快.当2,4-DCP浓度从20增大到80 mg·L-1时,反应速率常数k变为原来的1/8,反应速率大幅降低.当温度从25 ℃升至45 ℃时,k由0.0141 min-1升至0.0143 min-1,说明温度对2,4-DCP去除速率变化不明显.
2.8 Fe3O4@nZVI重复利用性能
对反应后的Fe3O4@nZVI利用强磁场分离,先用甲醇洗涤2次,再用去离子水洗涤2次,以去除Fe3O4@nZVI上附着的污染物,之后在60 ℃条件下进行真空干燥.用回收得到的Fe3O4@nZVI对2,4-DCP进行去除实验.在25 ℃,Fe3O4负载量为1∶1,pH=3,H2O2浓度15 mmol·L-1,2,4-DCP浓度40 mg·L-1,Fe3O4@nZVI投加量0.8 g·L-1条件下,重复实验结果见图7.由图看出,随着循环使用次数的增加,Fe3O4@nZVI纳米类Fenton法对2,4-DCP的去除率逐渐降低.这是由于Fe3O4@nZVI纳米复合材料在循环使用过程中,nZVI被逐渐消耗,使得剩余Fe3O4@nZVI纳米材料中的nZVI的含量逐渐降低,导致催化H2O2产生·OH 的量也相应减少.所以,随着循环使用次数的增加,Fe3O4@nZVI纳米类Fenton体系对2,4-DCP的去除率逐渐降低.但在循环使用10次后,其对2,4-DCP的去除率仍保持在66%以上.因而,Fe3O4@nZVI纳米复合材料具有较好的磁回收利用性能.

表1 不同影响因素对2,4-DCP去除的拟一级动力学拟合参数
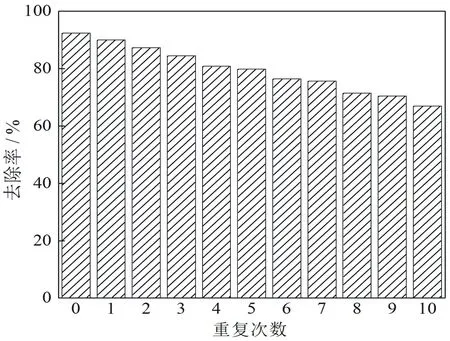
图7 负载材料重复利用对2,4-DCP去除的影响
3 结论
1)Fe3O4的负载量,溶液pH值,Fe3O4@nZVI的投加量,H2O2浓度以及2,4-DCP浓度对反应体系都有较大的影响.当Fe3O4的负载量为1∶1时,降低溶液pH值,增加Fe3O4@nZVI投加量,提高H2O2浓度,降低污染物浓度都可提高Fe3O4@nZVI纳米类Fenton体系对2,4-DCP的去除率.但pH值过低(pH<2)或过高(pH>7),H2O2浓度过低(<5 mmol·L-1)或过高(>15 mmol·L-1),都不利于Fe3O4@nZVI纳米类Fenton体系对2,4-DCP的去除.
2)在25 ℃,Fe3O4负载量为1∶1,pH=3,H2O2浓度15 mmol·L-1,2,4-DCP浓度40 mg·L-1,Fe3O4@nZVI投加量为0.8 g·L-1条件下,2,4-DCP去除率达94.42%.
3)Fe3O4@nZVI类Fenton体系去除水中2,4-DCP的过程符合拟一级动力学模型.
4)Fe3O4@nZVI经10次重复利用后,Fe3O4@nZVI类Fenton体系对2,4-DCP的去除率仍保持在66%以上,说明Fe3O4@nZVI纳米复合材料具有很好的磁回收利用性能.
