甘肃岷县当归连作种植区土壤细菌群落结构分析
2022-08-05牛世全樊子婧孙铭悦
牛世全,赵 进,樊子婧,孙铭悦
(西北师范大学 生命科学学院,甘肃 兰州 730070)
当归(Angelicasinensis)属伞形科[1],为药用草本植物,其干燥根是享誉世界的植物药材之一[2].据《神农本草经》中记载,当归具有补血活血等功效,常被中医用于治疗贫血、月经不调等妇科疾病,还可作为日常补品食用[3-5].我国当归产地主要分布在甘肃东南部、四川及云南等地,甘肃岷县因其得天独厚的自然条件优势而被誉为“千年药乡”,其所产的当归品质优良,又被称为岷归[6-7].然而随着耕作年限的增加,土壤可溶性养分含量不断下降,土传病害(主要以真菌为主,如镰刀菌、腐霉菌等)发病率不断上升,严重破坏了当归种植区土壤生态环境,导致当归品质和产量下滑,制约了当归产业的可持续发展[8].
土壤微生物通过调节土壤功能来维持生态系统的稳定,是影响植物健康生长的关键因素之一[9-10],不同土壤之间、或同一土壤类型的不同田地之间,微生物群落组成都存在明显差异[11].根际细菌群落多样性因在调节土壤肥力、固氮、生产激素、养分分配以及抑制植物病害发生等方面都发挥着至关重要的作用,因而被作为评估土壤质量和肥力的重要生物指标[12-13].已有研究表明,增加根际土壤细菌多样性,可以提高土壤中脲酶和磷酸酶的活性,降低当归发病率[14].此外,根际微生物群落结构还与土壤养分含量密切相关[15].根际微生物的生长繁殖需要从环境中获取所需营养物质,研究微生物介导的根际土壤养分循环过程,以及土壤理化因子与微生物群落的关系,有助于明确土壤养分的主要驱动因素,以减少外界对植物健康生长的干扰[16].有研究证实,适当的改变根际微生物群落的结构和功能,可以改善土壤养分含量,促进植物吸收利用,提高当归品质[17].可见,了解植物根际细菌群落多样性、结构组成、影响因素和功能等,对于土壤微生物生态学研究具有重要意义[18].
本研究应用高通量测序技术,分析岷县当归种植区不同连作年限根际土壤与休耕地土壤细菌群落结构差异,揭示土壤细菌群落与土壤理化性质的相关性,并运用PICRUSt2算法预测土壤细菌群落的基因功能,期望为探明甘肃岷县当归种植区不同连作年限根际土壤微生物群落结构特征,防止病害发生及当归种植区土壤修复提供一定的技术支撑.
1 材料与方法
1.1 研究区域概况及样点设计
甘肃省定西市岷县闾井镇当归种植区(104°37′42″E, 34°21′18″N, 海拔2785.39 m)气候高寒,年均气温较低(约4.4 ℃),年降水量较高(约640 mm),属典型的高原性大陆气候,无霜期为101 d,春秋相连,土壤类型为黑土,土层深厚,适宜当归生长.
样点设计:根据种植区实地调查,当归幼苗在4月份移栽前,均一次性施入足量基肥(腐熟农家肥每亩3 800 kg,配化学肥料(磷酸二铵每亩20 kg、硫酸钾每亩10 kg和尿素每亩10 kg)).试验共设计5个取样点,以荒置多年未耕作的土壤为休耕地土壤CK_J,种植当归1年的耕地为根际土壤F1,种植当归2年的耕地为根际土壤F2,种植当归3年的耕地为根际土壤F3,种植当归5年的耕地为根际土壤F4.
1.2 土壤样品采集
于2020年10月进行土壤样品采集.F1~F4采用5点采样法在每个取样点(重复3次)随机选择5株大小相近的当归,整株挖出后收集根须周围的土壤作为根际土样[19];CK_J采用5点采样法,收集5~20 cm的土壤,每个样地3个重复.将采集后的土样低温运回实验室,每组土样过2 mm筛后分成2份,一份保存在-80 ℃冰箱用于测序,另一份自然风干后测定理化性质.
1.3 土壤理化性质测定
测定的土壤理化性质包括pH、电导率(EC)、有机质(SOM)、全氮(TN)、速效磷(AP)、速效钾(AK).pH值使用笔式pH计测定,EC使用笔式电导率仪测定,SOM测定采用重铬酸钾容量法—稀释热法,TN测定采用凯氏定氮法,AP测定采用碳酸氢钠浸提—钼锑抗分光光度法,AK测定采用四苯硼钠比浊法[20].
1.4 土壤总DNA的提取、扩增和测序
将每个样点的15份土样等量混合后,使用E.Z.N.A.®soil试剂盒(Omega Bio-tek,Norcross, GA, USA)提取土壤总DNA.利用1%琼脂糖凝胶电泳检测DNA提取质量.土壤细菌16S rDNA PCR扩增,采用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增V3-V4 可变区.扩增程序为:95 ℃ 预变性3 min,27个循环(95 ℃ 变性30 s, 55 ℃ 退火30 s, 72 ℃ 延伸30 s),最后72 ℃延伸 10 min(PCR仪:ABI GeneAmp® 9700型).
使用2%琼脂糖凝胶回收PCR产物,AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测.QuantiFluorTM-ST(Promega, USA)进行检测定量.根据Illumina MiSeq 平台(Illumina, San Diego, USA)标准操作规程将纯化后的扩增片段构建PE 2*300的文库,在Miseq PE300平台进行测序,测序由深圳微科盟科技集团有限公司完成.
1.5 数据统计分析
利用 Microsoft Excel 2013进行数据处理,SPSS 25.0 软件 Duncan’s 法进行单因素方差分析.Origin 2021分析土壤细菌群落结构组成分布,R 4.1.2软件进行土壤细菌主坐标分析(PCoA);Canoco 5.0进行冗余分析(RDA),TBtools对土壤细菌群落的预测功能进行聚类分析,并绘制热图.
2 结果与分析
2.1 当归种植区土壤理化性质
岷县闾井镇当归种植区土壤均呈碱性,pH值波动较小,大致范围在7.6~8.2,随连作年限的增加根际土壤pH值增高.土壤其他理化指标变化规律则各不相同,电导率在各样本间差异显著(P<0.05),休耕地土壤显著高于根际土壤;速效磷含量根际土壤中显著高于休耕地土壤;速效钾含量在休耕地土壤中显著高于根际土壤;全氮含量在根际土壤中显著高于休耕地土壤;有机质含量则在两者间差异不显著.随连作年限的增加,速效磷、速效钾和全氮含量差异显著(P<0.05,表1).
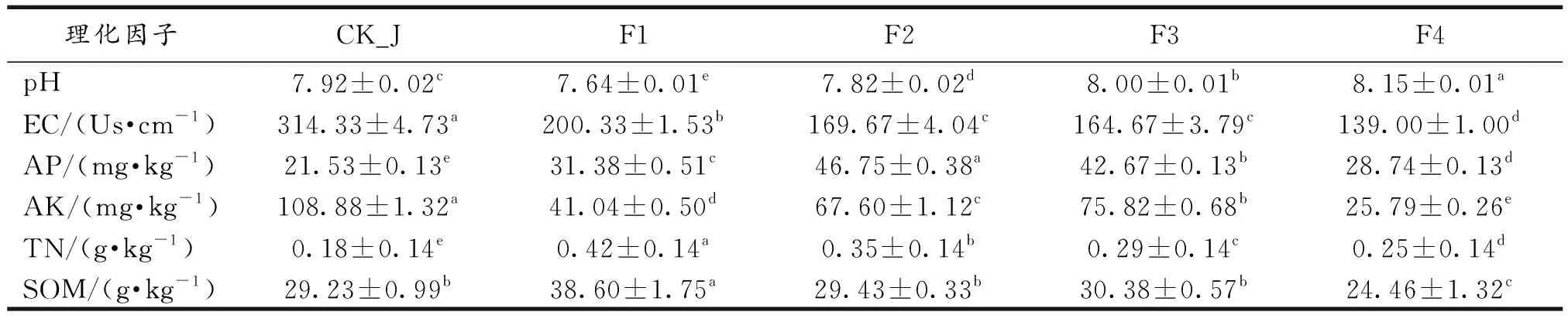
表1 当归种植区土壤理化性质
2.2 当归种植区土壤细菌群落结构的Alpha多样性分析
细菌群落多样性指数(Alpha-Diversity)中,Chao1 指数代表物种群落丰富度;Shannon指数代表物种群落多样性.由表2可知,根际土壤细菌的丰富度和多样性均高于休耕地土壤.随着连作年限的增加,当归根际土壤细菌的丰富度和多样性均呈先降低后增加的趋势.
2.3 当归种植区土壤细菌主坐标分析
基于Bray Curtis距离进行PCoA分析,并选取贡献率最大的主坐标组合进行作图,可以说明各土壤样本细菌群落结构之间存在的差异大小,图中各土壤样本的距离越接近,表示样本之间的细菌物种组成结构越相似.如图1所示,第一主成分轴和第二主成分轴分别解释细菌群落总变异的36.7%和30.0%,共解释了原信息量的66.7%;且与休耕地土壤CK_J细菌群落结构的相似度由近到远依次为F1,F2,F3,F4.

表2 当归种植区土壤细菌Alpha多样性指数

图1 土壤细菌群落主坐标分析图(PCoA)
2.4 当归种植区土壤细菌群落组成
2.4.1 当归种植区土壤细菌门水平群落组成分析甘肃岷县闾井镇当归种植区5个土壤样点共注释到28个门、74个纲、102个目、153个科和174个属.其中相对丰度排名前10的优势菌门分别为(图2):放线菌门(Actinobacteria, 根际土壤26.8%~46.3%,休耕地土壤39.3%)、变形菌门(Proteobacteria, 根际土壤18.1%~25.3%,休耕地土壤21.4%)、绿弯菌门(Chloroflexi, 根际土壤11.1%~14.1%,休耕地土壤12.8%)、厚壁菌门(Firmicutes, 根际土壤9.2%~12.2%,休耕地土壤11.1%)、酸杆菌门(Acidobacteria, 根际土壤8.8%~19.9%,休耕地土壤6.2%)、拟杆菌门(Bacteroidetes)(根际土壤1.1%~2.3%,休耕地土壤3.9%)、芽单胞菌门(Gemmatimonadetes, 根际土壤1.5%~2.3%,休耕地土壤2.2%)、硝化螺旋菌门(Nitrospirae, 根际土壤1.6%~2.3%,休耕地土壤1.7%)、未分类(Unclassified)和其他.其中放线菌门、变形菌门、绿弯菌门和厚壁菌门的相对丰度之和,在连作和休耕地土壤中均大于70%,为主要优势菌门.放线菌门的相对丰度随连作年限的增加而降低,酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae)的相对丰度随连作年限的增加而增加,变形菌门和厚壁菌门的相对丰度随连作年限的变化呈先增加后降低的趋势.
2.4.2 当归种植区土壤细菌属水平群落组成分析当归连作根际土壤和休耕地土壤分别包含92和113个细菌属.将相对丰度排名前20的细菌属绘图(图3)发现,根际土壤中相对丰度较高的细菌属为芽孢杆菌属(Bacillus,4.3%~7.3%)、节杆菌属(Arthrobacter,2.0%~3.3%)、分支杆菌属(Mycobacterium,1.0%~2.6%)、红游动菌属(Rhodoplanes,1.0%~2.1%)、Kaistobacter(0.9%~1.4%)、慢生根瘤菌属(Bradyrhizobium,0.6%~1.0%)、拜纳蒙纳斯属(Balneimonas,0.5%~1.3%)、硝化螺旋菌属(Nitrospira,0.5%~1.1%);休耕地土壤中相对丰度较高的细菌属为芽孢杆菌属(3.6%)、节杆菌属(2.7%)、棒杆菌属(Corynebacterium,2.0%)、藤黄单胞菌属(Luteimonas,1.7%)、红球菌属(Rhodococcus,1.5%)、柠檬球菌属(Citricoccus,1.1%)、红游动菌属(1.1%),说明属水平下,当归连作根际和休耕地土壤细菌群落结构组成相差较大.芽孢杆菌属和节杆菌属为共有的优势菌属.连作根际土壤中芽孢杆菌属相对丰度均高于休耕地土壤.

图2 当归根际和休耕地土壤细菌门水平前10的 相对丰度
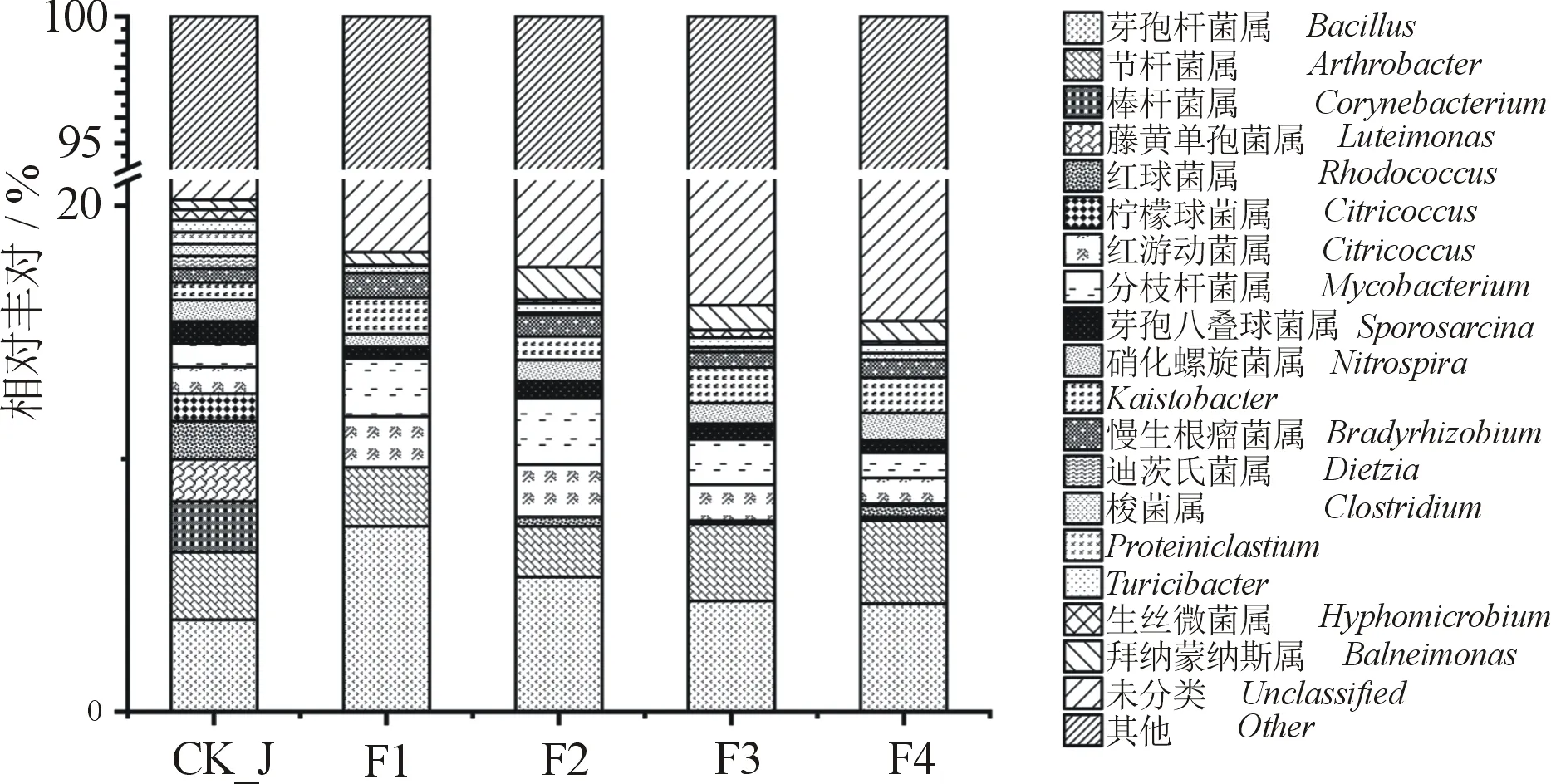
图3 当归根际和休耕地土壤细菌属水平 前20的相对丰度
2.5 当归种植区土壤细菌优势菌门与土壤理化因子的RDA分析
通过DCA分析发现,Lengths of gradient第一轴小于3.5,因此选择 RDA分析土壤细菌优势菌门和理化因子的相关性,调整后的方差解释度为96.1%(图4),结果显示土壤pH、电导率和全氮含量对土壤优势菌门影响较大.相对丰度与酸碱度呈正相关的菌门有:硝化螺旋菌门、绿弯菌门、酸杆菌门、芽单胞菌门、拟杆菌门和变形菌门;相对丰度与酸碱度呈负相关的菌门有:放线菌门和厚壁菌门.相对丰度与电导率呈正相关的菌门有:放线菌门、厚壁菌门、变形菌门和拟杆菌门;相对丰度与电导率呈负相关的菌门有:芽单胞菌门、硝化螺旋菌门、绿弯菌门和酸杆菌门.放线菌门相对丰度与全氮含量呈正相关,其余优势菌门相丰度与全氮含量为负相关.

横轴为RDA1,即第一轴解释了数据方差变化的82.65%;纵轴为RDA2,即第二轴解释了数据方差变化的16.37%.
2.6 当归种植区土壤细菌优势菌属与土壤理化因子的RDA分析
通过DCA分析发现,Lengths of gradient第一轴小于3.5,因此选择 RDA分析土壤细菌优势菌属和理化因子的相关性,调整后的方差解释度为91.4%(图5),结果显示土壤pH、速效磷和全氮含量对细菌优势菌属影响较大.相对丰度与酸碱度呈正相关的菌属有:Kaistobacter、拜纳蒙纳斯属、节杆菌属、硝化螺旋菌属、Turicibacter、生丝微菌属、红球菌属和芽孢八叠球菌属;呈负相关的菌属有:芽孢杆菌属、红游动菌属、分支杆菌属和慢生根瘤菌属.相对丰度与速效磷含量呈正相关的菌属有:拜纳蒙纳斯属、Kaistobacter、慢生根瘤菌属、分支杆菌属、红游动菌属和芽孢杆菌属;呈负相关的菌属有:Turicibacter、生丝微菌属、芽孢八叠球菌属、红球菌属、藤黄单孢菌属、棒杆菌属、柠檬球菌属、梭菌属、迪茨氏菌属和Proteiniclasticum.相对丰度与全氮含量呈正相关的菌属有:拜纳蒙纳斯属、Kaistobacter、分支杆菌属、慢生根瘤菌属、红游动菌属和芽孢杆菌属;呈负相关的菌属有:节杆菌属、硝化螺旋菌属、Turicibacter、生丝微菌属、芽孢八叠球菌属、红球菌属、藤黄单孢菌属、棒杆菌属、柠檬球菌属、梭菌属、迪茨氏菌属和Proteiniclasticum.

横轴为RDA1,即第一轴解释了数据方差变化的70.60%;纵轴为RDA2,即第二轴解释了数据方差变化的19.89%.
2.7 当归种植区土壤细菌PICRUSt2功能预测
PICRUSt2的原理是基于已测微生物基因组的序列,将测序得到的微生物组成映射到数据库中,对微生物功能进行预测[21-22].预测结果显示,在KEGG pathway LV1层级下,有6类代谢通路包括代谢、遗传信息处理、细胞过程、人类疾病、有机体系和环境信息处理.在KEGG pathway LV2层级下,共发现47个二级功能.在KEGG pathway LV3层级下,共发现384个三级功能.相对丰度排名前20的三级预测功能(图6),主要对应辅助因子和维生素的代谢、碳水化合物代谢、糖的生物合成与代谢、翻译、细胞运动和细胞生长与死亡等二级功能层.结果表明,当归根际土壤与休耕地土壤细菌群落基因功能相对丰度明显不同,且随着连作年限的增加,当归根际土壤细菌群落基因功能相对丰度呈增高的趋势.其中,D-谷氨酰胺和D-谷氨酸代谢、三羧酸循环的相对丰度在CK_J中最高;酮体的合成与降解、萜类化合物和类固醇的合成、泛酸和辅酶A生物合成以及肽聚糖的生物合成的相对丰度在F1中最高;细菌趋化性和生物素代谢的相对丰对在F2中最高;D-丙氨酸代谢和细胞周期-柄杆菌属的相对丰度在F3中最高;蛋白质输出、脂肪酸生物合成、氨酰-tRNA生物合成和缬氨酸、亮氨酸和异亮氨酸生物合成的相对丰度在F4中最高.

图6 土壤细菌群落预测功能基因三级功能层热图
3 结果与讨论
甘肃岷县闾井镇当归种植区,不同连作年限当归根际与休耕地土壤细菌群落多样性存在差异,根际土壤中细菌群落的多样性指数均高于休耕地土壤,这是因为当归生长过程中根系分泌产生大量营养物质有利于根际土壤细菌的繁殖[23],即植物根际土壤中营养物质的含量影响土壤细菌丰富度和多样性,这一结果在其他植物根际土壤微生物群落研究中也得到了证实[24-26].高晓梅等[27]研究根腐病胁迫下韭菜根际细菌多样性的变化发现,通过对3个实验组(健康组H、 轻度发病组RI和重度发病组Rh)根际细菌多样性的测定,结果表明2个发病组的细菌多样性均高于健康组,且RI的细菌多样性最高,推测可能是病原菌在侵染初期不具有优势性,植物根际会进行自身防御,根系分泌产生各类具有防御性能的化感物质,吸引各类细菌共同防御病原菌的侵染.随着连作年限的增加,闾井镇当归根际土壤细菌多样性呈先降低后增加的趋势,且连作土壤 F4中细菌多样性最高.
植物在生长过程中根际会与土壤环境形成特定的植物-土壤-微生物生态系统,其中根际细菌群落结构特征是该生态系统的决定因素之一[28].门水平下,闾井镇当归连作根际土壤和休耕地土壤细菌群落中,主要优势菌门包括放线菌门、变形菌门、绿弯菌门、厚壁菌门和酸杆菌门等,其中放线菌门为最优势菌群,这一结果与前人研究当归根际微生物多样性的结果相似[29],放线菌门在干旱半干旱区中的分布较广,许多菌属具有耐盐碱、耐旱等特性,在盐碱地土壤中能够较好的定殖[30-31].已有研究表明,放线菌门不仅可以降解土壤中的农药残留,协助修复土壤环境的污染[32-33];还能够分解土壤有机质促进碳循环,帮助植物生长[34-35].本研究中,当归连作根际土壤F1放线菌门的相对丰度高于休耕地土壤,推测可能是连作时间较短,土壤环境有利于放线菌门的生长繁殖,但随着连作年限的增加,当归连作根际土壤中的放线菌门相对丰度下降.这与连作后土壤养分含量的降低有关,这一现象在其他植物连作研究中也有相似的发现,例如苜蓿土壤中放线菌门相对丰度会随着种植年限的增加而下降,且在土壤养分不充足的农田土壤中放线菌门相对丰度显著低于苜蓿土壤,说明土壤养分含量是影响放线菌门相对丰度的主要因素[36].然而,酸杆菌门与放线菌门的相对丰度变化趋势恰好相反,闾井镇当归连作根际土壤中酸杆菌门相对丰度均高于休耕地土壤,且随着连作年限的增加而增加,这与Fierer等[37]研究结果一致,说明土壤养分环境与土壤细菌群落结构的变化密切相关,寡营养的土壤环境更有利于酸杆菌门的生长繁殖.此外,当归连作根际土壤与休耕地土壤细菌群落结构的不同之处,主要表现为各优势菌门在两者中相对丰度值不同,F1中放线菌门的相对丰度值最大,F2中变形菌门和厚壁菌门的相对丰度值最大,F3中绿弯菌门和芽单胞菌门的相对丰度值最大,F4中酸杆菌门和硝化螺旋菌门的相对丰度值最大,CK_J中拟杆菌门的相对丰度值最大,整体上优势菌门的群落结构组成基本稳定[38].属水平下,休耕地土壤中主要优势菌属为芽孢杆菌属、节杆菌属、棒杆菌属、藤黄单胞菌属和红球菌属等,当归连作根际土壤中主要优势菌属为芽孢杆菌属、节杆菌属、分支杆菌属、红游动菌属和Kaistobacter等,休耕地土壤与根际土壤细菌群落的共有优势菌属为芽孢杆菌属和节杆菌属.除此之外,两者间优势菌属结构组成变化较大,说明随着当归连作年限的增加,植物—土壤—微生物生态系统也会不断发生变化以适应外界环境.已有研究表明,连续种植或已经出现土传病害(如根腐病)后的根际土壤微生物群落结构会发生改变,不再维持原有的群落平衡,且土壤病害程度和种植年限都会改变土壤细菌的核心微生物群落,使群落成员不断向亚健康演替,同时伴随新类群的出现[27,39].当归连作根际土壤细菌群落中,未分类菌属的相对丰度(65.5%~70.5%)均高于休耕地土壤(64.9%),表明连作年限的增加可能会导致土壤中原有的细菌群落结构组成被打破,从而出现了新的组成模式.
微生物群落结构对土壤理化性质的变化高度敏感,土壤pH以及可利用的养分含量等近端因素都会直接影响微生物群落结构[40].Zhao等[41]研究连作下施加烟秆炭对白及土壤理化性质和细菌群落结构的影响发现,施加外源物质可以显著改善土壤理化性质,同时引起细菌群落结构的改变.姜小凤等[42]在研究不同混种模式下当归根际土壤细菌群落与土壤理化性质的相关性中发现,土壤pH、有机质和速效磷与细菌优势菌门显著相关,土壤电导率、速效磷和速效钾与细菌优势菌属显著相关.闾井镇当归土壤细菌群落结构与土壤理化性质的RDA分析结果表明,优势菌门与土壤pH、电导率和全氮含量相关性较高,优势菌属与土壤pH、速效磷和全氮含量相关性较高.土壤pH在土壤理化性质中占据着重要地位,主要影响土壤有效养分含量和微生物多样性等[43].随着连作年限的增加,当归连作根际土壤pH不断升高,可能与长期施加尿素等化学肥料,土壤消化作用较强导致土壤中硝酸盐的积累有关[44].此外,土壤pH又是土壤硝化作用的主要影响因素[45].曹彦强等[46]研究不同pH土壤的消化活性及细菌群落组成发现,硝化螺旋菌属是土壤硝化作用的主要功能菌,且在一定范围内消化活性、功能菌的相对丰度会随pH的升高而增加.随着连作年限的增加,当归连作根际土壤细菌群落中硝化螺旋菌属的相对丰度(0.5%~1.1%)随土壤pH的升高而升高,与上述结果一致.由此说明土壤理化性质也是影响当归连作土壤细菌群落结构的重要因素之一.
甘肃岷县闾井镇当归种植区土壤细菌群落功能预测主要涉及6个一级功能层、47个二级功能层和384个三级功能层,土壤细菌相对丰度前20的三级功能层以代谢为主,其次包括遗传信息处理和细胞过程等.土壤细菌群落的代谢功能在土壤养分循环等方面起着重要作用[47].例如,土壤中解磷微生物通过溶解和矿化作用高效释放土壤中的磷[48];固碳微生物的碳代谢强度会影响土壤中碳的循环利用[49].另外,在代谢功能的作用下土壤细菌群落会产生相应的代谢产物,如抗生素、萜类化合物等,这些化合物对植物连作的影响较大[50-51].随着连作年限的增加,当归根际土壤细菌群落基因功能预测的前20个功能相对丰度变化较大,表明亚健康下的土壤细菌群落结构的变化会引起群落功能的改变,可能会导致土壤环境不利于植物的生长.
综上所述,闾井镇当归连作根际土壤细菌群落多样性均高于休耕地土壤,且随连作年限的增加,根际土壤细菌多样性呈先降低后增加的趋势.门水平下,两者间的共有优势菌门为放线菌门、变形菌门、绿弯菌门、厚壁菌门和酸杆菌门,其中根际土壤放线菌门的相对丰度均值低于休耕地土壤,且随连作年限的增加而降低,而酸杆菌门的相对丰度均高于休耕地,并随着连作年限的增加而增加;属水平下,两者间的共有优势菌属为芽孢杆菌属和节杆菌属,其余优势菌属则各不相同.影响当归连作土壤细菌群落优势菌门的主要因素为土壤pH、电导率和全氮含量,影响优势菌属的主要因素为土壤pH、速效磷和全氮含量.细菌群落功能预测以代谢作用为主,三级功能层下当归根际土壤细菌群落主要基因功能的相对丰度随连作年限的增加而增高.
