组织蛋白酶L激活PKC信号加重TCE致敏小鼠肾脏损害
2022-08-04王燚灿洪依婷张家祥彭家乐朱启星
王燚灿,洪依婷,黄 猛,张家祥,王 峰,彭家乐,朱启星,3
职业暴露于三氯乙烯(trichloroethylene,TCE)的部分工人可出现类似于重症药疹样的皮肤黏膜损害,伴肝脏和肾脏等多脏器功能紊乱,在我国被定义为三氯乙烯药疹样皮炎(occupational medicamentosa-like dermatitis due to trichloroethylene,OMDT)[1-2]。尽管OMDT的发病率低,但其病死率可高达8.6%[3]。长期的糖皮质激素治疗导致患者出现多种并发症,严重影响患者预后[4]。肾脏损害是加重患者病情、影响预后的主要因素[5],然而目前关于OMDT肾脏损伤的内在机制尚不明确。
前期研究[6-7]表明,TCE致敏阳性小鼠同时存在肾小球和肾小管的结构和功能损害。近年来,大量研究[8-9]表明组织蛋白酶L(cathepsin L,CTSL)广泛参与多种肾脏疾病的发病过程,有望成为肾脏疾病治疗的新靶点。CTSL是半胱氨酸蛋白酶家族成员,在一定刺激下从溶酶体释放出,介导细胞死亡和蛋白质降解等生物学过程。研究[6]表明TCE致敏小鼠受损的足细胞中存在CTSL的过表达,药理学抑制CTSL的过表达可有效改善肾脏损害情况,但是其具体作用机制尚不明确。蛋白激酶C(protein kinase C,PKC)是组织蛋白酶的重要底物之一,可介导炎症和凋亡等生物过程[10]。该研究旨在探讨CTSL介导TCE致敏小鼠肾脏损伤的分子机制。
1 材料与方法
1.1 主要材料三氯乙烯(分析纯,货号:251402)、弗氏完全佐剂(FCA,货号:F5881)在美国Sigma公司购买;苏木精染液(货号:ZLI-9610)、伊红(货号:ZLI-9613)在北京中杉金桥生物公司购买;RIPA 裂解液(货号:P0013B)、苯甲基磺酰氟(PMSF,货号:ST505)、BCA蛋白浓度检测试剂盒(货号:P0012)和5X 蛋白上样缓冲液(货号:P0015L)在上海碧云天生物技术有限公司购买;4%多聚甲醛(货号:BL539A)和二抗(货号:BL003A,BL001A)在美国Biosharp公司购买;ECL发光液(货号:K-12045-D50)在美国Advansta公司购买;TUNEL染色试剂盒(货号:11772465001)在美国Roche公司购买;尿素氮(BUN,货号:C013-2-1)测定试剂盒购自南京建成生物工程研究所;在 CTSL(货号:sc-390385)、PKC(货号:sc-17804)、p-PKC(货号:sc-377565)的鼠单克隆抗体和CTSL抑制剂(货号:sc-364671)在美国Santa公司购买;β-actin单克隆抗体(货号:8457s)在美国CST公司购买,驴抗鼠IgG荧光二抗(货号:ab150108)在美国abcam公司购买。
1.2 实验动物分组与模型建立在安徽医科大学实验动物中心购买SPF级雌性BALB/c小鼠41只,6~8 周龄,体质量(16~18)g。待适应性饲养7天后随机将小鼠分为空白对照组5只、溶剂对照组5只、TCE处理组15只以及TCE+CTSLi处理组16只。空白对照组不做任何处理;溶剂对照组小鼠使用不含TCE的相同比例丙酮和橄榄油的混合溶液,其余处理与TCE处理组相同;TCE小鼠致敏模型按既往建模方法进行建立[11]:对小鼠背部剃毛,实验第1天对TCE处理组和TCE+CTSLi处理组小鼠进行皮下注射100 μl的50% TCE 溶液与等量FCA的混合液,在第4、7、10 天背部涂抹100 μl 50%的TCE 溶液,最后在第17、19 天对小鼠皮肤涂抹100 μl的30%TCE溶液分别进行初次和末次激发。TCE+CTSLi处理组在初末激发2 h前进行腹腔注射10 mg/kg剂量的CTSL抑制剂。末次激发24 h后进行小鼠皮肤致敏评分,末次激发72 h后,麻醉、处死小鼠,无菌取肾脏组织,用于组织病理学和相关蛋白的水平检测。
1.3 皮肤致敏反应视觉评分于末次激发24 h后,对小鼠的皮肤表现进行评分。具体评分标准为:① 0分:无反应;② 1分:散在或小块红斑;③ 2分:中度弥漫的红斑、轻微水肿;④ 3分:严重红斑、水肿。根据评分≥1分即评为致敏阳性组,反之评为致敏阴性组,即将TCE处理组和TCE+CTSLi处理组分为TCE致敏阳性组、TCE+CTSLi致敏阴性组、TCE+CTSLi致敏阳性组和TCE+CTSLi致敏阴性组。
1.4 免疫荧光将肾脏组织进行烤片,脱蜡,过碘酸阻断过氧化物酶(HRP)孵育20 min,PBS洗涤3次,枸橼酸抗原修复15 min,洗涤,0.5% Triton X-100在PBS中通透切片30 min,洗涤。血清封闭2 h,CTSL一抗(稀释比1 ∶400)于4 ℃过夜,24 h后,切片恢复至室温后,PBS洗涤后二抗(稀释比1 ∶1 000)避光孵育2 h,DAPI染核15 min,封片并拍照。
1.5 小鼠肾脏病理学检查取部分新鲜小鼠肾脏组织固定于4%多聚甲醛3 d,石蜡包埋制备肾脏组织蜡块,切片厚度为0.4 μm,以进行常规HE染色,显微镜观察组织病理学改变。
取新鲜小鼠肾皮质在2.5%戊二醛和1%锇酸中固定10 h后,按标准化制备程序制成标本,透射电镜观察肾细胞超微结构。
1.6 TUNEL染色TUNEL染色按照试剂盒说明书进行,蛋白酶K穿孔后,肾脏切片用TUNEL反应混合物在37 ℃孵育30 min,然后用DAB显色,显微镜拍照,Image J软件计算凋亡细胞率。
1.6 Western blot检测PKC、p-PKC蛋白表达水平新鲜肾脏组织在RIPA裂解液匀浆裂解后,提取总蛋白,并测定蛋白浓度。12.5% SDS-PAGE凝胶电泳结束后,200 mA恒流湿转3 h;PVDF膜在5%脱脂牛奶中室温封闭2 h,将膜与针对PKC(稀释比1 ∶1 000)、p-PKC(稀释比1 ∶1 000)和β-actin(稀释比1 ∶10 000)的抗体于4 ℃孵育过夜。第2天,PBST洗膜3次,10 min/次,二抗(稀释比1 ∶10 000)室温孵育2 h后,重复洗膜,化学发光仪显影,Image-Pro Plus software6.0软件分析条带光密度值。
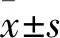
2 结果
2.1 小鼠皮肤致敏情况与肾脏病理学改变情况根据皮肤致敏反应对小鼠进行评分,具体如下:空白组与溶剂组小鼠背部均未见明显水肿和红斑,致敏评分均为0。TCE处理组致敏率为53.3%(8/15),其中评为1分的4只,评为2分的4只。TCE+CTSLi处理组致敏率为50.0%(8/16),其中评为1分的4只,评为2分的4只。且两组间小鼠致敏率无统计学差异(P>0.05)。
HE染色结果显示,空白对照组、溶剂对照组、TCE致敏阴性组和TCE+CTSLi致敏阴性组小鼠的肾小球与肾小管结构完整,未见明显病理学损伤。与溶剂对照组相比,TCE致敏阳性组小鼠的肾小管上皮细胞出现明显细胞水肿、空泡变性等。而TCE+CTSLi致敏阳性组小鼠较TCE致敏阳性组小鼠肾脏上述损伤减轻。经检测小鼠血清BUN水平发现,与其他组相比,TCE致敏阳性组(25.268±5.680)和TCE+CTSLi致敏阳性组(17.365±2.265)小鼠血清中的BUN水平升高,而TCE+CTSLi致敏阳性组较TCE致敏阳性组BUN的水平有一定程度下降,差异均有统计学意义(P<0.05,F=18.283);其他组BUN水平相对较低,差异无统计学意义(P>0.05),见图2。
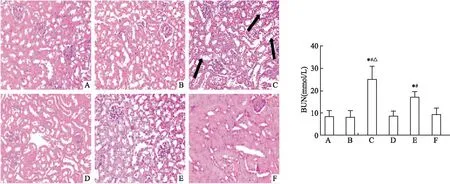
图1 各组小鼠肾脏病理改变情况 HE染色 ×400 图2 各组小鼠血清BUN水平
2.2 CTSL过表达对TCE致敏小鼠肾脏损害的影响本次研究结果发现CTSL在TCE致敏阳性组小鼠肾脏尤其在肾小球上高表达,见图3。电镜结果显示,TCE致敏阳性组小鼠肾小球滤过膜结构遭到破坏,基底膜增厚,且厚度不均,足细胞足突结构受损,出现融合、消失,线粒体水肿和空泡样变性,见图4。与TCE致敏阳性组相比,TCE+CTSLi致敏阳性组小鼠CTSL表达水平降低(P<0.05,F=82.438)、肾小球基底膜损伤程度减轻。
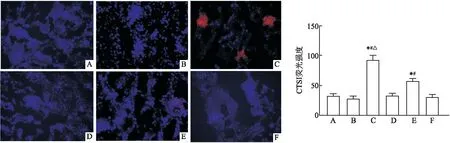
图3 不同组别小鼠肾脏CTSL表达情况
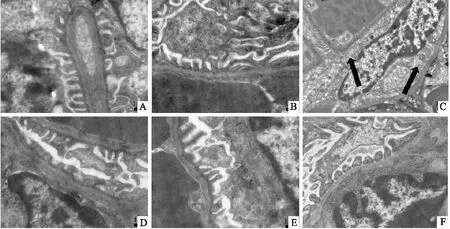
图4 不同组别小鼠肾脏形态学改变情况电镜 ×30 000
2.3 CTSL诱导TCE致敏小鼠肾脏结构细胞凋亡通过TUNEL染色评估CTSL诱导细胞凋亡的情况。结果显示:与空白对照组相比,溶剂对照组、TCE致敏阴性组、TCE+CTSLi致敏阴性组小鼠肾小球结构细胞凋亡比例未见明显异常,差异无统计学意义(P>0.05);与TCE致敏阴性组相比,TCE致敏阳性组小鼠肾小球凋亡细胞比例升高,差异有统计学意义(P<0.05);与TCE致敏阳性组相比,TCE+CTSLi致敏组小鼠肾小球凋亡细胞比例下降,差异有统计学意义(P<0.05)。不仅如此,肾小管细胞凋亡情况与肾小球相似,TCE致敏阳性组小鼠肾小管凋亡细胞比例高于其他各组(P<0.05),而TCE+CTSLi致敏阳性组小鼠肾小管凋亡细胞比例低于TCE致敏阳性组,见图5。以上结果说明,CTSL可以通过同时诱导肾小球和肾小管细胞凋亡,加重TCE致敏小鼠肾结构损害。
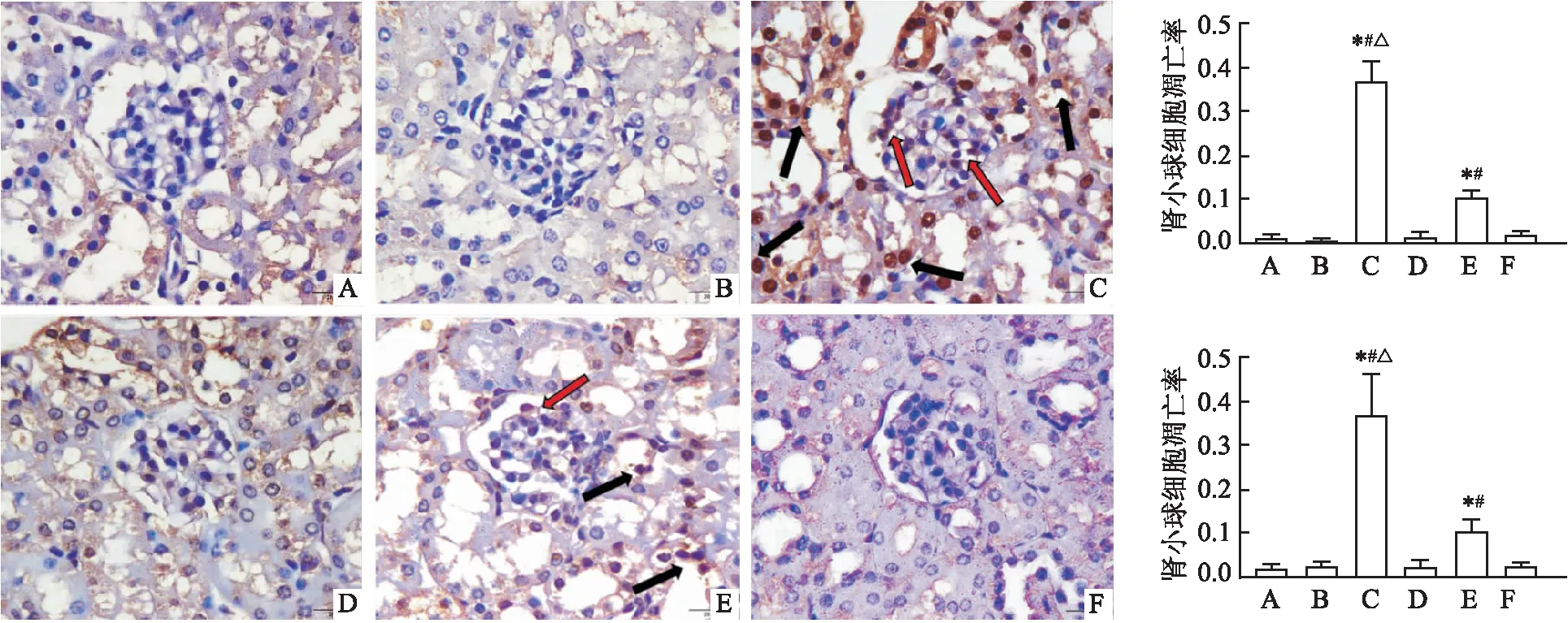
图5 不同组别小鼠肾脏结构细胞凋亡情况TUNEL染色 ×1 000
2.4 CTSL激活TCE致敏小鼠肾脏PKC信号分子Western blot检测结果表明,空白对照组、溶剂对照组、TCE致敏阴性组和TCE+CTSLi致敏阴性组中p-PKC蛋白的相对表达水平差异无统计学意义(P>0.05)。与其他各组相比,TCE致敏阳性组和TCE+CTSLi致敏阳性组的p-PKC的蛋白表达水平升高(P<0.05)。与TCE致敏组相比,TCE+CTSLi致敏阳性组p-PKC蛋白相对表达有所下降,差异有统计学意义(P<0.05,F=35.686),见图6。
3 讨论
作为OMDT常见并发症之一,TCE诱导的肾脏损害不仅会增加患者的治疗难度,而且严重影响患者预后[5,12]。近年来,多项研究[8-9]提示CTSL在多种自身免疫性肾脏疾病中发挥着关键作用。本研究表明药理学抑制TCE致敏阳性小鼠肾脏CTSL的过表达后,肾脏损伤减轻,提示CTSL有望成为OMDT肾脏损害临床治疗的潜在作用靶点。本课题组既往研究提示CTSL可能是TCE致敏所致肾小球损伤重要参与者,本次研究结果进一步显示,在TCE致敏阳性小鼠中肾脏过表达的CTSL与肾小球凋亡细胞水平呈正相关,抑制CTSL表达后,肾小球凋亡水平降低,提示过表达的CTSL可能是肾脏结构细胞凋亡的重要诱因之一。尽管病理学结果显示致敏阳性小鼠肾小球细胞的损害,然而过表达的CTSL是否破坏肾小球屏障结构还有待探究。
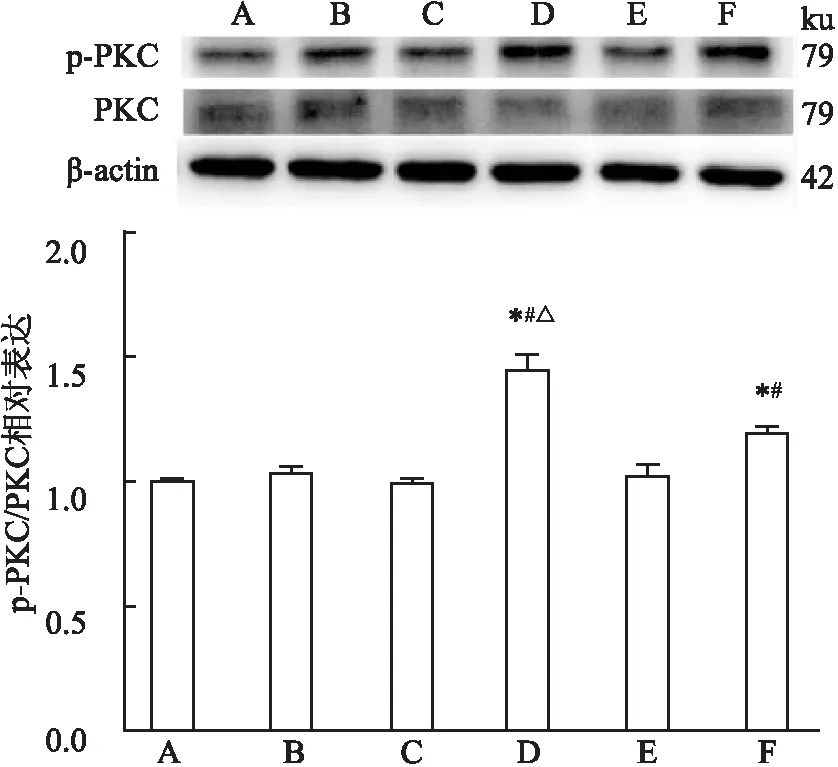
图6 不同组别小鼠肾脏PKC、p-PKC蛋白表达
虽然本研究发现CTSL主要表达于TCE致敏小鼠受损的肾小球,但是通过药理学抑制CTSL的表达后, TCE致敏所致的肾小管损伤同样有所减轻。课题组推测,CTSL可能是TCE致敏所致肾损伤中肾小球和肾小管对话的一个关键作用环节。肾小球-肾小管之间存在广泛的生物信息联系,存在许多共同的信号通路的参与,其串扰逐渐引起了广泛关注。由于球-管的特殊生理结构,肾小球分泌的包括血管内皮细胞生长因子、血管生成素-1、炎症因子在内的多种生物信息因子可通过旁分泌等途径作用于肾小管上皮细胞,导致其结构和功能发生不同程度的改变[13]。另一方面,肾小管炎症反应同样可以反过来损害肾小球的滤过功能,导致肾功能的下降。肾小球-肾小管的这种交互作用于信息传递在维系正常肾脏结构和功能中发挥重要作用,这种正常的生物信息传递的破坏也是多种肾脏疾病发病的分子机制。
慢性肾病的体外研究[14]表明细胞内白蛋白的超载可诱导内质网应激和激活PKC/p38 MAPK通路,介导足细胞凋亡。此外,PKC还是导致蛋白尿形成的关键分子,尿蛋白等生物大分子的过度运输不仅可加重肾小管负载,还可加重肾小管间质炎性损伤以及诱导RTECs凋亡。研究[15]显示药理学抑制PKC过表达可通过降低蛋白尿的生成,从而减轻肾小管负载和肾小管细胞凋亡的发生。本课题组前期研究[16]表明CTSL可通过切割补体C3,同时还可激活p38 MAPK和NF-κB通路。由此可见,PKC信号在串联肾小球-肾小管结构和功能中发挥关键作用。本研究中,蛋白免疫印迹结果显示TCE致敏阳性小鼠肾脏中PKC磷酸化水平明显升高,而CTSLi的预处理降低其表达。因此,推测在TCE致敏肾损害过程中,PKC可能是CTSL介导TCE所致肾小球和肾小管的损害过程中的一个关键作用分子。
综上所述,在TCE致敏过程中,过表达的CTSL可以通过激活PKC信号通路,诱导肾小球细胞和肾小管细胞凋亡,介导肾脏损害。药理性抑制CTSL的过表达可以明显改善TCE致敏所致小鼠肾脏损害,有望成为治疗OMDT肾脏损伤的潜在靶点之一。
