芹菜素对人肺鳞癌细胞NCI-H520增殖、转移、凋亡及自噬的影响
2022-08-04耿亚迪刘云霄谢彦博张欣格
刘 萍,耿亚迪,刘云霄,谢彦博,张欣格,张 蕾,,魏 伟
肺癌是全球发病率和病死率均居高位的一类癌症,其中,非小细胞肺癌(non-small cell lung cancer, NSCLC)是最常见的形式,肺鳞状细胞癌(lung squamous cell carcinoma, LUSC)是非小细胞肺癌的一种亚型,目前尚无特效的治疗方法[1]。芹菜素是一种天然的生物活性黄酮类分子,在乳腺癌、结肠癌、胃癌等人类癌症细胞系中被证明能抑制细胞增殖和诱导细胞凋亡[2],目前尚无关于芹菜素对人肺鳞癌细胞株NCI-H520作用的相关报道。
凋亡和自噬是细胞死亡的两种主要方式,许多化疗药物可以诱导细胞凋亡,当细胞受到外界刺激时,发生以目标细胞的形态变化为特征等的凋亡反应[3]。自噬是一个连续的过程,能够清除细胞内变性的蛋白质和受损的细胞器,产生大分子或者能量供细胞进一步重复使用[4]。该研究旨在观察芹菜素对人肺鳞癌细胞株NCI-H520增殖、转移的影响,并初步探讨芹菜素对NCI-H520细胞凋亡和自噬的作用。
1 材料与方法
1.1 药品与主要试剂芹菜素(Apigenin, APG) 、顺铂(cis-diamminedichloro-platinum, CDDP) 购自上海阿拉丁生化科技股份有限公司(货号:A106676、D109812);细胞增殖及毒性检测试剂盒(cell counting kit-8, CCK-8)购自大连美仑生物技术有限公司(批号:MA0218-2-Oct-11F);Hoechst 33258活细胞染色液(100×)、 细胞增殖示踪荧光探针(carboxyfluorescein diacetate, succinimidyl ester, CFDA SE)、BCA蛋白质测定试剂盒购自上海碧云天生物技术研究所(货号:C1018、C0051、P0010);Annexin V-FITC凋亡检测试剂盒购自美国BD公司(货号:556547);血清、胰酶和RPMI 1640培养基购自以色列BI公司(货号:04-001-1ACS、03-050-1ACS、01-100-1ACS);结晶紫购自天津市大茂化学试剂厂(CAS NO:548-62-9);p62多克隆抗体、GAPDH单克隆抗体购自武汉三鹰生物技术有限公司(货号:18420-1-AP、60004-1-Ig);微管相关蛋白1轻链3B-Ⅱ(microtubule-associated protein 1 light chain 3B-Ⅱ, LC3B-Ⅱ)、辣根过氧化物酶标记的山羊抗兔/鼠二抗购自美国Cell Signaling Technology(货号:3868T、7074P2、7056S);磷酸氯喹(chloroquine phosphate, CQ)购自美国MCE公司(货号:HY-17589);AO染色液购自上海麦克林生化科技有限公司(货号:A6009);Transwell小室购自美国Corning公司;24孔板购自美国NEST公司。
1.2 细胞培养NCI-H520细胞由中国科学技术大学附属第一医院(安徽省立医院)检验科提供,细胞用含10%胎牛血清、1%的青霉素和链霉素的RPMI 1640培养基,于37 ℃、5% CO2的培养箱中培养。细胞密度长至80%~90%时消化传代,用于后续实验。
1.3 药物配制用DMSO作为溶剂,将芹菜素溶于其中并配制成药物母液,实验中各组DMSO溶剂浓度不超过0.1%。在1 mg/ml的溶解度范围内,用超纯水配制成1 mmol/L的顺铂母液。药物分装后均于-20 ℃冰箱中避光保存。
1.4 细胞增殖水平测定
1.4.1CCK-8法检测芹菜素或顺铂对细胞活力的影响 将处在对数生长期的NCI-H520细胞以5×103个/孔细胞量接种至96孔板中,待细胞密度长至60%~70%时加入不同浓度的芹菜素(2.5、5、10、20 μmol/L)或顺铂(2.5、5、10、20 μmol/L)作为药物组分别作用24 h或48 h,同时设空白对照组,最后,吸净培基,加入100 μl配制好的10% CCK-8溶液,在细胞培养箱中孵育1~2 h后,使用酶标仪在450 nm波长处读取吸光度值。
1.4.2CFDA SE荧光探针检测芹菜素对细胞分裂能力的影响 荧光标记(1~5)×106个NCI-H520细胞,均匀种至6孔板中,3×105个/孔,随后可按照细胞的正常培养方法进行培养,细胞长至60%~70%时依序加入不同浓度芹菜素(5、10、20 μmol/L)或顺铂(2.5、5、10 μmol/L)培养48 h,用流式细胞仪检测荧光值大小。
1.5 细胞迁移、侵袭水平测定
1.5.1划痕实验检测芹菜素对细胞迁移能力的影响 用尺子和记号笔在6孔板的底部0.5~1 cm处均匀地画出水平线,然后将细胞以3×105个/孔的密度接种到6孔板中,在含有10%胎牛血清的RPMI 1640培基中培养,待细胞密度长至80%~90% 时用200 μl无菌移液管尖端制造垂直于水平线的划痕,加入不同浓度的药液,分别于0、24、48 h间隔时间在倒置显微镜下采集图像,观察各组细胞迁移情况。
1.5.2Transwell实验检测芹菜素对细胞迁移、侵袭能力的影响 Transwell迁移实验中,在10 cm培养皿中培养细胞,待细胞长至60%~70%时,加入不同浓度芹菜素(5、10、20 μmol/L),12 h后将含有200 μl无血清RPMI 1640培基的106个细胞接种到Transwell小室的上室中,并在下室中加入800 μl含有20%胎牛血清的RPMI 1640培基。72 h后,上室未迁移的细胞用棉签清洁,Transwell小室用多聚甲醛1 ml固定15 min,PBS漂洗3次,0.1%结晶紫1 ml染色20 min,染色结束后,PBS漂洗3次,在显微镜下对迁移的细胞进行拍照记录。细胞侵袭实验中,于聚碳酸酯膜的上侧涂有Matrigel胶,Matrigel胶加药前一晚与无血清RPMI 1640培基1 ∶7比例混合涂至上室,在24孔板中放置于37 ℃培养箱中,接种细胞前先用无血清培基水化基底膜30 min后,吸净无血清RPMI 1640培基再接种细胞。后续步骤同迁移实验。
1.6 细胞凋亡测定
1.6.1Annexin V/PI 双染法检测芹菜素对细胞膜磷酯酰丝氨酸外翻的影响 将对数生长期细胞以3×105个/孔细胞接种到6孔板中,用不同浓度的芹菜素(5、10、20 μmol/L)作用48 h后收集细胞,同时设空白对照组,用冷PBS洗涤2次,1 500 r/min, 离心5 min,用1 ml的1×Annexin V结合液对细胞进行重悬,吸取100 μl悬液(约1×105个细胞)转移到1.5 ml的离心管中,分别加入5 μl Annexin V和5 μl PI染液,室温避光孵育15 min,用流式细胞仪进行检测。
1.6.2Hoechst 33258染色实验检测芹菜素对细胞核的影响 将对数生长期的NCI-H520细胞以3×105个/孔细胞接种至6孔板中,加入不同浓度的芹菜素(5、10、20 μmol/L)作用48 h,同时设空白对照组。48 h后弃除药液,PBS清洗后用多聚甲醛固定,每孔加入1 ml Hoechst 33258染色液于培养箱中孵育15 min,PBS清洗2次,用荧光显微镜进行观察并拍照。
1.7 细胞自噬水平测定
1.7.1AO染色检测芹菜素对细胞内酸性细胞器的影响 不同浓度芹菜素(5、10、20 μmol/L)处理NCI-H520细胞48 h后,在胰酶中将细胞进行消化,用预冷的PBS洗涤细胞2次。细胞中加入含1 μg/ml AO染液的PBS溶液,在培养箱中孵育15 min,PBS洗涤细胞3次,用流式细胞仪对荧光强度进行统计分析。
1.7.2电镜检测芹菜素对细胞内自噬双分子层的影响 分组处理完毕的NCI-H520细胞制成细胞悬液并离心,加入预冷的2.5%戊二醛固定液于4 ℃固定12 h,经0.05% mol/L ph7.2的二甲胂酸钠-盐酸缓冲溶液漂洗后每管加入1滴1%锇酸固定液后固定1 h,将标本分别浸入30%、50%乙醇脱水各10 min,每管加入70%乙醇醋酸铀染色液放置3 h或过夜进行包埋前染色。将标本分别浸入80%、95%、100%乙醇和环氧丙烷各脱水10 min、15 min,两次50 min、30 min。浸透时,环氧丙烷 ∶环氧树脂=1 ∶1, 1~2 h;纯环氧树脂2~3 h。45 ℃烘箱12 h,再放入72 ℃烤箱24 h;取出包埋块修块后超薄切片、铜网捞片、电子染色(铅染色),最后用透射电镜观察及拍片。
1.7.3Western blot检测芹菜素对自噬相关蛋白的影响 分组处理完毕的NCI-H520细胞在蛋白质裂解缓冲液中裂解30 min,并在 4 ℃下以11 510 r/min, 离心15 min,蛋白质浓度用BCA蛋白质测定试剂盒定量,电泳、转膜结束后,用新鲜的5%脱脂牛奶在室温下封闭2 h。将膜与特异性一抗(p62、LC3B、GAPDH抗体稀释比例均为1 ∶1 000)在 4 ℃下孵育过夜,用TBST洗涤后,将膜与辣根过氧化物酶偶联的二抗(山羊抗兔、鼠二抗,比例为1 ∶10 000)于室温缓慢孵育1 h,将漂洗后的PVDF膜置于曝光仪中,滴加化学发光液,曝光并保存结果。
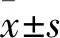
2 结果
2.1 芹菜素对NCI-H520细胞增殖能力的影响芹菜素(2.5、5、10、20 μmol/L)或顺铂(2.5、5、10、20 μmol/L)作用细胞48 h,图1A中的结果表明,相对于对照组细胞,芹菜素(F=7.256, 24 h;F=30.39, 48 h;P<0.05)或顺铂(F=2.507, 24 h;F=80.28, 48 h;P<0.01)抑制NCI-H520细胞活力并呈时间和浓度依赖性。在倒置显微镜下观察发现,空白对照组细胞贴壁生长、形态完整且边界清晰;随着芹菜素或顺铂作用浓度的增加,细胞皱缩,体积缩小,数目减少,见图1B。图1C显示,与空白对照组相比,荧光强度随着药物浓度的增加依次升高(F=4.799,F=76.24;P<0.05)。
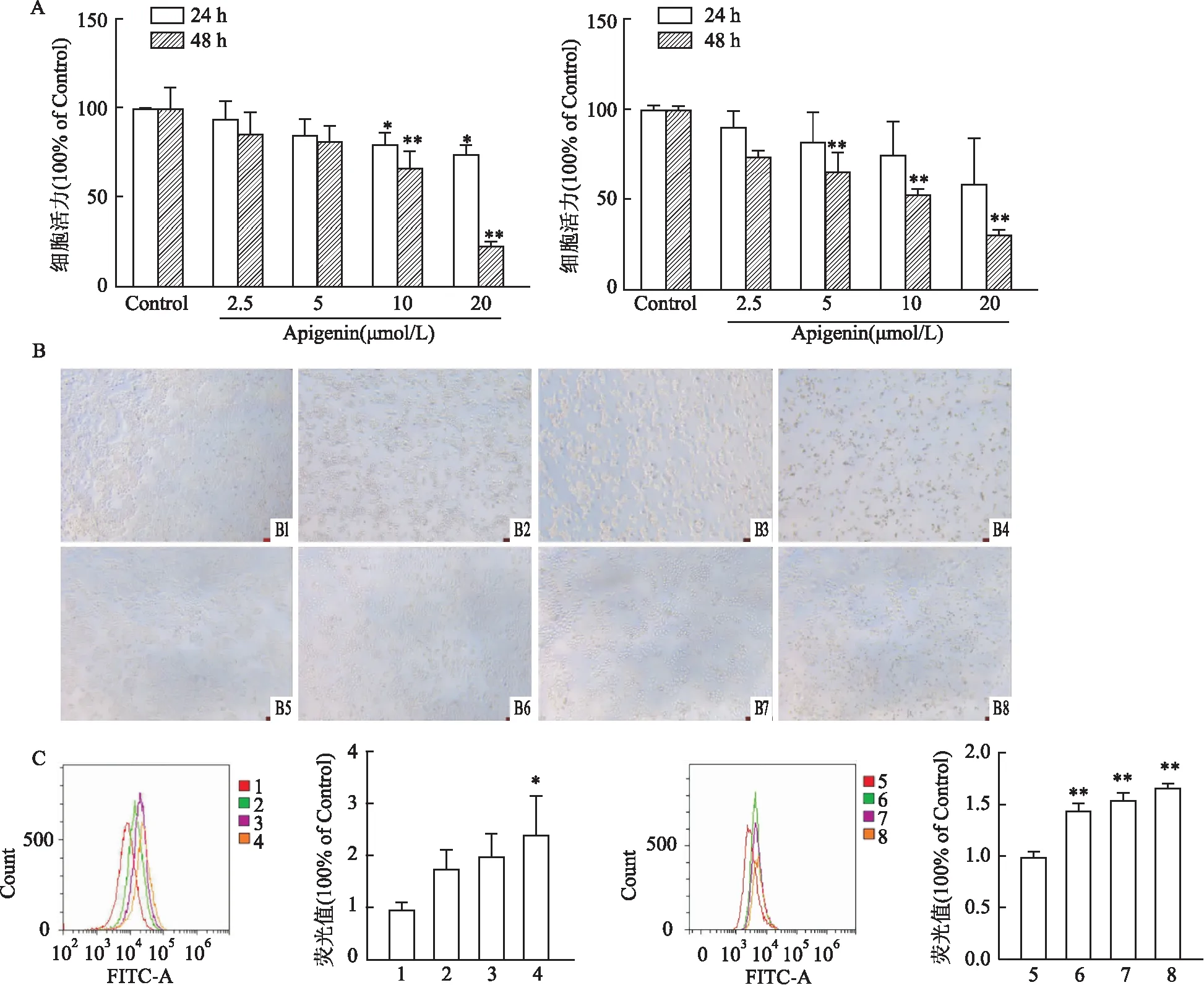
图1 芹菜素或顺铂对NCI-H520细胞增殖的影响
2.2 芹菜素对NCI-H520细胞迁移、侵袭能力的影响图2A结果显示,芹菜素加药组划痕愈合率较对照组下降,且48 h时更为明显,加药组的水平迁移能力受到了一定的抑制。Transwell实验(图2B、C)结果表明,与对照组相比,芹菜素加药组穿过小室的细胞数目有所减少,说明芹菜素对细胞的迁移能力(F=48.91,P<0.01)及侵袭能力(F=241.0,P<0.01)具有一定的抑制作用。
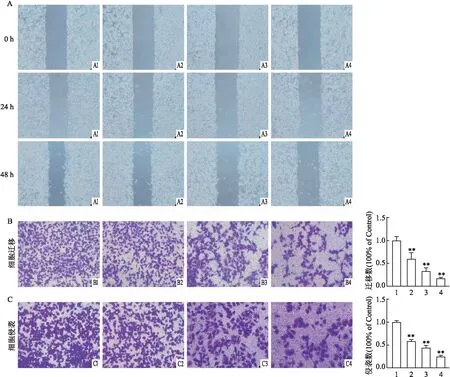
图2 芹菜素对NCI-H520细胞转移的影响
2.3 芹菜素诱导NCI-H520细胞凋亡作用图3A结果表明,与对照组相比,芹菜素加药组的细胞凋亡率增加,且呈现浓度依赖性(F=139.3,P<0.05)。在荧光显微镜下观察核染色情况,图3B显微镜观察结果显示,芹菜素加药组细胞核浓染并缩小,而空白对照组细胞无此现象。
图3 芹菜素对NCI-H520细胞凋亡的影响
2.4 芹菜素对NCI-H520细胞自噬作用的影响流式结果表明(图4A),芹菜素处理后,NCI-H520细胞中酸性细胞器的数量增加,差异有统计学意义(F=4.616,P<0.05)。电镜下观察(图4B),对照组细胞形态正常,胞体饱满,核膜、质膜完整,芹菜素加药组细胞肿胀,线粒体、内质网等细胞器出现碎片迹象,细胞内出现自噬双分子层样结构。Western blot检测结果显示(图4C),随着芹菜素浓度的增加,LC3B-Ⅱ蛋白表达水平升高,说明芹菜素诱导细胞内自噬体的增加(F=41.50,P<0.05),p62蛋白水平随着芹菜素浓度的增加而升高(F=27.39,P<0.01),加入自噬抑制剂CQ(5 μmol/L)后,芹菜素(20 μmol/L)组与芹菜素(20 μmol/L)联合自噬抑制剂CQ(5 μmol/L)组LC3B-Ⅱ、p62蛋白表达差异无统计学意义(F=38.4, NS;F=17.90, NS)。
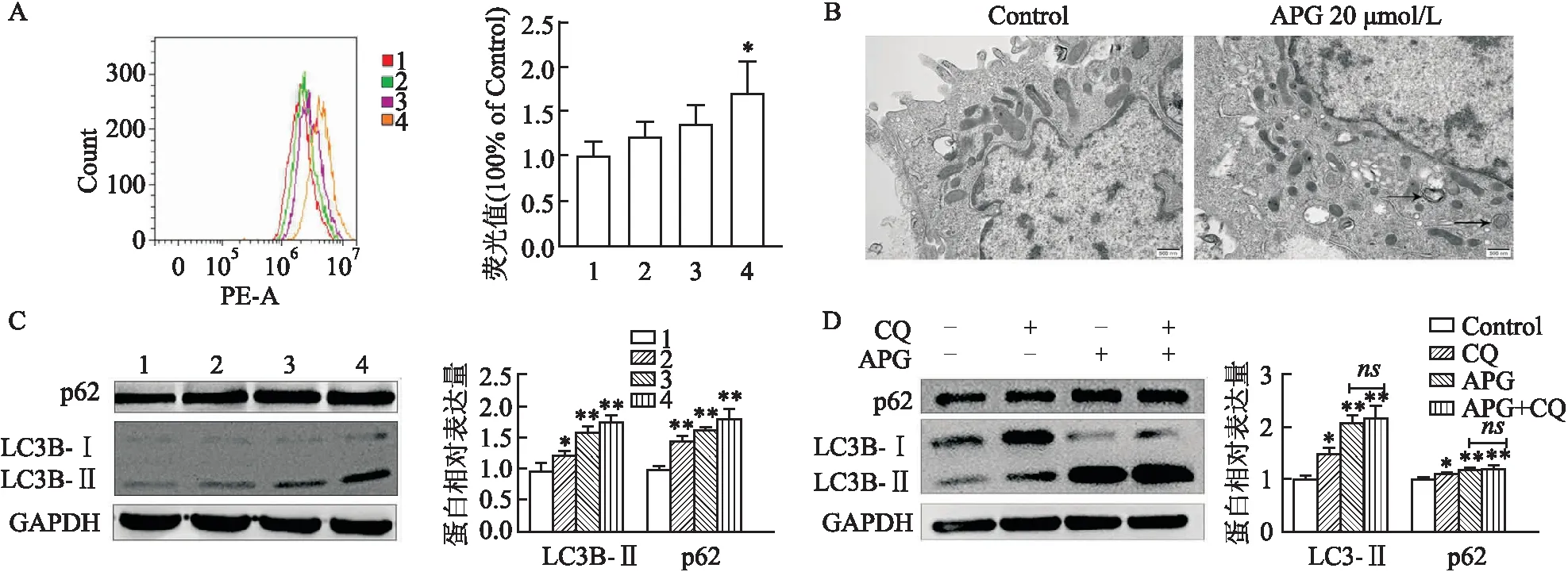
图4 芹菜素对NCI-H520细胞自噬水平的影响
3 讨论
作为一种天然黄酮类化合物,芹菜素具有低毒性和潜在的抗肿瘤药理作用,无论是单独使用还是与其他化疗药物联合使用,都在多种肿瘤中显示出潜在的抗癌作用[5],如:肝癌[6]、卵巢癌[7]、胶质瘤[8]等,同时在肿瘤耐药方面也有一定的作用[9]。文献[10]表明,芹菜素可以诱导癌细胞凋亡。凋亡被称为Ⅰ型程序性细胞死亡,细胞受到外界凋亡刺激后,通过细胞内发生信号级联反应,表现出如细胞变圆,体积缩小,结构更加紧密,脱离周围的细胞;胞浆浓缩,核染色质密度增高,核膜核仁破碎,膜内侧磷脂酰丝氨酸外翻到膜表面,胞膜出芽、脱落,包裹着细胞形成凋亡小体等一系列凋亡特征[11]。该研究表明芹菜素可以诱导细胞磷酯酰丝氨酸膜外翻,凋亡率增加,并促进细胞核固缩及染色质凝集,提示芹菜素可以诱导NCI-H520细胞凋亡。
自噬在肿瘤中所发挥的作用在近年来逐渐受到广泛的关注。自噬可以促进肿瘤的发生发展,同时也可以诱导肿瘤细胞死亡,因此也被称为Ⅱ型程序性细胞死亡。自噬过程中会形成自噬双分子层结构,该实验在电镜下观察,结果显示芹菜素可诱导细胞内自噬双分子层结构的形成。同时,在自噬的发生过程中,LC3B-I会转变成膜型LC3B-Ⅱ。该研究表明细胞内LC3B-Ⅱ蛋白水平升高。以上结果表明芹菜素可以诱导细胞内自噬体的生成。自噬的过程需要酸性细胞器溶酶体参与降解过程,AO是一种特异性染料,它能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光,也可以渗透进入酸性细胞器如自噬溶酶体[12]。AO流式结果表明,芹菜素可以引起细胞内酸性细胞器的增加,说明其促进了自噬的产生。
自噬是一个动态的过程,该实验检测p62蛋白的表达,以进一步验证自噬体增加的原因。自噬相关蛋白p62是一种支架蛋白和经典的接头蛋白,是自噬选择性底物,参与自噬体的降解[13]。该研究显示芹菜素可以诱导细胞内p62蛋白水平的升高,表明自噬体降解减少。在酸性溶酶体中,CQ会使溶酶体pH值升高,使溶酶体中酸性水解酶失活,从而抑制细胞内自噬溶酶体的融合与降解。CQ处理细胞会导致LC3B-Ⅱ的聚集,在CQ的存在下,细胞中LC3B-Ⅱ水平未能增加,表明芹菜素与CQ类似地可以阻断晚期自噬通量,而不是促进自噬启动。因此芹菜素诱导细胞自噬体的增加可能是由于抑制了自噬体的降解。
该研究用不同浓度的芹菜素处理人肺鳞癌细胞NCI-H520,初步探讨其对于细胞增殖、转移的影响以及可能的作用机制。该研究结果中,芹菜素作用于NCI-H520细胞后,细胞活力下降,分裂能力减弱,形态发生明显变化,迁移和侵袭的数量明显减少,表明芹菜素能够抑制人肺鳞癌细胞的增殖、迁移、侵袭能力,其抑制细胞的生长转移可能与诱导其凋亡和自噬有关。由于细胞及化合物的不同,自噬发挥不同的作用,因此自噬产生的具体机制有待进一步研究,以实现肿瘤的靶向治疗[14]。
