基于组合优化策略在毕赤酵母中高效表达杜邦嗜热菌脂肪酶
2022-08-04汪步青王亚森许向阳高晓冬藤田盛久李子杰
汪步青,陈 洲,王亚森,许向阳,高晓冬,藤田盛久,李子杰
(1.江南大学 生物工程学院,江苏 无锡 214122; 2.枣庄市杰诺生物酶有限公司,山东 枣庄 277100)
脂肪酶(EC 3.1.1.3)是一类广泛存在于动物、植物和微生物中的蛋白类酰基甘油水解酶,在自然条件下能够在油水混合界面催化油脂生成不同链长的游离脂肪酸、酯类和甘油等物质,而在非水相体系中参与催化酯交换、酯化、酸解和氨解等多种类型反应[1-2]。脂肪酶具有催化效率高、反应过程温和、对底物的特异性催化活力等特性,被广泛应用于食品、洗涤剂、造纸、生物能源和生物医药等工业领域[3-5]。
杜邦嗜热菌(Thermomycesdupontii)脂肪酶,即Talaromycesthermophilus脂肪酶(LIP1),是一种碱性脂肪酶,因其极高的热稳定性而广受关注,LIP1的最适催化温度为60℃,并且经70℃水浴处理1 h依旧保持50%以上的催化活性[6]。研究表明,LIP1在许多工业生产中具有应用潜力[6-8]。Romdhane等[6]研究发现,LIP1在碱性pH和不同的表面活性剂中具有良好的稳定性,有助于其作为添加剂在洗涤剂中的应用。同时,LIP1具有优异的催化酯交换活性,有助于其在生物柴油生产中的应用[7]。此外,随着对LIP1研究的开展,其显示出具有制备手性药物中间体的潜力[8]。然而杜邦嗜热菌培养过程复杂,LIP1发酵酶活低,生产成本过高,无法实现产业化。因此,实现LIP1高效表达尤为重要。
巴斯德毕赤酵母(Pichiapastoris)异源表达系统由于其高效表达水平、强大的分泌能力、完善的诱导表达方法以及成熟的高密度发酵能力被广泛应用于重组蛋白的表达[9-10]。研究发现,LIP1在毕赤酵母中的摇瓶分泌酶活为156 U/mL,是其在杜邦嗜热菌中的2.6倍[9]。因而,采用毕赤酵母表达系统是一种有效提高LIP1表达的方法。此外,据以往的研究可知,优化提升毕赤酵母高效表达效率的手段有很多,但大多数文献报道的都是单因素或双因素优化,总体的分泌表达水平提升不明显;而采用组合优化策略包括密码子偏好性优化、外源基因拷贝数的积累、更换分泌作用更强的信号肽、分子伴侣共表达优化用于过表达辅助蛋白从而促进目的蛋白修饰和分泌、强启动子优化以及高密度发酵进一步提高重组表达效率[11-14],可获得高水平分泌表达LIP1的重组菌株。
综上,本研究采用组合优化策略提高LIP1在毕赤酵母中的表达水平。首先,将LIP1密码子偏好性优化基因,连接至含醇氧化酶(AOX1)强启动子的质粒载体pPIC9K中,电击转化后成功构建筛选出含多拷贝LIP1基因的异源表达重组酵母菌株;在此基础上,研究了不同信号肽优化以及分子伴侣共表达对LIP1分泌表达的影响;最后,将优化筛选出的重组菌株进行高密度发酵,实现LIP1在重组酵母中高效表达和积累。总之,在本研究中,借助毕赤酵母表达体系,利用基因工程技术提高LIP1的表达量,对促进其实现产业化应用具有重要意义。
1 材料与方法
1.1 试验材料
大肠杆菌(Escherichiacoli)DH5α、毕赤酵母GS115,江南大学糖化学与生物技术教育部重点实验室;表达载体pPIC9K和pPICZA,美国Invitrogen公司;DNA聚合酶、连接酶、限制性内切酶等工具酶,美国Thermo Scientific公司;其他常规试剂,国药集团; 不同链长的对硝基苯酚酯(C4、C8、C10、C12、C14和C16),北京索莱宝科技有限公司;引物,无锡天霖生物有限公司。
LB、MD、YPD、BMGY、BMMY和BMMY-罗丹明B等培养基参考Invitrogen公司的毕赤酵母表达手册配制。
压力蒸汽灭菌锅(立式);无菌操作台;台式水平恒温摇床;5 L发酵罐;甲醇检测流加监控器;SDS-PAGE 凝胶电泳仪、核酸凝胶电泳仪和Western Blot快速转膜系统,美国Bio-Rad公司。
1.2 试验方法
1.2.1 载体构建和毕赤酵母转化
基因合成:LIP1基因(JF414585.1)由前体肽识别序列和成熟肽编码序列构成,含HA标签,经毕赤酵母密码子偏好性优化后[15],由无锡天霖生物有限公司合成至质粒载体PUC57中。
重组质粒载体构建:将pPIC9K和PUC57用EcoR I和NotI进行双酶切,采用DNA胶回收试剂盒进行纯化,并用T4DNA连接酶连接,热激转入E.coliDH5α中后成功构建表达载体pPIC9K-LIP1。
毕赤酵母转化:将表达载体pPIC9K-LIP1经SalI线性化、回收和浓缩后,电击转化至毕赤酵母GS115中,涂板于MD平板上。2~3 d后将MD平板中的转化子,依次挑至含不同质量浓度(0.5、1.0、2.0、3.0 mg/mL)G418(遗传霉素)的YPD平板,30℃培养2~3 d后,筛选出含多拷贝基因的重组菌株。并将获得的重组菌株接种于BMMY-罗丹明B定性筛选平板中,30℃培养3~4 d后筛选出透明圈大(脂肪酶水解油脂产生透明圈)的菌株用于进一步的LIP1的表达和检测。
1.2.2 脂肪酶在毕赤酵母中的高效表达策略
信号肽优化:根据毕赤酵母密码子偏好性优化设计信号肽D1 signal sequence (D1ss)、D2 signal sequence(D2ss)、FLD1 signal sequence(Fss)、MFH4 signal sequence(Mss)、W1 signal sequence(Wss)、Glucoamylase signal sequence(Gss)的基因序列,并根据上述信号肽的基因序列为模板设计引物扩增出信号肽,并经过BamH I和EcoR I 双酶切后用T4DNA连接酶连接至pPIC9K-LIP1,替换质粒pPIC9K中的α-factor信号肽,构建出质粒pPIC9K-D1ss-LIP1、pPIC9K-D2ss-LIP1、pPIC9K-Fss-LIP1、pPIC9K-Mss-LIP1、pPIC9K-Wss-LIP1和pPIC9K-Gss-LIP1。并参考1.2.1的方法进行毕赤酵母转化,筛选出酶活高的重组菌株,作为出发菌株。
分子伴侣共表达优化:首先,在NCBI网站中获得分子伴侣BMH2 (XM_002490942.1)、HAC(XP_002490039.1)、KEX2(XM_002491154.1)、SSA4(XM_002493814.1)、PDI(CAC33588.1)和UBC1(XM_002492398.1)的基因序列,并依据基因序列设计引物,以提取的毕赤酵母GS115基因组为模板,扩增出相应的分子伴侣片段。并经过BamH I和EcoR I 酶切后用T4DNA连接酶连接至pPICZA中,构建出质粒pPICZA-BMH2、pPICZA-HAC、pPICZA-KEX2、pPICZA-SSA4、pPICZA-PDI、pPICZA-UBC1。采用SalI线性化pPICZA-BMH2、pPICZA-KEX2、pPICZA-SSA4和pPICZA-UBC1,SacI线性化pPICZA-HAC和pPICZA-PDI,回收和浓缩后,电击转化至出发菌株中,并参考1.2.1的方法进行毕赤酵母转化,筛选出酶活高的重组菌株。
1.2.3 毕赤酵母摇瓶发酵
将筛选出的重组菌株接种于5 mL的YPD培养基中,30℃培养12 h,将菌液按4%接种量转接至50 mL的BMGY培养基中,30℃摇床培养至OD600为20左右,离心收集菌体,使用50 mL无菌水(预冷)洗两遍并离心收集,重悬于50 mL的BMMY培养基中,28℃发酵培养,每24 h加入1%的甲醇诱导,同时取上清液,采用SDS-PAGE和Western Blot检测LIP1的蛋白表达,并测定酶活。
1.2.4 5 L发酵罐高密度发酵
将采用组合优化策略筛选出的重组菌株接种于10 mL的YPD培养基中,30℃培养12 h,取菌液按4%接种量转接至200 mL的BMGY培养基中,30℃培养24 h,作为发酵种子液。将发酵种子液接种于含2 L BSM无机盐培养基的5 L发酵罐中,采用50%磷酸和氨水自动流加调节pH,保持pH为5.5,温度为30℃。待BSM无机盐培养基中甘油消耗完全,溶氧反弹后,保持发酵pH和温度不变进入流加甘油培养阶段,采用DO-Star方式流加甘油,待湿重达到220 g/L以上时,停止甘油流加并饥饿处理30 min后,进入流加甲醇诱导阶段。此时,调节pH至6.0,温度至27℃,将甲醇缓慢流加至培养液中,通过甲醇检测器检测发酵液中的甲醇含量,每隔24 h取样检测OD600、细胞干质量、脂肪酶的蛋白表达水平及上清LIP1酶活,甲醇诱导7 d后,停止流加甲醇,发酵结束。
1.2.5 重组脂肪酶的活性检测
LIP1活性检测采用碱滴定法[16]。在50 mL三角瓶中,依次加入5 mL Tris-HCl(50 mmol/L,pH 10.0)和4 mL高速匀浆机处理的橄榄油与聚乙烯醇乳化液(橄榄油与聚乙烯醇比例1∶3),在60℃水浴中预热5 min。加入1 mL 60℃预热稀释的发酵上清液(空白组加入60℃预热的1 mL Tris-HCl),在60℃水浴中反应10 min后,立即加入15 mL 95%乙醇溶液终止反应。向三角瓶中滴入2滴酚酞指示剂,采用0.05 mol/L NaOH标准溶液进行滴定,直至液体呈微红色并保持30 s内不褪色,记录消耗的NaOH标准溶液的体积。单位LIP1酶活力以每分钟产生1 μmol游离脂肪酸的所需酶量表示。
1.2.6 重组脂肪酶的底物特异性检测
重组脂肪酶LIP1的底物特异性采用比色法[17]测定。在1.5 mL EP管中加入80 μL Tris-HCl(50 mmol/L,pH 7.5),依次加入10 μL稀释至200 U/mL的1.2.3发酵上清液和10 μL不同链长的对硝基苯酚酯(C4、C8、C10、C12、C14和C16),35℃反应5 min,最后加入100 μL 1%的SDS溶液终止反应,在405 nm下测定吸光值,以测定酶活最高时底物下的酶活为100%,计算其他底物下的相对酶活。
1.2.7 数据处理
所有试验进行3次平行,结果以平均值表示。采用Origin 8.1软件对数据进行作图,同时进行单因素方差分析。
2 结果与分析
2.1 载体构建和毕赤酵母转化
按1.2.1方法进行载体的构建和毕赤酵母转化,菌落PCR验证和BMMY-罗丹明B平板筛选结果见图1。

注:M.DNA Marker;1.特异性引物PCR验证产物(图A);1.毕赤酵母阳性转化子菌落PCR(图B);CK.GS115/pPIC9K(图C);1~13.GS115/pPIC9K-LIP1(图C)
由图1A可看出,LIP1(含HA标签)全长为870 bp,与重组质粒经LIP1上下游特异性引物PCR获得的条带大小一致,说明重组质粒载体pPIC9K-LIP1构建成功。由图1B可看出,经G418的YPD平板梯度筛选出的含多拷贝基因重组菌株,采用pPIC9K通用引物进行菌落PCR验证发现,结果与预期相符。由图1C可看出,重组菌株经BMMY-罗丹明B平板培养,平板上出现大小不一的透明圈,筛选存在最大透明圈的菌株用于LIP1的表达。
2.2 脂肪酶在毕赤酵母中的表达
将1.2.1经BMMY-罗丹明B平板筛选的透明圈最大的重组酵母菌株GS115/pPIC9K-LIP1按1.2.3方法发酵,发酵上清液进行SDS-PAGE分析,并以HA为标签,进行Western Blot分析,结果如图2所示。由图2A可看出,重组菌株在约32 kDa处出现条带,与目的蛋白大小相符,通过碱滴定法测定LIP1的酶活达到576 U/mL。由图2B可看出,在32 kDa位置确实存在条带。因此,结合SDS-PAGE和Western Blot分析结果表明LIP1在毕赤酵母中成功表达。

注:M. Marker; 1.发酵上清液中的LIP1
2.3 信号肽对脂肪酶在毕赤酵母中表达水平的影响
为提高LIP1在毕赤酵母中的分泌效率,本研究优化了LIP1的分泌型信号肽,如表1所示。

表1 本研究所用的信号肽
由表1可知,选取6种毕赤酵母同源的分泌型信号肽,成功构建出6株不同信号肽替换优化的重组毕赤酵母菌株GS115/pPIC9K-D1ss-LIP1、GS115/pPIC9K-D2ss-LIP1、GS115/pPIC9K-Fss-LIP1、GS115/pPIC9K-Mss-LIP1、GS115/pPIC9K-Wss-LIP1和GS115/pPIC9K-Gss-LIP1。采用BMMY-罗丹明B平板进行筛选,挑选透明圈最大的转化子按1.2.3方法进行摇瓶发酵。发酵上清液中LIP1的蛋白表达水平和酶活测定结果如图3所示。

注:M. Marker;CK. GS115/pPIC9K-LIP1;1.GS115/pPIC9K-D1ss-LIP1;2.GS115/pPIC9K-D2ss-LIP1;3.GS115/pPIC9K-Fss-LIP1;4.GS115/pPIC9K-Mss-LIP1;5.GS115/pPIC9K-Wss-LIP1;6.GS115/pPIC9K-Gss-LIP1
由图3可看出,信号肽D1ss、D2ss、Fss、Mss优化菌株均在32 kDa处有条带,且信号肽D1ss、D2ss及Mss均可促进LIP1的分泌表达,对应的发酵上清液中LIP1酶活分别达到674、640、835 U/mL,是出发菌株GS115/pPIC9K-LIP1(CK)酶活的1.17、1.11 倍及1.45倍,其中信号肽Mss的分泌效果最强。因此,筛选菌株GS115/pPIC9K-Mss-LIP1进行下一步的优化试验。
2.4 分子伴侣对脂肪酶在毕赤酵母中表达水平的影响
以GS115/pPIC9K-Mss-LIP1作为出发菌株,按1.2.2分子伴侣共表达优化方法成功构建6株共表达不同分子伴侣的重组毕赤酵母菌株GS115/pPIC9K-Mss-BMH2-LIP1、GS115/pPIC9K-Mss-HAC-LIP1、GS115/pPIC9K-Mss-KEX2-LIP1、GS115/pPIC9K-Mss-SSA4-LIP1、GS115/pPIC9K-Mss-PDI-LIP1和GS115/pPIC9K-Mss-UBC1-LIP1,并采用BMMY-罗丹明B平板进行筛选,挑选透明圈最大的转化子按1.2.3方法进行摇瓶发酵。以GS115/pPIC9K-Mss-LIP1菌株作为对照,测定发酵上清液中LIP1的蛋白表达水平及酶活,结果如图4所示。
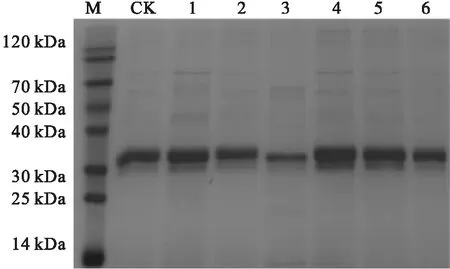
注:M. Marker;CK. GS115/pPIC9K-Mss-LIP1;1.GS115/pPIC9K-Mss-BMH2-LIP1;2.GS115/pPIC9K-Mss-HAC-LIP1;3.GS115/pPIC9K-Mss-KEX2-LIP1;4.GS115/pPIC9K-Mss-SSA4-LIP1;5.GS115/pPIC9K-Mss-PDI-LIP1;6.GS115/pPIC9K-Mss-UBC1-LIP1
由图4可看出:6种分子伴侣共表达菌株均在32 kDa处有条带,其中分子伴侣SSA4、BMH2、HAC以及PDI均可促进LIP1的分泌表达,对应发酵上清液中LIP1酶活分别达到1 136、970、885 U/mL和1 030 U/mL,分别为出发菌株的1.36、1.16、1.05 倍和1.23 倍,分子伴侣SSA4效果最好;而KEX2和UBC1的共表达抑制了LIP1的分泌,降低了LIP1的酶活。总之,基于组合优化策略,依次经过密码子偏好性优化、目的基因多拷贝、信号肽优化以及分子伴侣共表达优化,最终筛选出一株脂肪酶活性最高的菌株GS115/pPIC9K-Mss-SSA4-LIP1,其酶活达到1 136 U/mL,是已报道的未经过组合策略优化的LIP1表达于毕赤酵母中酶活[9]的7.28倍。说明本研究采用的组合优化策略能显著提高LIP1在毕赤酵母中的表达水平。
2.5 重组毕赤酵母的高密度发酵
重组酵母在发酵罐中高密度发酵,是进一步提高LIP1重组表达效率的有效方法。Xu等[18]利用3 L发酵罐发酵培养皱褶念珠菌脂肪酶的酵母重组菌,在高密度发酵130 h后,脂肪酶活性达到13 490 U/mL,相对于摇瓶培养提高了7.67倍。按1.2.4方法利用5 L发酵罐对GS115/pPIC9K-Mss-SSA4-LIP1菌株进行高密度发酵,每隔24 h取样,测定重组菌株的OD600、细胞干质量、脂肪酶的蛋白表达水平及酶活,结果如图5所示。

注:M. Marker;24、48、72、96、120、144、168 h分别为甲醇诱导时间
由图5可看出,随着诱导时间延长,重组LIP1的酶活和蛋白表达水平逐渐增加,当诱导时间达到144 h时,重组LIP1的酶活最高,达到12 150 U/mL,是摇瓶发酵酶活的10.7倍,说明高密度发酵实现了LIP1在重组酵母中高效表达和积累。随着诱导时间的延长,重组菌株的OD600和细胞干质量也在不断增加,在诱导时间为168 h时,细胞干质量达到最大,为120.5 g/L。总之,基于组合优化策略的实施,可在发酵上清液中获得大量重组LIP1(见图5A),有利于重组LIP1进一步在产业化生产中的分离和纯化。
2.6 重组脂肪酶的底物特异性(见图6)

图6 重组LIP1的底物特异性
脂肪酶特殊的底物特异性很大程度上决定了其在工业化中应用的领域[19]。由图6可看出:重组LIP1对不同链长的对硝基苯酚酯的水解能力差异很大,其对中链脂肪酸底物(C8和C10)呈现较高活性,最适底物为C8链长的对硝基苯酚酯;而当底物碳链长度大于12或低于8时,重组LIP1的催化活力显著降低,表明重组LIP1对中链底物具有特异性的亲和力,能够特异性地水解生成大量的中链脂肪酸。由于中链脂肪酸独特的生理生化功能,常应用于医药、保健食用油及养殖业等领域[20],因而重组LIP1在中链脂肪酸的工业化生产中具有潜在的应用价值。
3 结 论
通过对杜邦嗜热菌来源的脂肪酶密码子的偏好性进行优化,结合G418高浓度抗性筛选和BMMY-罗丹明B平板筛选,获得了一株脂肪酶活性较高的重组酵母菌株GS115/pPIC9K-LIP1,其酶活为576 U/mL;然后,通过信号肽优化和分子伴侣共表达优化,获得一株高效表达脂肪酶的毕赤酵母菌株GS115/pPIC9K-Mss-SSA4-LIP1,其酶活达到1 136 U/mL;采用5 L发酵罐进行高密度发酵,诱导144 h后,脂肪酶酶活最高,达到12 150 U/mL,是摇瓶发酵的10.7倍。通过测定重组脂肪酶的底物特异性发现,其对中链(C8)底物的对硝基苯酚酯存在特异性的催化活性。后续研究将基于对高密度发酵进行优化,进一步提高LIP1的重组表达水平,为重组LIP1规模化生产和产业化应用奠定基础。
